Випробування лікарських засобів на чистоту та граничний вміст домішок.
Кількість годин: 2 год.
Курс : III
Випробування лікарських засобів на чистоту та граничний вміст домішок.
Практично всі лікарські речовини мають у своєму складі сторонні домішки. Випробування на чистоту є важливою частиною контролю якостi лiкарських засобiв, оскiльки наявнiсть домiшок може не лише знизити фармакологiчний ефект i виявити протилежну дiю, а й зробити їх токсичними чи небезпечними для здоров’я. Причини виникнення домішок в ЛЗ можуть бути різні і не є випадковою величиною та носять цілком закономірний характер.
Джерела та причини забруднення ЛЗ домішками:
1. Технологічний процес добування (в процесі одержання ЛЗ):
недостатня чистота вихідних продуктів, які застосовуються при синтезі;
утворення побічних продуктів у процесі синтезу;
екстракція сторонніх речовин із лікарської рослинної сировини;
залишки розчинників;
домішки речовин, з яких виготовлена апаратура (важкі метали та арсен).
2. Навколишнє середовище (вплив О2, СО2, вологи, світла та інших чинників).
3. Порушення правил зберігання ліків (в результаті неправильного зберігання):
розклад лікарської речовини при неправильному зберіганні або забруднення продуктами розкладу таропакувальних матеріалів.
Наприклад: металічна апаратура може слугувати джерелом таких небезпечних домішок в ЛЗ, як свинець (з посуду), залізо, мідь, інколи цинк і найбільш небезпечна домішка – арсен.
При недбалому очищенні в лікарських засобах можуть міститися домішки розчинників, волокна тканин або фільтрувального паперу, пісок, азбест тощо, а також залишки кислот і лугів.
Синтетичні лікарські речовини здебільшого містять домішки вихідних, проміжних та побічних продуктів органічного синтезу, а лікарські речовини, які добувають з рослинної та тваринної сировини, нерідко мають домішки сторонніх екстрактивних речовин.
Важливе значення мають домішки, які з`являються внаслідок неправильного зберігання лікарських засобів. Коли не були враховані властивості або порушені умови зберігання, відбувається розкладання лікарського засобу, нерідко з утворенням продуктів, небезпечних для організму.
Таким чином, невідповідні умови зберігання можуть бути причиною недоброякісності лікарських засобів.
Фактори, під впливом яких лікарські засоби можуть змінюватись, називаються факторами нестабільності.
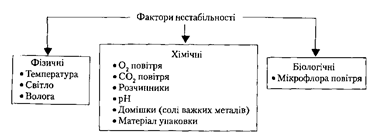
Процеси, що відбуваються при зберіганні ЛЗ та властивості лікарських засобів:
Хімічні процеси:
1. Переміщення електронів – окисники відновлюються (розкладаються під дією світла), відновники окиснюються;
2. Переміщення протонів – речовини амфотерного, кислого та основного характеру гідролізуються, речовини основного характеру також можуть вилуговуватися та взаємодіяти з діоксидом карбону.
Фізичні процеси пов`язані зі зміною енергії зв`язку :
легкорозчинні речовини поглинають воду із повітря;
низькомолекулярні, низькокиплячі, малодисоціюючі речовини здатні сублімуватися;
кристалогідрати вивітрюються.
Як приклад можна навести зміни, які відбуваються при неправильному зберіганні препаратів, які за структурою є складні ефіри ( ацетилсаліцилова кислота, атропіну сульфат) – в умовах вологи вони можуть гідролізуватися, при цьому не тільки знижується лікувальний ефект ЛЗ, але й продукти гідролізу можуть бути токсичними.
Найбільш частим типом гідролізу є гідроліз солей.
Гідроліз солей, утворених слабкою основою і сильною кислотою, підсилюється під час стерилізації та розведення розчинів. Посилення гідролізу відбувається також при підлужнюванні розчину силікатами лужних металів, які входять до складу скла. Такі розчини стабілізують додаванням розчину кислоти хлористоводневої.
Гідроліз солей, утворених сильною основою і слабкою кислотою, посилюється в кислому середовищі, тому для стабілізації (пригнічення гідролізу) додають розчин натрію гідроксиду або натрію гідрокарбонату.
Окиснення ЛЗ при зберіганні може проходити під дією світла та кисню повітря. Наприклад, встановлено, що в процесі виготовлення розчинів таких речовин, як аскорбінова кислота, адреналіну гідротартрату тощо, та їх теплової стерилізації відбувається їх окиснення з утворенням токсичних продуктів. На практиці використовують різноманітні методи, які уповільнюють процеси окиснення:
- використання інгібіторів окислювального процесу;
- застосування комплексоутворювачів;
- використання кислоти хлористоводневої або буферних розчинів для зниження рН ( гідроксид-іони каталізують швидкість реакції окиснення).
Дуже важливо додержуватися визначених умов зберігання для тих препаратів, які містять кристалізаційну воду, особливо для ЛЗ, в склад яких входять отруйні речовини. Так, якщо в препараті арсену- натрії арсеніті NaHAsO4•7H2O вивітриться кристалізаційна вода, а дозування йде з розрахунку на 7 молекул води в препараті, то при тому ж дозуванні хворий отримає більшу кількість арсену, ніж це потрібно для лікувального ефекту, що може призвести до отруєння організму.
Необхідно пам`ятати, що під впливом різних факторів (факторів нестабільності) лікарські засоби через деякий час можуть змінюватись.
Ознаки і причини нестабільності:
зміна маси → сублімація, взаємодія з CO2, H2O повітря ;
руйнування кристалів→ вивітрювання ;
зволоження, розплавлення кристалів → поглинання води повітря ;
зміна кольору →окиснення, розкладання;
зміна рН середовища → всі перечислені чинники та гідроліз ;
утворення осаду → взаємодія з CO2 повітря, гідроліз, розкладання ;
поява стороннього запаху → окиснення, гідроліз, розкладання.
Для підвищення стабільності лікарських засобів використовують різні способи.
Так для стабілізації ЛЗ використовують два методи – фізичний та хімічний.
Методи фізичної стабілізації базуються на захисті лікарських речовин від неблагоприємної дії зовнішнього середовища ( тара, умови зберігання та ін.).
Методи хімічної стабілізації базуються на введені в ЛЗ особливих допоміжних речовин – стабілізаторів, які забезпечують стабільність фізико-хімічних, мікробіологічних властивостей та біологічної активності. Хімічна стабілізація має велике значення для ЛЗ, які підлягають стерилізації (особливо термічній).
Властивості лікарських засобів і способи підвищення їх стабільності:
Методи хімічної Методи фізичної
стабілізації стабілізації
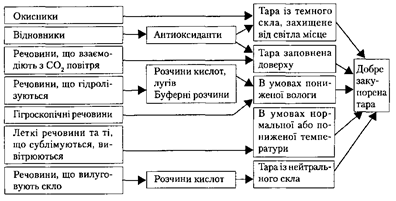
Також широко використовують протимікробні стабілізатори або консерванти.
Консерванти – допоміжні речовини, які застосовують для попередження контамінації (потрапляння) та розмноження мікроорганізмів в ЛЗ. Наприклад, в офтальмологічних лікарських формах застосовують консервант неорганічної природи – борну кислоту.
Державна фармакопея не вимагає абсолютної чистоти лікарського засобу , але допускає в ньому певні домішки в суворо визначених межах. Ця допустима межа визначається фізіологічною дією домішки на організм та впливом її на властивості лікарського засобу.
Тому в різних лікарських засобах одні й ті ж домішки допускаються в різних кількостях або не допускаються зовсім. Наприклад, якщо в натрії хлориді, який використовується для виготовлення ізотонічного розчину, будуть домішки солей калію, то такий препарат не може застосовуватись в медицині, оскільки іони калію в фізіологічному відношенні є антагоністами іонів натрію. Тому домішки солей калію в натрію хлориді зовсім не допускаються. З іншої сторони, цей же домішок в іншому препараті, наприклад в кальцію хлориді, не є небезпечним, і тому ДФУ допускає її у визначеній кількості.
Класифікація домішок:
- допустимі (фармакологічно неактивні домішки, але у великих кількостях знижують вміст біологічно активних речовин та відповідно знижують активність ЛЗ);
- недопустимі (токсичні домішки – впливають на фармакологічний ефект);
- специфічні (характерні для даної речовини і є проміжними продуктами синтезу (при добуванні) ,або продуктами розкладання речовини (при зберіганні) ,чи то супутні біологічно активні речовини);
- неспецифічні (зустрічаються в багатьох лікарських засобах і потрапляють при транспортуванні, з розчинників та допоміжного матеріалу, з обладнання та таропакувальних матеріалів).
Основним принципом фармакопейних вимог до чистоти лiкарських засобiв є вiдсутнiсть або обмежений вмiст домiшок, якi можуть негативно впливати на фiзичнi, хiмiчнi та фармакологiчнi властивостi лiкарських засобiв.
Державна фармакопея України в кожнiй монографiї на субстанцiї наводить перелiк показникiв, за якими встановлюють чистоту лiкарського засобу, i методики визначення недопустимих і допустимих домiшок в розділі „Випробування на чистоту”.
Способи визначення домішок в субстанції:
1. Хімічні – з використанням або без використання еталонних розчинів.
ДФУ регламентує два методи визначення граничного вмiсту домiшок: безеталонний та еталонний.
Еталонний метод використовують у разi, якщо межа вмiсту домішки (допустима домішка) вказана в числовому вираженнi (наприклад, у вiдсотках). Для визначення допустимої межi вмiсту домiшок проводять їх кiлькiсне оцiнювання за допомогою вiдповiдних еталонних розчинiв. Еталоннi розчини мiстять таку кiлькiсть домiшки, яку вказано в монографiї (ФС).
Визначення допустимих домішок проводять шляхом порівняння результатів реакцій в розчині еталону і в розчині субстанції після додавання до них однакових кількостей відповідних реактивів.
Порiвняння проводять колориметрично (визначення iнтенсивностi забарвлення) або нефелометрично (визначення iнтенсивностi мутностi) .
При визначенні домішок використовують найчутливіші реакції на відповідні іони, оскільки домішки, якщо й допускаються, то в дуже малих кількостях.
Таким чином, еталонний метод базується на спостереженні в однакових умовах забарвлення або опалесценції , які виникають під дією якого-небудь реактиву на досліджуваний домішок в порівнянні з еталонним розчином.
Еталон- це зразок, який містить точну кількість домішки, яку визначають.
Оскільки еталонні розчини – це розчини з точно визначеною концентрацією, якісні випробування на домішки набувають кількісного значення. Тобто ми можемо сказати не тільки, чи є домішка, але й яка її відносна кількість. Наприклад, для встановлення вмісту домішки проводять кольорову реакцію чи реакцію осадження (якісні реакції) на досліджувану домішку як у випробовуваному розчині, так і в еталонному розчині. Порівнюють інтенсивність забарвлення або опалесценцію в обох пробірках. При цьому еталонний розчин містить певну відому кількість іонів, на які проводиться дослідження. Якщо забарвлення або опалесценція в досліджуваному розчині інтенсивніша, ніж в еталонному, значить кількість досліджуваних іонів перевищує допустиму межу і субстанція не відповідає вимогам відповідної монографії ДФУ та не може застосовуватися як лікарський засіб.
Але слід пам`ятати, що еталонні розчини використовують тільки тоді, коли визначають домішки, наявність яких допускається фармакопеєю в певній кількості (допустимі) – якщо в монографії вказано, наприклад, що хлоридів повинно бути не більше ніж 0,02% (тобто зазначена допустима межа вмісту домішки).
Безеталонний метод використовують у разi, якщо в монографiї на лiкарський засiб вказано, що домiшки “не повинно бути” (недопустима домішка). В цьому випадку в монографії не вказано допустиму межу вмісту домішки й до порівняння з еталоном не вдаються.
Позитивним результатом при проведеннi випробування на ту чи iншу домiшку буде її вiдсутнiсть, тобто пiд час виконання реакцiї не виявляється аналiтичний ефект.
Загальні положення, яких необхідно дотримуватися при визначенні домішок (проведення випробувань на чистоту):
При проведенні аналізу на домішки необхідно суворо додержуватися кількісних співвідношень реактивів та послідовності їх додавання, які рекомендує фармакопея, інакше домішок може бути не виявлений.
Вода та всі реактиви мають бути вільними від іонів, на вміст яких проводять дослідження.
Пробірки, у яких проводять дослідження, повинні бути безбарвними та однакового діаметра.
Наважки для виготовлення еталонних розчинів відважують з точністю до 0,001г.
Еталонні розчини (друге або третє розведення) виготовляють безпосередньо перед застосуванням.
Спостереження мутності та опалесценції розчинів проводять у світлі, що проходить через розчин на темному фоні перпендикулярно до осі пробірок, а забарвлення – при денному відбитому світлі на матово-білому фоні.
Додавання реактивів до досліджуваного та еталонного розчинів проводиться одночасно і в однакових кількостях.
У випадку, коли у відповідній фармакопейній статті, або монографії, вказано, що у цій концентрації розчину не повинна визначатися та чи інша домішка, до порівняння з еталоном не вдаються, а діють так: до досліджуваного розчину додають усі наведені для кожної реакції реактиви, крім основного, який відкриває домішку. Розчин ділять на дві частини, до однієї з них додають основний реактив. Обидва розчини порівнюють між собою, між ними не повинно бути помітної різниці.
ДФУ при випробуванні ЛЗ на наявність домішки дає докладні описи умов проведення тих чи інших якісних хімічних реакцій.
У тих випадках, коли домішка, що визначається, зустрічається в багатьох ЛЗ : хлорид-іони, сульфат-іони, іони кальцію тощо (неспецифічні домішки) – фармакопея не дає докладної методики визначення цієї домішки в окремій статті, а тільки зазначає допустиму її межу в лікарській речовині.
Уніфіковані методи визначення домішок, які найчастіше трапляються, наведено у відповідній загальній статті ДФУ, а методики приготування еталонних розчинів – у розділі «Реактиви».
Наприклад, хлориду еталонний розчин, концентрація якого становить 0,0005% готують так: 0,824 г натрію хлориду розчиняють у воді і доводять до 1000,0 мл. Розчин розводять у 100 разів безпосередньо перед використанням. Визначення хлоридів проводять так: до 15 мл випробовуваного розчину , зазначеного в окремій статті, додають 1 мл кислоти азотної розведеної і виливають суміш у пробірку, яка містить 1 мл розчину срібла нітрату:
CI¯ + AgNO3 → AgCI↓ + NO3¯
Паралельно за цих самих умов готують еталон, використовуючи замість випробуваного розчину 10 мл еталонного розчину і 5 мл води.
Через 5 хв пробірки переглядають на чорному фоні горизонтально (перпендикулярно до осі пробірок). Опалесценція випробуваного розчину не повинна перевищувати опалесценцію еталона (до порівняння з еталоном вдаються тільки у випадку, коли домішка допустима).