Фази у сплавах системи залізо-вуглець
РОЗДІЛ 3
ДІАГРАМА “ЗАЛІЗО - ВУГЛЕЦЬ”
Властивості чистого заліза. Алотропія
Залізо – це метал, в якому відбувається поліморфне перетворення. Найбільш стійкою кристалічною ґраткою є така, що володіє найменшим запасом вільної енергії. Але при зміненні температури чи тиску ґратка може перебудовуватися.
 Існування одного металу (речовини) у кількох кристалічних формах називається поліморфізмом або алотропією. Різні кристалічні форми одної речовини називаються поліморфними або алотро-пічними модифікаціями (різновидами).
Існування одного металу (речовини) у кількох кристалічних формах називається поліморфізмом або алотропією. Різні кристалічні форми одної речовини називаються поліморфними або алотро-пічними модифікаціями (різновидами).
Алотропічні форми позначаються грецькими літерами α, β, γ та ін., які у вигляді індексів додають до символу, що позначає елемент (наприклад, Feα, Feβ, Feγ). Найнижчій температурі відповідає літера α, потім β, γ, δ та ін.
Перетворення однієї алотропічної форми в іншу при нагріванні супровод-жується поглинанням тепла і відбувається при постійній температурі. На кривій кристалізації (що будується в координатах “температура - час”) це перетворення відзначається горизонтальною дільницею. При охолодженні відбувається виділення тепла.
Цікавий приклад. Олово існує у двох модифікаціях α і β. Нижче + 18 ºС стійким є так зване сіре олово (α). При охолодженні α – олово з’являється у вигляді окремих горбів на β – олові (так звана “олов’яна чума”). Сіре олово – це сірий порошок, який не володіє металічними властивостями (не знаючи цього, загинула експедиція Скотта до Південного полюсу, що зберігала гас у бідонах, паяних оловом).
Залізо – метал з питомою вагою 7,8 г/см3, температурою плавлення 1539 ºС, твердістю НВ 80. У чистому вигляді в природі практично не зустрічається, легко вступає у реакцію, утворюючи хімічну сполуку. З багатьма елементами залізо утворює розчини: з металами – розчини заміщення, з вуглецем, азотом та воднем – розчини проникнення.
Залізо існує у двох алотропічних формах (α і γ). Існування цих форм спостерігається зі зміною визначеної температури, що пояснюється зміною запасу внутрішньої енергії при зміненні температури.
Фази у сплавах системи залізо-вуглець
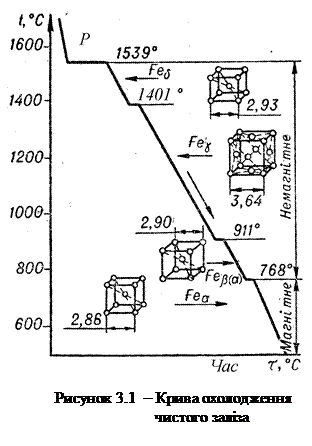
Залізо двічі змінює свою ґратку – при 911 ºС і при 1392 (1401 ºС) – за останніми даними температура 1392 ºС уточнена завдяки новим методам дослідження діаграм і становить 1401 ºС. Нижче 911 ºС залізо має об’ємно-центровану кубічну ґратку (ОЦК), називається α-залізо і позначається Feα. При нагріванні до температури 911 ºС ґратка заліза змінюється на гранецентровану кубічну (ГЦК). Це γ-залізо (Feγ). При 1392 (1401 ºС) відбувається ще одне поліморфне перетворення – ГЦК ґратка знову перетворюється на ОЦК. Високотемпературне залізо з ОЦК-ґраткою називають δ-залізом (Feδ). Під час охолодження відбуваються зворотні перетворення ґраток. Площинки на кривій охолодження відповідають критичним точкам (температурі кристалізації заліза та температурам поліморфних перетворень); поруч з кривою схематично показані кристалічні ґратки.
У залізі також відбувається магнітне перетворення, тобто перехід при нагріванні з феромагнітного до парамагнітного стану (при охолодженні - навпаки). Воно здійснюється при 768 ºС (точка Кюрі) та не супроводжується зміною типу ґратки. Відповідно сучасним уявленням, при магнітному перетворенні відбувається зміна не у кристалічній структурі, а у взаємодії зовнішніх і внутрішніх електронних оболонок атомів.
Вуглець – неметалічний елемент з питомою вагою 2,5 г/см3, атомним радіусом 0,77Аº, з температурою плавлення 3500 ºС. Вуглець має три алотропічні форми: алмаз, графіт та вугілля. Вуглець у залізовуглецевих сплавах може кристалізуватися у вільному стані у вигляді графіту (температура плавлення 2862 ºС) або взаємодіяти з залізом, утворюючи тверді розчини і хімічну сполуку. Графіт має гексагональну шарувату ґратку, неміцний, непластичний, зустрічається у сірих чавунах.
Залізо з вуглецем утворює ряд хімічних сполук FeC, Fe2C, Fe3C, FeC2, FeC3 та ін. Найбільш стійким з цих карбідів є цементит (Fe3C) – карбід заліза.
Цементит – дуже тверда речовина (> 800 НВ), але дуже крихка. Він містить 6,67 % С, має складну орторомбічну кристалічну ґратку з дванадцятьма атомами заліза і чотирма вуглецю, температуру плавлення близько 1250 ºС, має магнітні властивості нижче температури 217 ºС.
Ферит (Ф) – обмежений твердий розчин вуглецю в α-залізі (Feα). Ферит має кубічну об’ємноцентровану ґратку.
Аустеніт (А) – обмежений твердий розчин вуглецю в γ – залізі. Аустеніт має кубічну гранецентровану ґратку. Його назвали на честь відомого англійського вченого Р. Аустена (R.Austen).
Ферит – м’яка фаза (НВ ~ 70, σв ~ 200-250 МПа) з високою пластичністю (δ ~ 40 %, ψ ~ 70 %). Аустеніт має дещо вищу твердість і міцність (170-200 НВ, σв ~ 500-800 МПа), зберігаючи при цьому високу пластичність (δ ~ 50 %, ψ ~ 60 %).
3.3 Діаграма стану залізо-цементит (Fe – Fe3C)
Діаграма стану Fe - Fe3C охоплює тільки невелику частину всієї системи сплавів залізо-вуглець і обмежується кількістю вуглецю 6,67 %, що відповідає цементиту. Саме ці сплави знайшли широке практичне застосування.
Наявність невеликої кількості звичайних домішок у сталях не впливає істотно на положення критичних точок і характер ліній діаграм, тому сталь можна з відомим
наближенням розглядати як подвійний сплав “залізо - вуглець” (Fe – C).
Найбільша кількість вуглецю, за діаграмою (6,67 %) відповідає вмісту вуглецю в хімічній сполуці – цементиті.
Отже, компонентами, з яких складаються сплави цієї системи, будуть, з одного боку, чисте залізо Fe, з другого – цементит Fe3C.
У залежності від умов (температури та концентрації компонентів) можуть утворюватися:
1) тверді розчини (аустеніт і ферит);
2) механічні суміші (перліт та ледебурит);
3) хімічні сполуки (цементит).
 |
Відповідно є дві діаграми сплавів “залізо - вуглець”: цементитна (Fe - Fe3C ) і графітна (Fe – C).
 |
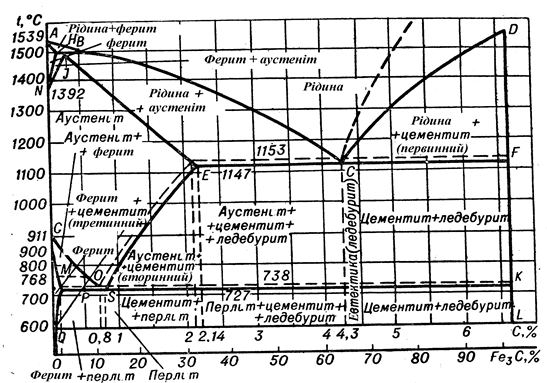
Як видно з діаграми, структура аустеніту складається з однієї фази – твердого розчину. Максимальна розчинність вуглецю у γ – залізі дорівнює 2,14 % при темпе-ратурі 1147 ºС (точка Е), мінімальна розчинність дорівнює 0,8 % при температурі 727 ºС (точка S). Структура фериту складається також з однієї фази – твердого розчину. Максимальна розчинність вуглецю у α – залізі дорівнює 0,02 % при 727 ºС (точка Р), мінімальна розчинність дорівнює 0,006 % при температурі 0 ºС (точка Q).
Ледебурит (Л) – евтектика (яка отримала назву на честь німецького вченого-металурга А. Ледебура) – механічна суміш аустеніту і цементиту первинного у межах температур від 1147 ºС до 727 ºС (дві тверді фази). Нижче температури 727 ºС аустеніт ледебуриту перетворюється у перліт, який складається з двох твердих фаз (фериту і цементиту). Ледебурит утворюється із рідкої фази визначеного складу, що містить 4,3 % вуглецю. Точка С – евтектична точка, лінія ЕСF – евтектична горизонталь.
Перліт (П) – евтектоїд (тобто подібний до евтектики; від слова перл, оскільки на протравленому шліфі він має характерний блиск, що нагадує перламутр) – механічна суміш фериту і цементиту із вмістом 0,8 % вуглецю. Структура перліту складається з двох твердих фаз: фериту та цементиту вторинного, цей процес відбувається при постійній температурі (727 ºС), точка S є евтектоїдною точкою, лінія РSK – евтектоїдною горизонталлю.
Різниця між евтектикою та евтектоїдом полягає в тому, що евтектика формується з рідкого розчину, а евтектоїд – з твердого.
Лінія АВСД – лінія ліквідус (або лінія первинної кристалізації), лінія АНJЕСF – лінія солідус.
Проаналізуємо діаграму без врахування поліморфного γ↔δ-перетворення, яке відбувається при високих температурах (лівий верхній кут діаграми) і практично не впливає на структуру та властивості більшості залізовуглецевих сплавів.
По лінії АСД йде перетворення рідкого стану в твердий. По лінії АС з рідкого стану починають випадати кристали аустеніту. По лінії СД з рідкого стану починають випадати кристали цементиту (первинного).
По лінії ЕСF при температурі 1147 ºС відбувається одночасно кристалізація аустеніту і цементиту та утворюється евтектика (ледебурит). Лінія ЕСF називається лінією первинної кристалізації, або евтектичного перетворення (або ледебуритного).
Лінія РSK – лінія вторинної кристалізації, або евтектоїдного перетворення (перлітного). По лінії РSK аустеніт при охолодженні перетворюється у перліт.
По лінії СД з рідкої фази кристалізується цементит первинний (Ц1), по лінії SE із аустеніту – цементит вторинний (ЦІІ), по лінії РQ із фериту – цементит третинний (ЦІІІ). Структурні складові залізовуглецевих сплавів показані на рисунку 3.3.
 |
Залізовуглецеві сплави з вмістом вуглецю менше 2,14 % називаються сталями, більше 2,14 % – чавунами.
Діаграма стану Fe - Fe3C дозволяє визначити для кожного сплаву структуру і фазовий склад при будь-якій температурі. Це допомагає вирішувати практичні задачі. Які стосуються вибору температурних режимів обробки тиском, термічної обробки заготовок та виробів.