Свойства, строение молекул и структура растворителей
В литературе отсутствует единая классификация растворителей, но обычно их рассматривают по классам химических соединений. Однако такой подход не позволяет понять сходства и различия растворителей разных классов. Поэтому их классифицируют на основе тех или иных физических и химических свойств. Известны классификации по физическим константам, кислотно-основным свойствам, по способности к комплексообразованию, образованию водородной связи, донорно-акцепторной способности и др. [108, вторая ссылка;
198].
Для исследования сольватации особое значение имеют растворители, характеризующиеся специфическим взаимодействием с растворенным веществом. Рассмотрим наиболее важные из них более подробно.
Вода. Вода — одно из наиболее важных веществ, которое благодаря своеобразию физических и химических свойств, определяет характер физического и биологического мира [199]. Своеобразие многих из этих свойств связано с особенностями строения молекул воды и ее структурой. Основные сведения о свойствах воды можно найти в монографиях, например [200. 201].
Интересно рассмотреть строение самой молекулы воды, распределение в ней электронной плотности, поскольку именно эти свойства определяют энергетику гидратации ионов. Спектроскопическими исследованиями воды в парообразном состоянии найдено, что молекулы воды нелинейны. Ядра атомов молекулы воды образуют равнобедренный треугольник с двумя протонами в основании и кислородом в вершине. Причем угол связи Н -О- Н для низшего колебательного уровня равен 105° 03', а межъядерные расстояния ОН и Н—Н равны 0,09568 и 0,154 нм [200, 201]. Правильное истолкование свойств воды возможно только на основе изучения строения электронного облака ее молекулы. Молекулы воды в этом плане описывают при помощи электростатических моделей и моделей, основанных на теории молекулярных орбиталей, распределения электронной плотности, использования точных волновых функций и расчетов физических свойств [143, W. Wood ]. Наиболее реальна из них четырехполюсная модель Бьеррума [12, 202], согласно которой электрические заряды молекулы воды расположены в вершинах тетраэдра. Два отрицательных полюса созданы избытком электронной плотности в местах расположения неподеленных пар электронов, а два положительных — ее недостатком в местах расположения протонов. При этом строение электронного облака молекулы воды не зависит от ее изотопного состава.
Описанная модель согласуется с моделями, полученными на основе теории молекулярных орбиталей, распределения электронной плотности и др. Тетраэдрическая направленность в размещении электрических зарядов связана с распределением электронной плотности на четырех гибридных sp 3-opбитaляx. В подобной тетраэдрической конфигурации угол Н—О—Н должен бьпь равен 109°. Уменьшение этого угла примерно на 40 обусловлено различием в отталкивании электронных пар на связывающих и несвязывающих орбиталях. sp3-Гибpидизaция изменяет также пространственное расположение тех пар электронов кислорода, которые не принимают непосредственного участия в образовании химической связи в молекуле воды. Они располагаются на противоположной стороне атома кислорода таким образом, что в целом заряды расположены в вершинах тетраэдра.
Жидкая вода характеризуется значительными силами межмолекулярного взаимодействия за счет водородных связей, приводящим к ассоциации и особой структуре.
Отправным моментом в изучении структуры воды явилось установление тетраэдрического окружения ее молекулы [116]. Исследования ФРР электронной плотности [200, 203 ] подтвердили этот вывод.
Представления о тетраэдрическом окружении молекул воды приводят к выводу о высокой ажурности ее строения и наличия в ней пустот. Размеры пустот равны или превышают размеры молекул воды. Это позволило Самойлову [204] выдвинуть идею о заполнении пустот тетраэдрических локальных молекулярных образований молекулами воды. Физическая возможность самого заполнения связана с представлениями Фрэнка и Квиста [205] о «гидрофобизации» молекул воды в пустотах таких образований (ассоциатов) вследствие трудностей образования в них направленных связей за счет высокой симметрии поля.
Следует отметить, что для понимания структуры жидкой воды важное значение имеют представления Попла [206] об изгибе водородных связей. Большой интерес представляют также идеи Фрэнка [207] о кооперативном характере возникновения и разрушения системы водородных связей в воде.
Из сказанного следует, что в жидкой воде мы имеем дело с молекулами, находящимися в различных состояниях: в составе локальных молекулярных образований, их пустотах и с нарушенными водородными связями. Выбор той или иной комбинации состояния молекул создает определенные модельные представления о ее структуре. Для создания правильного геометрического образа структуры требуется выделение ее характерных признаков из множества мгновенных состояний, возникающих за счет теплового движения.
К настоящему времени предложены самые разнообразные модели структуры, начиная с простейших ассоциатов, льдоподобных моделей и кончая чрезвычайно сложными, сходными со структурой полипептидов и полинуклеотидов — бесконечно и беспорядочно разветвленный гель с быстро возникающими и исчезающими водородными связями. Обзор их можно найти в работах [12, 48, 200-202, 208].
Однако имеющиеся модели жидкой воды - это лишь известное приближение к действительности. В принципе нельзя построить модель структуры жидкости, адекватной ее реальной структуре. Многочисленные конкретные модели структуры воды имеют лишь ограниченное значение и здесь не обсуждаются.
Для создания геометрического образа структуры необходимо найти способ выделения характерных признаков из множества мгновенных конфигураций, возникающих в процессе теплового движения. Подход Ван-дер-Ваальса предполагает, что при отсутствии или наличии слабых межмолекулярных взаимодействий молекула испытывает жесткие упругие столкновения с молекулами своего окружения. Между столкновениями молекула движется свободно и характеризуется длиной свободного пробега. При наличии взаимодействия существенны мягкие столкновения, которые приводят к извилистости пути движения молекулы между двумя последовательными жесткими столкновениями.
В основе подхода Френкеля лежит другой механизм теплового движения. Предполагается, что молекула колеблется около временного положения равновесия, а затем скачком перемещается в другое положение (см. раздел III.1). При этом величина скачков близка к среднему расстоянию между соседними молекулами. Здесь важны период колебаний и среднее время пребывания около временного положения равновесия.
Для построения геометрического образа структуры используются оба из указанных подходов.
В масштабе времени [200, 209 ] различают:
мгновенную, или I-структуру —
tизмер < tкол
колебательно-усредненную, или V-структуру -
tкол < tизмер < tпост
диффузионно-усредненную, или D-структуру
 |
tизмер > tпост
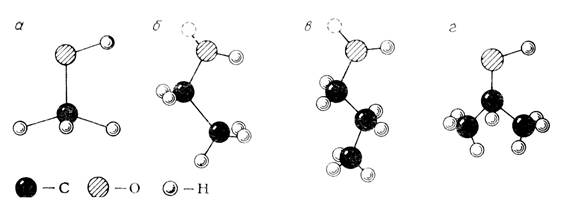
IV.I. Модели молекул метанола (а), этанола (б), пропанола (в) и изопропанола (г).
Для промежутков времени порядка 10 -10 с воде присуща V-структура. По сути дела V-структура — это сугубо локальная характеристика жидкости, отражающая усредненную картину расположения молекул в ближайшем окружении вокруг произвольно выбранной молекулы за период времени, включающей приблизительно тысячу молекулярных осцилляций вблизи временного положения равновесия. Для жидкой воды понятие V-структуры играет фундаментальную роль, поскольку вода, как никакая другая жидкость, должна характеризоваться широким спектром V-структур.
Усреднение по всем локальным структурам дает картину строения жидкости, называемую диффузионно-усредненной, или D-структурой. Такое усреднение может быть выполнено во времени. В этом случае следует рассматривать D-структуру в ближайшем окружении данной молекулы в течение промежутков времени (10-8 сек), за которое совершается большое число вращательных переориентации и трансляционных перемещений молекул. С другой стороны, можно рассматривать D-структуру как результат усреднения локальных V-структур по всему пространству, занимаемому жидкостью.
С позиций статистической механики оба метода эквивалентны, однако, два этих подхода несколько различаются возможностями машинного моделирования жидких систем. D-Структура может быть описана с помощью ФРР. Экспериментальными методами, позволяющими получить необходимую информацию о ФРР, являются рентгенография и нейтронография. К теоретическим относятся метод интегральных уравнений и метод машинного моделирования. Следует отметить большое преимущество экспериментальных способов нахождения ФРР, так как они не требуют знания потенциала взаимодействия молекул, о котором для воды известно все еще мало. Из ФРР воды следует, что структура воды является приблизительно тетраэдрической и весьма ажурной — среднее число ближайших соседей составляет 4,4, что отличается от соответствующего значения для льда. Вид ФРР воды сохраняет все основные особенности до весьма высоких температур (выше 373 К), что говорит о сохранении основных особенностей структуры воды и при повышенных температурах.
Метод МК для воды использован в работах [210, 211], а расчеты по МД систематически проводят Стилинджер и Рамано [212]. Основные выводы о строении воды, полученные разными авторами на основе расчетов совпадают. Макроскопическая D-структура воды является результатом наложений большого числа локальных V-структур, а V-структура в воде представляет собой приблизительно тетраэдрические сетки водородных связей, топология которых не совпадает ни с одной из предложенных моделей. Но данным эксперимента [243] и теоретических расчетов можно сделать вывод, что наиболее близким к действительности является представление о структуре воды, как о статистически упорядоченной трехмерной сетке водородных связей.
Вышесказанное позволяет под структурой жидкой воды понимать статистическую упорядоченность ее взаимодействующих молекул в элементарном объеме при заданных условиях, которая проявляется в образовании сетки водородных связей и имеет ряд характерных особенностей (тетраэдричность расположения ближайших соседей, наличие пустот с частичным заполнением молекулами воды; разная степень связанности ее молекул, кооперативный характер водородной связи и др.).
Одноатомные спирты. Строение молекул одноатомных спиртов — широко распространенных растворителей - изучалось в работах [36, 214]. Основные характеристики их приведены в табл. IV.1.
Модели, приведенные на рис. IV.1, позволяют заключить, что молекулы рассматриваемых спиртов можно рассматривать как тетраэдры, в центре которых расположены атомы углерода, а в вершинах — атомы водорода, углеводородные радикалы и гидроксильные группы. Физической основой такого окружения атома углерода является тетраэдрическое расположение его гибридных sp3-орбиталей, принимающих участие в образовании химических связей.
Спектроскопические исследования [215] показали, что одноатомные спирты, начиная с этанола, могут образовывать поворотные изомеры, так называемые транс- и гош-изомеры. В первом случае для нормальных спиртов гидроксильная группа находится в одной плоскости с углеродным скелетом, во втором — она повернута к нему на 120°.
ТАБЛИЦА IV. 1. Межъядерные расстояния и валентные углы в молекулах некоторых одноатомных спиртов
| Фрагменты молекулы | Спирты | |||
| метанол | этанол | пропанол | пропанол-2 | |
| Межъядерные расстояния, нм | ||||
| O-Н | 0,0937 | 0,0956 | 0,0937 | |
| C-H | 0,109.3 | 0,1090 | 0,1096 | 0,1090 |
| C-O | 0,1434 | 0,148 | 0,1434 | 0,1400 |
| C2-C1 | — | OJ54 | 0,1526 | 0,1550 |
| С3-С2 | — | — | 0,1526 | 0,1550 |
| Валентные углы | ||||
| COH | 105° 56' | 109° 56' | 105° | |
| ССО | — | 109°32' | — | 106° 6' |
| ССС | — | — | 109°28' | 112° 24' |
| (метил) | ||||
| HCH | 109030' | -- | 109° 16' | |
| метилен | (метил) | |||
| 108° 19' | ||||
| CCH | — | —. | — | 110° 36' |
| метилен | (мeтил) | |||
| 110°36' |
В молекуле спиртов атом кислорода обладает двумя неподеленными парами электронов, что обусловливает значительную полярность их молекул. Распределение зарядов в рассматриваемых спиртах обсуждено в работе [216].
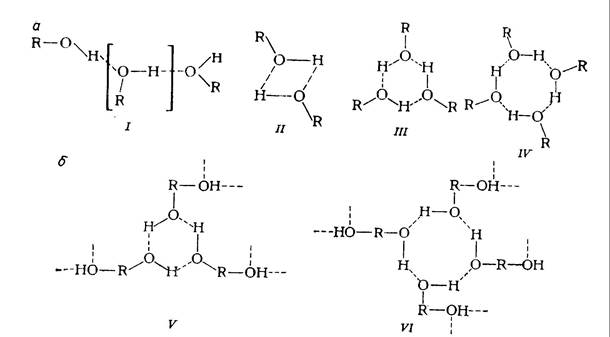
IV.2. Основные элементы структуры одно- (a) и многоатомных (б) спиртов:
I — линейный ассоциат; II — циклический димер; III, V — циклические тримеры; IV, VI— циклические тетрамеры.
Рентгеноструктурные исследования жидких одноатомных спиртов впервые были выполнены Стюартом и Морроу 1217 ]. На основании этих данных Захариазен [218] рассчитал кривые радиального распределения электронной плотности для метанола и нонанола, а также предложил модель, согласно которой молекулы спирта за счет водородных связей ассоциированы в цепочки с неплоскостным расположением атомов (рис. IV.2). К аналогичным результатам пришли Остер и Кирквуд [219]. Расчет по кривым радиального распределения привел к следующим значениям координационных чисел в структуре спиртов: 2 — метанол и этанол; 3, 2 — пентанол; 3, 5 — гептанол и 5, 3 — дециловый спирт [220]. Об этом свидетельствуют и результаты других работ.
В работах [215, Л. Н. Иманов; 221 1 установлено, что кроме цепочечных ассоциатов, одноатомные спирты могут образовывать циклические ассоциаты: циклические тримеры и тетрамеры для метанола и димеры для других спиртов (рис. IV.2).
Степень ассоциации, состав и форма ассоциатов зависят от различных факторов. Степень ассоциации спиртов снижается с увеличением молекулярной массы спиртов, т. е. для них характерен так называемый эффект утяжеления 14, 48]. Физическая сущность его связана с ослаблением водородной связи как за счет стерического фактора, так и за счет тепловых колебании частиц. В том же направлении, что и эффект утяжеления, действуют повышение температуры и добавки некоторых неполярных веществ. Действие эффекта утяжеления проявляется также в том, что с ростом молекулярной массы спиртов структура их становится все более плотной. Об этом свидетельствует уменьшение коэффициента термического расширения одноптомных спиртов при переходе от метанола к бутанолу [222]. На степень ассоциации спиртов непосредственное влияние оказывает изомерия спиртов (разветвленность углеводородного радикала). Так, для изомерных спиртов она несколько меньше, чем для нормальных [221, В. Singh]. С увеличением числа молекул спирта в ассоциате увеличивается вероятность перехода линейных ассоциатов в циклические.
При рассмотрении структуры жидких одноатомных спиртов необходимо учитывать взаимодействие между неполярными углеводородными радикалами за счет вандерваальсовых сил. Как показано в работе [223], энергия такого взаимодействия близка к энергии водородной связи между молекулами спиртов или превышает ее.
В работе [224] сделана попытка создания машинной модели жидких метанола и этанола. Расчеты показывают, что молекулы спиртов ассоциированы в изогнутые разветвленные цепи и внутримолекулярное вращение не оказывает существенного влияния на структуру.
Иной подход к структуре одноатомных спиртов предложен в работах Тарасова с сотр. [225], в которых ее рассматривают как трехмерную статистическую упорядоченность. В локальных молекулярных образованиях молекулы спиртов связаны жесткими водородными связями. .Молекулы спиртов разных образований связаны вандерваальсовыми силами. Однако и в этом случае мы имеем дело с цепными и слоистыми структурами, обуславливающими структуру спиртов по сравнению со структурой воды.
Одноатомные спирты и вода существенно различаются по энергии водородной связи. По данным Полинга [9], энергия водородной связи для воды составляет 18,8, а для метанола и этанола 25,9 кДж-моль-1. Если учесть, что в воде на одну молекулу приходится две водородные связи, а в спиртах только одна, то станет совершенно очевидным большая прочность структуры воды.
Отличительная черта одноатомных спиртов — более плотно-упакованная структура их по сравнению с водой.
Многоатомные спирты. Строение молекул многоатомных спиртов по сравнению с одноатомными изучено хуже. Данные для этиленгликоля и глицерина приведены в табл. IV.2 [2261.
Молекулы многоатомных спиртов (гликолей) могут образовывать поворотные изомеры, причем наиболее вероятна гош-форма [227]. Однако при повышении температуры для этиленгликоля равновесие между изомерами смещается в сторону образования транс-формы [228]. Особенности строения их молекул определяют специфику структуры многоатомных спиртов в жидком состоянии.
Молекулам многоатомных спиртов из-за наличия двух и более гидроксильных групп свойственно образование двух типов водородных связей: внутри- и межмолекулярной. Внутримолекулярные водородные связи изучены в работах [227—231]. На основе рассчитанных энергий водородной связи в работе [229] делается вывод, что в ряду изомерных бутиленгликолей прочность ее уменьшается в ряду: 1,4- >1,3- >1,2- и 2,3-бутиленгликоль, в то время как расстояние О...Н в этой же последовательности увеличивается. Авторы считают, что энергия образования внутримолекулярной водородной связи в этих соединениях сильно зависит от геометрического фактора. В 1,4-изомере — семичленное кольцо, в 1,3-изомере — шестичленное, в 1,2- и 2,3-изомерах — пятичленные кольца. Увеличение расстояния между гидроксильными группами с увеличением длины углеводородной цепи уменьшает вероятность образования внутримолекулярной водородной связи [229].
ТАБЛИЦА IV. 2. Межъядерные расстояния и валентные углы в молекулах некоторых многоатомных спиртов
| Фрагменты молекулы | Cпирты | Фрагменты молекулы | Спирты | ||
| Этиленгликоль | Глицерин | Этиленгликоль | Глицерин | ||
| Межъядерные расстояния, нм | Валентные углы | ||||
| О—Н | 0,097 | 0,096 | СОН | - | 107—109° |
| С—Н | 0,108 | 0.1083 | ССО | 109°30' | 109° 18' |
| С—О | 0,143 | 0,143 | СОС | — | 109° 18' |
| С—С | 0,154 | 0,152 |
В работе [230] из ИК-спектров многоатомных спиртов [НО — (СН2)n — ОН, где п ==2-6] и с использованием литературных данных делается вывод, что образование внутримолекулярной водородной связи наиболее выгодно для 1,4-бутиленгликоля. Найдено также [230, 231], что у этиленгликоля при 298,15 К за счет образования водородной связи между соседними гидроксильными группами происходит выигрыш в изменении энтропии. Вследствие этого этиленгликоль содержит наибольшее число циклических структур.
Многоатомные спирты, имеющие три гидроксильные группы, могут образовывать две внутримолекулярные водородные связи, но доля связанных за счет их гидроксильных групп в трехатомных спиртах меньше, чем у двухатомных [232].
Несмотря на важную роль внутримолекулярных водородных связей в многоатомных спиртах, их структура в жидком состоянии определяется в основном образованием межмолекулярных водородных связей (см. рис. IV.2). Наличие в многоатомных спиртах двух или более гидроксильных групп приводит к тому, что в жидком состоянии в них образуется статистически упорядоченная пространственная сетка водородных связей [28, 233, 234]. Плотностьихв этиленгликоле и глицерине в полтора — три раза больше, чем и одноатомных спиртах [48]. Авторы работы [233] указывают, что у этиленгликоля степень разветвленности водородных связей, больше чем у воды, однако энергия этих связей меньше.
Тепловое движение молекул, разрывая или искажая водородные связи, ведет к локальному ослаблению межмолекулярных сил, но подобие динамически подвижной пространственной молекулярной сетки сохраняется [48]. Согласно выводам [2341, сделанным на основании исследований диэлектрической проницаемости этиленгликоля в интервале 293-423 К, вблизи температуры плавления число водородных связей на молекулу составляет немного меньше четырех. При повышении температуры это число резко уменьшается и около 323,15 К становится равным двум, соответствуя переходу от пространственной к цепочной структуре.
На образование межмолекулярных водородных связей заметное влияние оказывают внутримолекулярные водородные связи. Так, в бутиленгликолях [235] за счет образования внутримолекулярных водородных связей снижается число донорных и акцепторных групп, принимающих участие в образовании межмолекулярных водородных связей. Вследствие чего их способность к образованию таких связей близка к таковой одноатомных спиртов. Молекулы глицерина обладают большим числом донорных и акцепторных групп, в результате чего способность к образованию межмолекулярной водородной связи у них выше.
Степень ассоциации многоатомных спиртов, их способность к образованию межмолекулярных водородных связей зависит, как видно из вышесказанного, от многих факторов. В работе [236] рассмотрены некоторые закономерности влияния строения молекул и температуры на ассоциацию в гликолях. Из них следует, что наименее ассоциированы гликоли с прямыми цепями; рост разветвленности углеводородной цепи увеличивает степень ассоциации; при высоких температурах в случае разветвленной цепи гликоли ассоциируются только за счет одной гидроксильной группы молекулы.
Отметим, что имеются указания на существенную роль межмолекулярных взаимодействий за счет сил Ван-дер-Ваальса [223] на ассоциацию в многоатомных спиртах.
За последнее время в литературе появляется все больше данных, полученных при помощи таких современных методов исследования, как: ИК-спектроскопия [237]; акустическая спектроскопия [238];определение спектров комбинационного рассеяния [239]; измерение диэлектрической релаксации [194], а также релаксации сдвиговой и объемной вязкости [240], определение спектров корреляции фотонов в жидком глицерине, с помощью аргонового лазера [241 ] и т. д., которые убедительно свидетельствуют о наличии высокоупорядоченной статистической сетки водородных связей в многоатомных спиртах. Вместе с тем эта сетка заметно отличается от той, которая характерна для жидкой воды: в ней отсутствуют тетраэдрическое окружение молекул ближайшими соседями, пустоты, в которых могут размещаться молекулы растворителя. Сближает эти сетки наличие в локальных молекулярных образованиях трехмерной сетки водородных связей.
Другие растворители. К числу изученных органических растворителей относятся: кетоны; карбоновые кислоты; эфиры; алифатические и ароматические углеводороды и их производные; амины, а также некоторые растворители с особыми свойствами. Из неорганических растворителей изучены: серная кислота, аммиак, перекись водорода, оксиды серы, хлороксиды серы и фосфора и многие др. Сведения об их структуре в жидком состоянии либо недостаточно полны, либо противоречивы. Имеющихся обобщений в этой области недостаточно [194, 242, 243]. Остановимся кратко на тех растворителях, которые изучены в плане обсуждаемых вопросов.

IV.3. Схемы строения молекул ацетона (I), диоксана (II), муравьиной (III) и уксусной (IV) кислот, ДМСО (V) и ДМФА (VI) (расстояние в нм).
Ацетон относится к алифатическим кетонам, в которых существенную роль играет диполь-дипольное взаимодействие. Атом кислорода карбонильной группы, обладая неподеленной парой электронов, проявляет протон-акцепторные свойства. Схема строения молекулы ацетона приведена на рис. IV.3; там же приведены значения межъядерных расстояний и углов [243]. В ацетоне из-за отсутствия активных протон-донорных групп [194] водородные связи между молекулами не образуются. Считается, что при 283,15 К в ацетоне полностью отсутствует межмолекулярная ассоциация [194, 244]. При более низких температурах она возможна за счет антипараллельной ориентации диполей [194].
Муравьиная и уксусная кислоты представляют собой растворители, в которых существенную роль играют межмолекулярные водородные связи. Особенности указанных кислот определяются строением их молекул (см. рис. IV.3); значения межъядерных расстоянии и углов для этих кислот взяты из работы [245]. На основании ИК-, ЯМР-спектров и дифракции электронов [246] показано, что в газообразном состоянии муравьиная кислота находится преимущественно в форме циклических димеров. Исследование ИК-спектров жидкой муравьиной кислоты не дало однозначного ответа о ее структуре [247]. Однако предполагается, что в жидком состоянии имеются линейные ассоциаты из молекул кислоты. Фактор ассоциации муравьиной кислоты равен 3,6 при 293,15 К. Она обладает как протон-донорными, так и протон-акцепторными свойствами.
В газообразном состоянии уксусная кислота также находится главным образом в виде димеров [248]. В жидкой фазе уксусная кислота образует сложную смесь кольцевых димеров, мономеров и цепочечных ассоциатов, находящихся в динамическом равновесии [249].
1,4-Диоксан — это представитель класса эфиров. Схема строения его молекулы приведена на рис. IV.3; там же даны межъядерные расстояния и углы [250]. В растворе и в парах 1,4-диоксан существует исключительно в виде крестовидной конформации. Исследования методом релеевского рассеяния света [251 ] привели к выводу, что в жидком диоксане имеются мономеры, димеры, тримеры. Соотношение между ними существенно зависит от температуры. Образование ассоциатов связано с возможностью образования между молекулами слабой водородной связи [2521.
За последние годы, наряду с типичными органическими, широкое распространение получили растворители с особыми свойствами. Среди них заметное место принадлежит так называемым «сверхрастворителям» — диметилсульфоксиду (ДМСО) и диметилформамиду (ДМФА).
ДМСО отличается от ацетона тем, что карбонильный углерод заменен на серу. Это обстоятельство приводит к принципиальному изменению в пространственном расположении атомов и свойств указанных жидкостей. Если молекула ацетона имеет плоскую структуру, то ДМСО обладает пирамидальным строением [253] (см. рис. IV.3). В вершине пирамиды находится атом S, высота ее 0,0706 нм. Поскольку атом серы имеет наименьший вибрационный эллипсоид, то центр тяжести ляжет недалеко от него [253]. Однозначного мнения о характере связи S—О не существует. Методом ИК-спектроскопии найдено, что она имеет наполовину ионный и наполовину ковалентный характер [254]. Для молекул ДМСО по сравнению с ацетоном характерна более сильная донорная способность [255]. В молекуле ДМСО имеется два акцепторных центра — атом кислорода с наивысшей электронной плотностью и экранированный атом серы [256]. Координация ДМСО окружающими молекулами осуществляется через кислород [257]. ДМСО относится к сильно ассоциированным жидкостям [258]; характер ассоциации может быть разным [259]. При этом наиболее вероятно образование циклических димеров. Термодинамические исследования [260] подтверждают представления о ДМСО, как об ассоциированной жидкости.
ДМФА является наиболее интересным представителем амидных растворителей. Особенности их определяются спецификой молекулярной структуры. Химические свойства амидов, несмотря на присутствие группы С==0, существенно отличаются от таковых альдегидов и кетонов, в которых эта группа характеризуется высокой химическом активностью. Длина связи С-N в амидах 0,134 им для ДМФА) заметно короче, чем ст-связь С - N (0,1376 нм для формальдегида, 0,147 нм для нитрометана) [261]. Длины связей С=О в амидах и альдегидах близки.
ТАБЛИЦА IV. 3. Физико-химические характеристики жидких растворителей при стандартных условиях
(Р = 1,01325 105 Па; Т=298,15 К)
| Растворитель | М, у. е. | Ткип, К | Тnл, К | р, кг/м3 | п | De | m, Д | h |
| Вода Н2О | 18,0160 | 373,15 | 273,15 | 997,07 | 1,3330 (293 К) | 78,25 | 1,86 | 0,801 (303 К) |
| Метанол СН3ОН | 32,042 | 337,66 | 175,66 | 786,75 | 1,3286 (293 К) | 32,70 | 1,706 | 0,5445 |
| Этанол С2Н5ОН | 46,069 | 351,39 | 158,6 | 785,22 | 1,3613 (293 К) | 32,70 | 1,706 | 1,078 |
| Пропанол С3Н7ОН | 60,096 | 370,30 | 146,0 | 799,50 | 1,38556 (293 К) | 20,33 | 1,657 | 2,004 |
| Пропанол-2 (СН3)2СНОН | 60,096 | 355,55 | 183,7 | 785,1 (293 К) | 1,3776 (293 К) | 18,3 | 1,65 | 2,43 (293 К) |
| Бутанол С4Н90Н | 74,123 | 390,6 | 193,3 | 809,9 (293 К) | 1,3993 (293 К) | 17,7 | 1,66 | — |
| Бутанол-2 (СН3)2СНСОН | 74,123 | 380,7 | 165,6 | 802,7 (293 К) | 1,3878 (293 К) | 17,24 | — | — |
| Этиленгликоль НО(СН2)2ОН | 62,068 | 470,9 | 261,6 | 1106,6 | 1,4318 | 37,7 | 2,88 | 17,3 |
| Диэтиленгликоль НОСН2СН2ОНСН2ОН | 106,120 | 691,2 | 1117,0 | 1,4472 | 30,8 | — | ||
| Глицерин НОСН2СН2ОНСН2ОН | 92.094 | 291,2 | 1,4744 | 42,4 | 2,56 | 94,5 | ||
| 1,2-Пропиленгликоль НОСН2СН2ОНСН3 | 76,095 | 1032,4 | 1,4313 | 29,02 | 2,25 | 45,66 | ||
| 1,3-Пропиленгликоль HOCH2CH2CH2OH | 76,095 | 487,1 | 241,1 | 1048,9 | 1,4396 | 35,0 | 2,50 | — |
| 1,4-Бутиленгликоль НОСН2(СН2)2СН2ОН | 90,124 | 1012,9 | 1,4420 | 30.7 | 2,55 | 75,6 | ||
| Ацетон (СН3)2СО | 58,080 | 329,39 | 177,80 | 785,08 | 1,35609 | 20,7 | — | 0,2954 |
| Муравьиная кислота НСООН | 46,025 | 373,9 | 281,40 | 1219,61 (293 К) | 1,37140 (293 К) | 56,1 | — | 1,966 |
| Уксусная кислота СН3СООН | 60,052 | 291,2 | 289,90 | 1055,0 (288 К) | 1,3720 (293 К) | 6,19 | — | |
| 1,4-Диоксан О(СН2)2(СН2)2О | 88,114 | 374,47 | 284,95 | 1033,75 (293 К) | 1,42241 (293 К) | 2,209 | 0,45 | 1,31 (293 К) |
| ДМСО (СН3)2SО | 78,133 | 291,70 | 1095,75 | 1,4783 (273 К | 46,4 | — | 2,000 | |
| ДМФА (СН3)2NCOН | 173,094 | 944,5 | 1,4269 | 36,7 | 3,82 | — | ||
| Тетраметиленсульфон (ТМС, сульфолан) (CH2)4SO2 | 120,170 | 301,60 | 1261,5 (303 К) | 1,48181 (303 К) | 43,3 (303 К) | — | 9,87 (303 К) | |
| Этиленкарбонат (ЭК) (СН2О)2СО | 88,066 | 309,6 | 1320,8 (313 К) | 1,4199 (313 К) | 89,61 (313 К) | — | 1,85 (313 К) | |
| Гексаметилфосфортриамид (ГМФТ, гексаметанол) [(CH3)2N]3PO | 179,204 | 280,4 | 1020,26 | 1,4570 | 29,6 | - | 3,247 |
Введение в амидную группу формамида вместо атомов водорода двух метильных групп приводит к существенным изменениям свойств амидов. Молекулярное строение ДМФА приведено на рис. IV.3; там же даны межъядерные расстояния и углы [259, 261 ].
Рентгенографически [2621 и электронографически [261] найдено, что конфигурация молекулы ДМФА близка к плоской, причем метильные группы атома азота неэквивалентны: одна из них расположена к группе С—Н ближе, чем другая. Вследствие частичной двоесвязанности связи С—N барьер внутреннего вращения вокруг нее сравнительно велик. По данным ЯМР [263] энергетический барьер внутреннего вращения лежит в интервале от 29,3 до 108,9 кДж-моль-1.
Молекула ДМФА имеет три неподеленные пары электронов — одна на атоме азота и две на атоме кислорода; поэтому для ДМФА характерны сильные электрондонорные свойства, причем донором электронов является карбонильный кислород.
Вопрос о существовании ассоциатов в жидком ДМФА до конца не выяснен, а имеющиеся данные противоречивы.
К рассматриваемой группе растворителей относятся также тетра-метиленсульфон (ТМС), этиленкарбонат (ЭК), пропиленкарбонат (ПК), гексаметилфосфортриамид (ГМФТ), нитрометан (НМ) и многие другие. Однако обсуждение их здесь нецелесообразно.
В заключение отметим, что указанные выше растворители характеризуются специфическим взаимодействием с растворенным веществом. Физико-химические свойства этих растворителей, приведенные в табл. IV.3, показывают, что они относятся к протонным и диполярным апротонным растворителям. Наиболее характерны для них — наличие несвязывающих неподеленных пар электронов; именно поэтому они представляют особое значение для изучения сольватационных процессов. Протонные растворители содержат группы, способные отщеплять протоны (—ОН, >NH, —SH и др.), и являются донорами протона при образовании водородных связей. Диполярные апротонные растворители обладают высокой диэлектрической проницаемостью и большими дипольными моментами. Они хорошо сольватируют катионы l263] и поэтому растворяют неорганические соли. Существенное значение имеют и другие характеристики растворителей — их донорно-акцепторная способность, полярность и др. [163, 255, 264].
Наряду с индивидуальными растворителями, большой интерес представляет исследование смешанных растворителей и растворов.