Понятие об иммунитете. Классификация различных форм иммунитета.
Иммунитет – совокупность свойств и механизмов, обеспечивающих постоянство состава организма и его защиту от инфекционных и других для него чужеродных агентов.
- Врожденный, естественный иммунитет (неспецифическая резистентность) - филогенетически более древний. Составляют неспециализированные защитные механизмы, действующие против любого чужеродного фактора. Действуют постоянно.
- Приобретенный или специфический иммунитет – механизмы, определяющие способность организма к избирательному ( специфическому) ответу на конкретные чужеродные структуры, именуемые антигенами. Эта способность формируется в каждом организме в ответ на воздействие конкретного антигенного вещества.
- Врожденный и приобретенный иммунитет реализуются действием клеток и гуморальных факторов, что привело к формулировке терминов – клеточный и гуморальный иммунитет.
- При некоторых заболеваниях ( туберкулез, сифилис) устойчивость к повторному заражению сохраняется на протяжении того времени, пока в организме присутствует возбудитель болезни. Такой иммунитет называют инфекционным, или нестерильным.
- Формирование приобретенного иммунитета – процесс активной перестройки иммунной системы, приводящий к образованию гуморального либо клеточного иммунитета – антител и клеток, способных эффективно взаимодействовать с антигенами, вызвавшими развитие иммунной реакции. В этих случаях иммунитет называют активным.
- Антитела и клетки иммунного организма способны вызвать состояние иммунитета в другом организме. Если будут перенесены искусственно или попадут естественным путем. Такой иммунитет получил название пассивный.
- Пассивный иммунитет формируется у новорожденного ребенка за счет поступления материнских антител через плаценту при беременности – плацентарный иммунитет, либо с молозивом и молоком при кормлении ребенка. Иммунитет, воспринятый от матери, может быть назван материнским иммунитетом.
- Для создания пассивного иммунитета используют пересадку лимфоцитов иммунного организма или клеток самого пациента, активированных антигеном или цитокинами вне организма. Такой иммунитет получил название адаптивного (воспринятого).
- При трансплантации несовместимых тканей возникает трансплантационный иммунитет ( реакция отторжения трансплантата).
- Поступление в организм антигена через дыхательные пути, пищеварительный тракт и другие участки слизистых поверхностей и кожи нередко обуславливает развитие выраженной локальной иммунной реакции. В таких случаях речь идет о местном иммунитете. Поступление антигена в одни участки слизистых поверхностей обуславливает развитие секреторного иммунитета, связанного с образованием секреторных иммуноглобулинов класса А, защищающих все слизистые поверхности.
9
Под неспецифическим иммунитетом подразумевают систему предсуществующих защитных факторов организма, присущих данному виду как наследственно обусловленное свойство. Так, собаки никогда не болеют чумой человека, а куры - сибирской язвой. Иммунитет, создаваемый анатомическими, физиологическими, клеточными и молекулярными факторами, которые являются естественными составляющими элементами организма, иначе называют конституционным. Такие факторы защищают организм от разных экзогенных и эндогенных агрессий, они передаются наследственно, их защитные функции лишены избирательности и они не способны сохранять память от первичного контакта с чужеродностью.
Условно факторы неспецифической защиты можно разбить на четыре типа: физические(анатомические); физиологические; клеточные, осуществляющие эндоцитоз или прямой лизис чужеродных клеток; молекулярные (факторы воспаления).
Клеточные факторы
К клеточным факторам неспецифической защиты относятся фагоцитирующие клетки и натуральные киллеры.
Фагоцитирующие клетки.Одним из мощных факторов резистентности являетсяфагоцитоз.И.И.Мечников установил, что фагоцитарными свойствами обладают зернистые лейкоциты крови и лимфы, главным образом полиморфноядерные нейтрофилы (микрофаги - нейтрофилы, эозинофилы и базофилы) и по-другому обозначаются как полиморфноядерные лейкоциты, или гранулоциты, а такжемоноциты и различные клетки ретикулоэндотелиальной системы, которую он назвал макрофагами.В настоящее время под макрофагами понимают клетки, которые обладают высокой фагоцитарной активностью. Они различаются по форме и размерам, в зависимости от тканей, где они обнаруживаются. По классификации ВОЗ все макрофаги объединены всистему мононуклеарныхфагоцитов (СМФ).
Фагоцитам присущи трифункции:
- Защитная. Фагоцитозом уничтожаются чужеродные объекты, т.е. происходит очистка организма от инфекционных агентов, продуктов распада, отмирающих клеток, неметаболизируемых органических веществ.
- Секреторная. Взаимодействие объекта фагоцитоза с фагоцитом стимулирует бактерицидные системы последнего. К основным системам бактерицидности относят окислительную (О2-зависимую) и неокислительные (ферментные). Окислительная бактерицидная система убивает микроб за счет прямого действия продуцируемых фагоцитом О2, ОН и Н2О2 или галогенизацию. Из ферментных систем самым сильным бактериологическим потенциалом обладают лизоцим и катепсин.
Кроме того фагоциты синтезируют и секретируют множество цитокинов - биологически активных веществ, необходимых для поддержания иммунного ответа организма на чужеродное вещество.
- Представляющая. Переработка антигена (процессинг) и представление его иммунокомпетентным клеткам, принимающим участие в формировании иммунного ответа
Процесс фагоцитоза складывается из следующих стадий:
- Хемотаксис - продвижение фагоцита к объекту фагоцитоза, осуществляется с помощью псевдоподий.
- Адгезия (прикрепление). На мембране фагоцитов размещены различные рецепторы для захвата микроорганизмов.
- Эндоцитоз (поглощение). Принципы поглощения бактерий идентичны таковым у амеб: захваченные частицы погружаются в протоплазму и в результате образуетсяфагосома с заключенным внутри объектом.
- Внутриклеточное переваривание. К фагосоме устремляются лизосомы, затем оболочки фагосомы и лизосомы сливаются и ферменты лизосом изливаются в фаголизосому. Фагоцитированные микроорганизмы подвергаются атаке комплекса различных микробицидных факторов.
- Натуральные киллеры.
Натуральные киллеры (НК или NK) или естественные киллеры (ЕК) представляют собой популяцию лимфоидных клеток, лишенных признаков Т- и В-лимфоцитов. Их участие в неспецифическом иммунном ответе состоит в способности оказывать прямое цитотоксическое действие на злокачественнотрансформированные и - бактериальные патогены. . В процессе цитолиза различают три основных стадии: распознавание, выделение цитотоксинов («летальный удар») и лизис клетки-мишени.
Гуморальные (молекулярные) факторы неспецифической защиты
В неспецифическом иммунитете против микробов участвуют белки острой фазы воспаления: С-реактивный протеин (белок), сывороточный амилоид, альфа2-макроглобулин, фибриноген, b-лизины, интерфероны, система комплемента, лизоцим и др.
Система комплемента.
Система комплемента это комплекс растворимых белков и белков клеточной поверхности, взаимодействие которых опосредует разные биологические эффекты:
- разрушение (лизис) клеток,
- привлечение лейкоцитов в очаг инфекции или воспаления (хемотаксис),
- облегчение фагоцитоза (опсонизация),
- стимуляция воспаления и реакций гиперчувствительности (анафилотоксины).
Большая часть компонентов комплемента синтезируются гепатоцитами и мононуклеарными фагоцитами. Компоненты комплемента циркулируют в крови в неактивной форме. При определенных условиях самопроизвольный каскад ферментативных реакций ведет к последовательной активации каждого из компонентов системы комплемента. Компоненты комплемента обозначают латинской буквой С и арабскими цифрами (С1, С2 .... С9).
Существуют два взаимосвязанных пути активации комплемента: классический и альтернативный. В результате формируется мембраноатакующий комплекс, который способен пенетрировать (формирование поры) клеточную мембрану и вызывать лизис микроорганизмов.
Центральными органами иммунной системы называют органы, где происходит формирование и созревание иммуноцитов. К ним относят костный мозг, вилочковую железу (тимус) и сумку Фабрициуса. Периферические органы иммунной системы содержат зрелые лимфоциты. Здесь после антигенного воздействия происходит их дальнейшая пролиферация и дифференцировка, продуцируются антитела и эффекторньш лимфоциты. К периферическим органам относятсяселезенка, лимфатические узлы, скопления лимфоидной ткани под слизистыми поверхностями желудочно-кишечного, дыхательного, мочеполового трактов(групповые лимфатические фолликулы, тонзиллы, пейеровы бляшки).
Тимус, или вилочковая железа, - лимфоэпителиальный орган. Он состоит из долек, каждая из которых содержит корковый и мозговой слой. Клетки-предшественники тимоцитов формируются в костном мозге и через кровь попадают в кору тимуса. Клетки и их гуморальные продукты (цитокины, гормоны) стимулируют деление незрелых лимфоцитов, поступивших в кору. В процессе деления они созревают. На их поверхности появляются новые структуры, а некоторые стадиоспецифические структуры утрачиваются. Структуры, определяющие особенности клеток иммунной системы, обладают антигенными свойствами. В тимусе Т-лимфоциты дифференцируются на две субпопуляции, содержащие антигены CD4 либо CD8. Лимфоциты CD4 обладают свойствами клеток-помощников - млперов (Тх), лимфоциты CD8 - цитотоксическими свойствами, а также супрессорным эффектом, заключающимся в их способности повалять активность других клеток иммунной системы. В ходе созревания Т-лимфоциты проходят позитивную селекцию - отбор клеток, обладающих рецепторами для молекул главного комплекса тканевой совместимости (МНС), обеспечивающих возможность последующих контактов Т-лимфоцитов с клетками, представляющими им чужеродный антиген. В корковом слое тимуса происходит и негативная селекция
Костный мозг, Как уже упоминалось, костный мозг служит местом происхождения всех клеток иммунной системы. Здесь же происходит созревание и дифференцировка В-лимфоцитов. Костный мозг функционирует и как вторичный орган иммунной системы. Макрофаги костного мозга обладают фагоцитарной активностью, а В-лимфоциты дифференцируются в плазматические клетки, которые продуцируют антитела. Направления дифференцировки стволовых клеток костного мозга определяются клетками стромы костного мозга, макрофагальными клетками, лимфоцитами и образуемыми ими цитокинами. Клетки костного мозга продуцируют гормоноподобный пептидный фактор, способствующий активации В-лимфоцитов.
Лимфатические узлы обеспечивают неспецифическую резистентность организма, выполняя функции барьеров и фильтров, удаляющих из лимфы и крови чужеродные частицы. Вместе с тем лимфатические узлы служат местом формирования антител и клеток, осуществляющих клеточные иммунные реакции.
СелезенкаСнаружи орган окружен соединительнотканной капсулой, от которой внутрь органа отходят поддерживающие перегородки — трабекулы. Характерной чертой строения селезенки является наличие двух гистологически хорошо различающихся участков — красной и белой пульпы. Белая пульпа (мальпигиевы тельца) представляет собой скопление лимфоцитов вокруг эксцентрично расположенного артериального канала. Красная пульпа есть место локализации большого количества эритроцитов, а также макрофагов, мегакариоцитов, гранулоцитов, перемещающихся сюда из белой пульпы лимфоцитов. Четких границ между белой и красной пульпой нет и между этими двумя регионами происходит частичный клеточный обмен.
Т лимфоцитыФункции.
Т- лимфоциты распознают процессированный и представленный на поверхности антиген- представляющих ( А ) клеток антиген. Они отвечают за клеточный иммунитет, иммунные реакции клеточного типа. Отдельные субпопуляции помогают В- лимфоцитам реагировать на Т- зависимые антигены выработкой антител.
Происхождение и созревание.
Родоначальницей всех клеток крови, в том числе лимфоцитов, является единая стволовая клетка костного мозга. Она генерирует два типа клеток- предшественников- лимфоидную стволовую клетку и предшественника клеток красной крови, от которой происходят и клетки- предшественники лейкоцитов и макрофагов.
Выделяют три основные группы Т- лимфоцитов- помощники (активаторы), эффекторы,регуляторы.
В- лимфоциты.
Существует несколько подтипов В- лимфоцитов. Основная функция В- клеток- эффекторное участие в гуморальных иммунных реакциях, дифференциация в результате антигенной стимуляции в плазматические клетки, продуцирующие антитела.
Образование В- клеток у плода происходит в печени, в дальнейшем- в костном мозге. Процесс созревания В- клеток осуществляется в две стадии- антиген — независимую и антиген — зависимую.
11Фагоцитоз. Фагоцитирующие клетки. Основные стаи фагоцитоза и их характеристика. Фагоцитарные показатели. Завершенный и незавершенный фагоцитоз. Ферменты фагоцитов. Значение факторов приобретенного иммунитета в фагоцитозе.
Стадии фагоцитоза:
- Хемотаксис и опсонизация.
- Хемотаксис – приближение фагоцита к объекту фагоцитоза. Индуцируется хемоатрактантами.
Хемоатрактанты.
| Эндогенные | Экзогенные |
| Белки в плазме крови С5, каллекреин, фибриноген - продукты распада нейтрофилов – лимфокины, монокины -простагландины | ЛПС Гр «- « бактерий -некоторые лекарства -иммностимуляторы |
Опсонизация – окружение объект фагоцитоза молекулами комплемента, а в иммунном организме молекулами антител.
- Прикрепление и прилипание опсонизированных частиц к фагоциту. Есть рецепторы к такой клетке.
- Поглощение частиц и формирование фагосомы – внутри находятся микробы для уничтожения.
Фагоциты:
-микрофаги
-макрофаги
Макрофаги – морфологически разнородные, но одинаково функционирующие клетки, способны к фагоцитозу
Свободно-циркулирующие – моноциты, подвижны.
Фиксированные (сидят в органах) – альвеолярные, перитонеальные, никроглия, остеокласты, куперовские клетки долго живущие, живут до нескольких месяцев, до 2-3 лет.
Микрофаги:
-нейтрофилы
- базофилы
- эозинофилы.
Бактерицидная система фагоцитов
- Миелопероксидазная система в результате окисления субстратов образуется биооксиданты ( перекись водорода, вода).
- Лактоферрин
- Лизоцим – повреждает КС
- Катионы белка – повреждают КС
- Слияние фагосомы с лизосомами и переваривание убитых микробов.
Фагоцитоз может быть незавершенным, микробы не погибают, а размножаются в организме. Погибает фагоцит; при патологии; хронизация инфекционного процесса.
12Гуморальные факторы неспецифической защиты: пропердин, лизоцим, лизины. трансферрин, лактоферрин, ОРВ. Значение оценки этих показателей в клинической практике.
Лизоцим
Лизоцим представляет собой термостабильный белок типа муколитического фермента. Он содержится в тканевых жидкостях животных и человека – в слезах, слюне, перитонеальной жидкости, плазме и сыворотке крови, в лейкоцитах, материнском молоке и др.
Лизоцим продуцируется моноцитами крови и тканевыми макрофагами. Он вызывает лизис многих сапрофитных бактерий, оказывая менее выраженное литическое действие на ряд патогенных микроорганизмов и не активен в отношении вирусов.
Механизм бактериологического действия лизоцима состоит в гидролизе связей между М 0 ацетилмурамовой кислотой и N – ацетилглюкозамином в полисахаридных цепях пептидогликанового слоя клеточной стенки бактерий. Это приводит к изменению ее проницаемости, сопровождающемуся диффузией клеточного содержимого в окружающую среду, и гибели клеток.
Системой комплемента называют многокомпонентную, самособирающуюся систему белков сыворотки крови, которая играет важную роль в поддержании гомеостаза. Она способна активироваться в процессе самосборки, т.е последовательного присоединения к образующемуся комплексу отдельных белков, которые называются компонентами, или фракциями комплемента. Таких фракций известно девять. Они продуцируются клетками печени. Мононуклеарными фагоцитами и содержатся в сыворотке крови в неактивном состоянии.
Процесс активации комплемента может запускаться двумя разными путями. Получившими названия классический и альтернативный.
При активации комплемента классическим путем инициирующим фактором является комплекс антиген-антитело ( иммунный комплекс). Причем антитела только двух классов IgG и IgM в составе иммунных комплексов могут инициировать активацию комплемента благодаря наличию вЕли активация комплемента по классическому пути происходит при участии иммунного комплекса эритроцит – антиэритроцитарный Ig. Происходит гемолиз эритроцитов; если иммунный комплекс состоит из бактерий и антибактериального Ig, происходит лизис бактерий (бактериолизис).
Таким образом, при активации комплемента классическим путем ключевыми компонентами являются С1 и С3. продукт расщепления которого C3b активирует терминальные компоненты мембраноатакующего комплекса (С5 –С9).
В альтернативном пути активации комплемента необходимо участие сывороточного белка.
Функции комплемента:
1. Участвует в реакциях иммунного лизиса, лизирует Гр»-« бактерии, клетки.
2. Участвует в реакциях гиперчувствительности нормального типа
3. Индуцирует воспаление в месте наличия иммунных комплексов антиген-антитело
4. Участвует в работе свертывающей системы крови
5. Является мощным хемоаттрактантом усиления фагоцитоза. С3а-C3b,С5а,С4а.
- Опсонизирует объекты фагоцитоза
-Т-проницаемость сосудов
- вызывает дегрануляцию тучных клеток
- стимулирует систему свертывания крови
14 Антигены (АГ) - это любые простые или сложные вещества, которые при попадании в организм тем или иным путем вызывают иммунную реакцию и способны специфично взаимодействовать с продуктами этой реакции: антителами и иммунными Т-клетками
.Антигены, как правило, являются белками или полисахаридами и представляют собой части бактериальных клеток, вирусов и других микроорганизмов
Полноценными антигенами являются природные или синтетические биополимеры, чаще всего белки и их комплексные соединения (гликопротеиды, липопротеиды, нуклеопротеиды). Они имеют молекулярную массу более 10000 дальтон, обладают достаточно жесткой структурой. Полноценные антигены обычно поливалентны - на 1 молекуле высокомолекулярного АГ может быть 10-20 и более эпитопов.
Гаптены - низкомолекулярные вещества, которые в обычных условиях не вызывают иммунную реакцию. К гаптенам относятся лекарственные препараты и большинство химических вешеств. Они способны запускать иммунный ответ после связывания с белками организма, например с альбумином, а также с белками на поверхности клеток
Полугаптены — неорганические вещества (например, йод или хром), присоединение которых к молекуле белка меняет его иммуногенные свойства
Классификация
В зависимости от происхождения, антигены классифицируют на экзогенные, эндогенные и аутоантигены.
Экзогенные антигены
Экзогенные антигены попадают в организм из окружающей среды, путем вдыхания, проглатывания или инъекции.
Эндогенные антигены
Эндогенные антигены образуются клетками организма в ходе естественного метаболизма или в результате вирусной или внутриклеточной бактериальной инфекции. Фрагменты далее презентируются на поверхности клетки в комплексе с белками главного комплекса гистосовместимости первого типа
Аутоантигены — это как правило нормальные белки или белковые комплексы (а также комплексы белков с ДНК или РНК), которые распознаются иммунной системой у пациентов с аутоиммунными заболеваниями. Такие антигены в норме не должны узнаваться иммунной системой, но, ввиду генетических факторов или условий окружающей среды, иммунологическая толерантность к таким антигенам у таких пациентов может быть утеряна.
15Антигенная структура бактериальной клетки. Основные свойства микробного антигена. Протективные свойства микробных антигенов. Микробная мимикрия.
Антигенами называют вещества любого происхождения. В том числе и микробного, которые способны вызвать в организме специфическую иммунную реакцию и принимать участие в е осуществлении. Антигены могут оказывать иммунногенное действие – вызывать гуморальный иммунный ответ и клеточный ответ либо толерогенное действе, т.е. обуславливать развитие иммунологической толерантности – ареактивности к последующему иммуногенному воздействию антигена.
Различают полные и неполные антигены, или гаптены. Последние – относительно простые вещества, способные участвовать в иммунологических реакциях, но не способны активировать АПК и самостоятельно индуцировать иммунный ответ. Лишь после присоединения к крупным, обычно белковым молекулам (носителям), гаптен сможет приобрести свойства полного антигена.
Практически все природные субстраты. Обладающие антигенными свойствами. Являются комплексами нескольких антигенов. Микробная клетка обладает множеством антигенов, свойственных отдельным ее структурам. Даже индивидуальные молекулы могут обладать несколькими антигенами.
Основными свойствами антигена являются:
Специфичность. Уникальное биологическое явление, которое лежит в основе иммунологических взаимодействий в организме, а также лабораторных методов определения разных антигенов, серодиагностики, методов специфической профилактики и терапии инфекционных заболеваний.
Структура, обладающая антигенной специфичностью, называется антигенным детерминантом, или эпитопом. Антигенной активностью обладают только структуры, лежащие на поверхности молекулы.
Чужеродность. Антиген вызывает позитивный иммунный ответ только в тех случаях, когда он чужероден, т.е. обладает структурами, отсутствующими в данном организме. К собственным антигенам организм толерантен.
Собственные антигены организма могут подвергаться модификации при действии внешних химических или физических факторов или вступать в контакт с чужеродными веществами гаптенной природы. В результате формируются антигены, гаптенная часть которых – чужеродная структура, а носитель – собственный антиген. Такие модификационные антигены часто служат причиной развития аллергических реакций.
Иммуногенность и толерантность – альтернативные свойства антигенного субстрата. Для индукции иммунного ответа и толерантности необходимо воздействие антигена на лимфоцит, обладающий рецепторами для данного антигена – антиген-реактивную клетку (АРК). Отличия состоят в том, что при индукции позитивной иммунной реакции АРК получает стимулы от цитокинов. Обеспечивающие из пролиферацию и формирование клона эффекторных клеток. При индукции иммунологической толерантности АРК не подвергается дальнейшей стимуляции и либо погибает, либо лишается рецепторов к антигену.
Формирование иммунологической толерантности Т-ив-лимфоцитов к собственным антигенам, как уже отмечалось, происходит в организме постоянно и созревающие лимфоциты. Обладающие рецепторами к аутоантигенам, гибнут в результате контакта с ними в тимусе или костном мозге. Чужеродные антигены в иммунологически полноценном организме встречают преимущественные условия для иммуногенного действия и лишь при особых ситуациях проявляют толерогенные свойства. Это наблюдается:
1. При действии антигена в условиях неспособности организма обеспечить стимуляцию клеток. Вошедших в контакт с антигеном в случаях действия иммунодепрессивных факторов, способствующих иммуногенезу (незрелость организма, беременность).
2. При отсутствии стимуляции активного иммунного ответа, вследствие недостаточной дозы антигена (« низкодозная» толерантность), сверхбольшой дозы антигена ( «высокодозная» толерантность ли иммунологический паралич)
3. При попадании антигена в структуры, не формирующие позитивный иммунный ответ ( « пероральная» толерантность).
Для характеристики иммунологической толерантности следует отметить, что чувствительность Т- и В-лимфоцитов к индукции толерантности различна: Т-лимфоциты более чувствительны к индукции толерантности, чем В-лимфоциты. И сохраняются толерантными более длительное время. Поэтому в организме может возникнуть ситуация, когда Т-лимфоциты толерантны к данному антигену, а В- лимфоциты не толерантны.
4. Сенсибилизирующая активность – повышенная чувствительность организма. Антигены. Которые могут вызвать гиперчувствительность немедленного типа или замедленного типа.
5. Адъювантность – способность некоторых антигенов усиливать иммунный ответ на другие иммунные антигены.
6. Иммунодепрессантное действие.
7. Толерантность– на них иммунная система не отвечает иммунной реакцией – заболевание протекает длительно.
Протективные свойства – свойства, которые стимулируют реакции, носящие замкнутый характер.
Антигенная мимикрия – когда микробы маскируются под антигенный состав некоторых тканей – аутоиммунный ответ.
Антителами называют белки, образование которых индуцируются антигенами и основным свойством которых является способность к специфическому взаимодействию с антигеном. Антитела – это свободные молекулы гликопротеидов, по электрофоретической подвижности относятся к гамма-глобулинам и по международной классификации именуются иммуноглобулинами. Они составляют 1/3 всех белков сыворотки крови ( около 16 г/л).
Иммуноглобулины
Иммуноглобулины подразделяются на классы в зависимости от структуры. Свойств и антигенных способностей их тяжелых цепей. 5 классов иммуноглобулинов: G, M,A,D,E.
Иммуноглобулины класса G (IgG)составляют около 80% сывороточных иммуноглобулинов ( в среднем 12 г/л). С молекулярной массой 16000 и скоростью седиментации 7S. Они образуются на высоте первичного иммунного ответа и при повторном введении антигена ( вторичный ответ). IgG обладают весьма высокой авидностью (скорость и прочность связывания с молекулой антигена), т.е. высокой скоростью связывания с антигеном. Особенно бактериальной природы. При связывании активных центров IgG с эпитопами антигена в области его Fc-фрагмента обнажается участок, ответственный за фиксацию первой фракции системы комплемента, с последующей активацией системы комплемента по классическому пути. Этим обуславливается способность IgG участвовать в защитных реакциях бактериолиза. IgG является единственным классов антител, проникающим через плаценту в организм плода. Через некоторое время после рождения ребенка содержание его в сыворотке крови падает и достигает минимальной концентрации к 3-4 мес., после чего начинает возрастать за счет накопления собственных IgG, достигая нормы к 7-летнему возрасту. Около 48% IgG содержится в тканевой жидкости. В которую он диффундирует из крови. IgG так же как и иммуноглобулины других классов. Подвергаются катаболическому распаду, который происходит в печени, макрофагах, воспалительном очаге под действием протеаз.
Иммуноглобулины класса М ( IgM) – первыми начинают синтезироваться в организме плода и первыми появляются в сыворотке крови после иммунизации людей большинством антигенов. Они составляют около 13% сывороточных иммуноглобулинов при средней концентрации 1г/л. По молекулярной массе они значительно превосходят все другие классы иммуноглобулинов. Это связано с тем, что IgМ являются пентамерами, т.е. состоят из 5 субъединиц, каждая из которых имеет молекулярную массу, близкую к IgG. IgM принадлежит большая часть нормальных антител – изогемагглютининов, которые присутствуют в сыворотке крови в соответствии с принадлежностью людей к определенным группам крови. Эти агглютинические варианты IgM играют важную роль при переливании крови. Они не проходят через плаценту и обладают наиболее высокой авидностью. При взаимодействии с антигенами в пробирке вызывают их агглютинацию, преципитацию или связывание комплемента. В последнем случае активация системы комплемента ведет к лизису корпускулярных антигенов.
Иммуноглобулины класса А ( IgA) встречаются в сыворотке крови и на поверхности слизистых оболочек. В сыворотке крови присутствуют мономеры IgA с константой седиментации 7S в концентрации 2,5 г/л. Данный уровень достигается к 10 годам жизни ребенка. Сывороточный IgA синтезируется в плазматических клетках селезенки, лимфатических Злов и слизистых оболочек. Они не агглютинируют и не преципитируют антигены, не способны активировать комплемент по классическому пути, вследствие чего не лизируют антигены.
Секреторные иммуноглобулина класса А (SIgA) отличаются от сывороточных наличием секреторного компонента, связанного с 2 или 3 мономерами иммуноглобулина А. Секреторный компонент является бета – глобулином с молекулярной массой 71 KD. Он секретируется клетками секреторного эпителия и может функционировать в качестве их рецептора, а к IgA присоединяется при прохождении последнего через эпителиальные клетки.
Секреторный IgA грает существенную роль в местном иммунитете, поскольку препятствует адгезии микроорганизмов на эпителиальных клетках слизистых оболочек рта, кишечника, респираторных и мочевыводящих путей. Вместе с тем SIgA в агрегированной форме активирует комплемент по альтернативному пути, что приводит к стимуляции местной фагоцитарной активности.
Секреторные IgA препятствуют адсорбции и репродукции вирусов в эпителиальных клетках слизистой оболочки, например при аденовирусной инфекции, полиомиелите, кори. Около 40% общего IgА содержится в крови.
Иммуноглобулины класса D (IgD). До 75 %IgD содержится в крови, достигая концентрации 0,03 г/л. Он имеет молекулярную массу 160000 D и скорость седиментации 7S.
IgD не проходит через плаценту и не связывает комплемент. До сих пор не ясно, какие функции выполняет IgD. Полагают, что он является одним из рецепторов предшественников В-лимфоцитов.
Иммуноглобулины класса Е 9IgE). В норме содержится в крови в концентрации 0, 00025 г/л. Они синтезируются плазматическими клетками в бронхиальных и перитонеальных лимфатических узлах, в слизистой оболочке ЖКТ со скоростью 0,02 мг/л массы в сутки. Иммуноглобулины класса Е называют также реагинами, поскольку, они принимают участие в анафилактических реакциях, обладая выраженной цитофильностью.
Местный иммунитет-разновидность системной реакции организма,которая обеспечивает устойчивость к инфекциям на границе проникновения вредных агентов в организм(кожа кишечник,слизистая ротовой полости,коньюктива глаз).Местный ответ обеспечивают иммуноглобулины А
1818.Гуморальный иммунный ответ. Гуморальный иммунный ответ – это
один из механизмов специфического иммунитета, возникающего в
организме под влиянием антигенного стимула. Осуществляется в
периферической лимфоидной ткани при участии 3 типов клеток: АПК,
Т-лимфоцитов хелперов, В-лимфоцитов. Определяет иммунитет при
большинстве бактериальных и вирусных инфекций, антитоксический
иммунитет, аллергию немедленного типа, ряд аутоиммунных
заболеваний.При гуморальном
иммунном ответе есть две фазы: индуктивная и продуктивная.
Индуктивная фаза – это время от момента попадания антигена в
организм до начала выработки антител, она включает клеточную
перестройку, восприятие антигена АПК, пролиферацию и
трансформацию определенного клона лимфоцитов. Продуктивная
фаза – это выработка антител и уничтожение антигена.
Формирование гуморального ответа определяется кооперацией В-лимфоцитов с другими клетками иммунной системы и в первую очередь с Т-лимфоцитами-хелперами, в стимуляции которых принимают участие и сами В-лимфоциты. В-лимфоцит воспринимает антиген путем прямого контакта рецепторов с антигеном. Антиген проходит тот же путь, что и в любой другой АПК: подвергается эндоцитозу, фрагментируется и экспрессируется на поверхности В-клетки в комплексе с белком МНС II класса. Этот комплекс воспринимается рецептором Т-лимфоцита и служит сигналом развития Т-клеточного ответа, так же как после стимуляции через другие АПК. Одновременно Т-лимфоциты начинают функционировать как хелперы, продуцируя лимфокины (ИЛ-2, -4, -5), обеспечивающие способность В-клетки, поглотившей антиген, пролиферировать и дать начало клону антителообразующих клеток, продуцирующих Ig (Т-зависимый ответ). Как уже отмечалось, содружество группы цито-кинов - ИЛ-6, ИЛ-4, ИЛ-2 и у-интерферона - способствуют переключению синтеза IgM антител на IgG. Преобладающее действие ИЛ-5 и трансформирующего фактора роста-(3 приводит к формированию антител класса IgA, а преобладающее действие ИЛ-4 переключает синтез иммуноглобулинов на IgE.
19.На скорость образования антител ( АТ ) влияет ряд факторов: доза Аг (сила Аг-воздействия), частота Аг-стимуляции и состояние иммунной системы индивида (то есть его иммунный статус). Если организм впервые встречается с Аг, то развивается первичный иммунный ответ, а при повторном контакте — вторичный ответ (рис. 10-11). 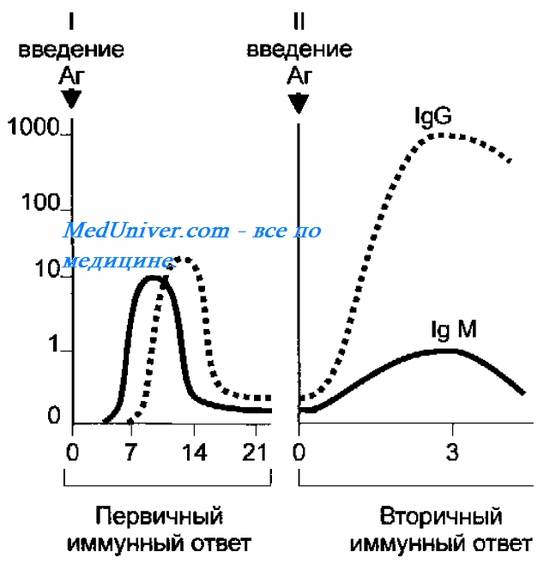
Первичный иммунный ответ
Появлению антител ( АТ ) предшествует латентный период продолжительностью 3~5 сут. В это время происходит распознавание Аг и образование клонов плазматических клеток. Затем наступает логарифмическая фаза, соответствующая поступлению антител ( АТ ) в кровь; её продолжительность — 7-15 сут. Постепенно титры антител ( АТ ) достигают пика и наступает стационарная фаза, продолжительностью 15-30 сут. Её сменяет фаза снижения титров AT, длящаяся 1-6 мес. В основу пролиферации клеток-продуцентов AT заложен принцип селекции. В динамике антителообразования титры высокоаффинных AT постепенно нарастают: после иммунизации аффинность AT к Аг постоянно увеличивается. Первоначально образуются IgM, но постепенно их образование уменьшается и начинает преобладать синтез IgG. Так как переключение синтезов от IgM к IgG не меняет идиотипа AT (то есть его специфичность по отношению к конкретному Аг), то оно не связано с клональной селекцией. Особенности первичного ответа — низкая скорость антитело -образования и появление сравнительно невысоких титров AT.
по оси ординат — титр AT (разведения).
Вторичный иммунный ответ
После антигенной стимуляции часть В- и Т-лимфоцитов циркулирует в виде клеток памяти. Особенности вторичного иммунного ответа — высокая скорость антителообразования, появление максимальных титров антител ( АТ ) и длительное (иногда многолетнее) их циркулирование.
Основные характеристики вторичного имунного ответа:
• образование антител ( АТ ) индуцируется значительно меньшими дозами Аг;
• индуктивная фаза сокращается до 5-6 ч;
• среди антител ( АТ ) доминируют IgG с большой аффинностью, пик их образования наступает раньше (3-5 сут);
• Антитела ( АТ ) образуются в более высоких титрах и циркулируют в организме длительное время.
20Клеточный иммунный ответ в антиинфекционной защите. Способы его выявления. Аллергический метод диагностики. Механизмы цитотоксических реакций.
Клеточный иммунный ответ возникает к возбудителям, которые паразитируют Внутриклеточно ( вирусы, риккетсии, хламидии).
Клеточный иммунный ответ лежит в основе противоопухолевого, противовирусного, трансплацитарного, осуществляется Т –лимфоцитами – эффекторами, его результат – появление Т-киллеров.
Осуществляется макрофагами – Т-клетками эффекторными.
Макрофаг захватывает антиген, перерабатывает его же антигены на поверхности NH- антигенами 1 клетки. В таком виде они воспринимают клонами Т-лимфоцитов эффектора, у которого есть антиген, специфичный к данной антигенной детерминанте.
Макрофаг выделяет ИЛ, который воздействует на этот клон Т-лимфоцитов, в этом случае под действием антиген, медиатора Т- лимфоциты иммунной памяти.
Т-киллеры способны находить, узнавать, убивать клетку, созданный антиген, вызывающий их образование.
Т-киллеры, Т-лимфоциты гиперчувствительности замедленного типа. Т- лимфоциты иммунной памяти.
Т-лимфоциты замедленного типа – секретируют множество лимфокинов, которые усиливают действие других иммунных и неиммунных клеток для уничтожения антигена.
Т-лимфоциты иммунной памяти не этом этапе перестают дифференцировать, хранят антигенную информацию – они первые воспринимают информацию об антигене.
2121.В учебнике стр 227
цитоки́ны-белки, синтезированные активированными клетками иммунной системы и обусловливающие межклеточные взаимодействия при кроветворении, воспалении, иммунном ответе и межсистемных контактах. Как правило, это локальные гормоны, действующие на основе рецепторного механизма. В кровотоке их концентрация обычно ниже эффективного порога, но она резко возрастает при развитии иммунного ответа. К цитокинам относятся интерлейкины, интерфероны, хемокины, факторы некроза опухоли, колониестимулирующие факторы. Они составляют цитокиновую систему, характеризующуюся активным взаимодействием компонентов. Некоторые цитокины используют в качестве иммунотерапевтических препаратов при вирусных, аллергических, онкологических заболеваниях.
К системе цитокинов в настоящее время относят около 200 индивидуальных полипептидных веществ. Среди всех из-вестных к настоящему времени секретируемых клетками регуляторных факторов две группы цитокинов являются наи-более хорошо изученными и, в связи с этим, наиболее часто используемыми в диагностических целях. Это факторы роста и цитокины иммунной системы (ИС). Цитокины ИС характеризуются следующими общими свойствами:
синтезируются в процессе реализации механизмов естественного или специфического иммунитета;
проявляют свою активность при очень низких концентрациях (порядка 10-11 моль/л);
служат медиаторами иммунной и воспалительной реакций и обладают аутокринной, паракринной и эндокринной ак-тивностью;
действуют как факторы роста и факторы дифференцировки клеток (при этом вызывают преимущественно медленные клеточные реакции, требующие синтеза новых белков);
образуют регуляторную сеть, в которой отдельные элементы обладают синергическим или антагонистическим дейст-вием;
обладают плейотропной (полифункциональной) активностью.
В зависимости от того, ка-кие клетки ИС преимущественно синтезируют тот или иной цитокин, различают интерлейкины, монокины и лимфоки-ны.
Цитокины ИС можно условно подразделить на 4 следующие группы:
- Гемопоэтические факторы (CSF-G,-M,-GM, IL-3 и IL-7, эритропоэтин) – стимуляторы роста и созревания не-зрелых кроветворных клеток.
- Регуляторы естественного иммунитета – провоспалительные цитокины (IFNα, β, IL-1 и IL-6, TNFα, хемокины - IL-8, MCP-1, RANTES и др.). Они участвуют в неспецифической защите организма от бактериальных и ви-русных инфекций. Их основными мишенями являются клетки-фагоциты – макрофаги и гранулоциты.
- Цитокины, регулирующие специфические иммунные реакции (IL-2 и IL-4, трансформирующий фактор роста (TGFβ) и др.). Эти белки участвуют в активации, росте и дифференцировке зрелых лимфоцитов.
- Цитокины, регулирующие воспалительные реакции, развивающиеся в процессе специфического иммунного ответа (INFγ, лимфотоксин,IL-5, IL-10 и др.). Их основная функция – активация неспецифических эффектор-ных клеток: цитотоксических макрофагов и естественных киллеров
Серологический метод диагностики – это определение обнаружения АТ к определенным АГ в сыворотке больного и определение их титра. Следуемым материалом является сыворотка больного.
Для подтверждения диагноза заболевания серологическим методом необходимо определить природу АТ, ее выявлении в реакции с парными сыворотками. Парные сыворотки – 2 сыворотки, взятые у больных с интервалом 5,7,10 дней
Реакции широко используются в микробиологических и серологических (иммунологических ) лабораториях с самыми разнообразными целями:
1) Серодиагностики бактериальных, вирусных. Реже других инфекционных заболеваний,
Сероидентификации выделенных бактериальных, вирусных и других культур различных м/о
2323.В учебнике стр 329
В основу реакций иммунитета положено специфическое взаимодействие антигена с антителом. С помощью известных антигенов можно определить наличие антител в сыворотке крови больного или обследуемого лица (серологическая диагностика инфекционных заболеваний). И, наоборот, наличие специфических иммунных сывороток позволяет установить родовую, видовую и типовую принадлежность микроорганизма (серологическая идентификация микроба по антигенной структуре).
Агглютинация – склеивание микробов или других клеток при воздействии на них иммунной сыворотки, содержащей антитела – агглютинины. Реакция агглютинации проявляется в том, что равномерной взвеси клеток, например бактерий, при добавлении иммунной сыворотки происходит скручивание клеток, образование зернышек или хлопьев, которые постепенно оседают на дно, жидкость же над осадком совершенно просветляется. Однако зернышки или хлопья образуются только в том случае, если реакция происходит в присутствии электролитов. Таким образом, для проявления реакции агглютинации нужно иметь: 1) антиген (агглютиноген) в виде взвеси клеток; 2)антитела (агглютинины) в виде иммунной сыворотки; 3) электролиты ( физиологический раствор).
Внешнее проявление положительной реакции агглютинации бактерий имеет двоякий характер в зависимости от свойств антигена: у безжгутиковых бактерий, имеющих только один соматический или О-антиген, происходит склеивание непосредственно самих микробных клеток, и образующиеся кучки имеют вид мелких компактных зерен. Такая агглютинация называется тонкозернистой; она происходит медленно – в течение 18-22 часов. У бактерий со жгутиками имеются два антигена – соматический, О-антиген, в самой клетке и жгутиковый, Н-антиген, находящийся в жгутиках. Клетки склеиваются друг с другом жгутиками и образуют рыхлые крупные хлопья. Такая агглютинация называется крупнохлопчатой; она наступает быстро – в течение 2-4 часов.
Реакция аггютнации благодаря своей специфичности, простоте и постановке и демонстративности получила широкое распространение в микробиологической практике для диагноза многих инфекционных заболеваний: брюшного тифа, сыпного тифа, паратифов, дизентерии, холеры, бруцеллеза и др. Ею пользуются с диагностической целью в 2 направлений.
1. Для определения выделения выделенного из какого-либо субстрата неизвестного микроба. В этом случае агглютинацию ставят с определенной, заранее приготовленной агглютинирующей сывороткой, полученной путем иммунизации кроликов определенным видом бактерий и, следовательно, содержащей агглютинины в отношении этих бактерий.
В качестве антигена берут культуру неизвестного исследуемого микроба. Положительный результат реакции указывает, что неизвестный микроб идентичен тому, который был взят в качестве антигена для приготовления агглютинирующей сыворотки.
2. Для обнаружения агглютининов к тому или другому определенному виду бактерий в сыворотке больного. В этом случае для агглютинации берут определенную лабораторную культуру бактерий ( или несколько культур бактерий разных видов) в качестве в качестве антигена и сыворотку больного. Положительный результат агглютинации указывает на то, что сыворотке больного имеются агглютинины к определенному , известному, виду микроба, т.е. данный микроб является возбудителем заболевания, в процессе которого в сыворотке больного накопились защитные антитела.
Механизм: «теория решетки».
Активный центр АТ соединяется с 1 антигенной детерминантой, 2-ой активный центр реагирует с антигенной детерминантой, находящейся на 2 молекуле АГ, в результате происходит склеивание. Если в качестве АТ взята безжгутиковая бактерия, то зернистость мелкая – агглютинация., если жгутиковая – Н-агглютинация (крупная зернистость).
Варианты агглютинации:
1. Ориентировочная на стекле – для выявления серологических свойств бактерий, для выявления признаков, для идентификации.
2. Развернутая в пробирках – мало чувствительна и невысоко специфична. Определяется титр АТ (это максимальное разведение сыворотки, в которой обнаружена агглютинация).
3. РНГА (нагрузочная реакция) – реакция непрерывной Геной агглютинации – используется АГ, абсорбированный на эритроцитах барана, т.о. перевод из растворимого в корпускулярный – агглютинация эритроцитов.
Агглютинирующая диагностическая сыворотка готовится путем иммунизации кроликов.
Сыворотка от больного для постановки реакции агглютинации получается из его крови, взятой стерильно на локтевой вене в количестве 5-10 мл. одновременно часть крови употребляется для посева. Если же кровь нужна только для постановки реакции, вполне достаточно 1-2 мл. тогда берут кровь из пальца проколом иглой Франка.
АГ для реакции агглютинации являются соответствующие живые ил убитые культуры бактерий. Живыми культурами пользуются тогда, когда агглютинация ставится с целью определения вида бактерий, выделенных из какого-либо субстрата.
Диагностикумы – диагностические препараты, содержащие АГ и используемые для обнаружения АТ.
24Реакция преципитации и ее значение, область применения. Методы постановки. Преципитирующие сыворотки, их получение и титрование. Использование реакции преципитации в диагностике инфекций.
Реакции преципитации основаны на феномене образования видимого осадка ( преципитата) после взаимодействия растворимых либо находящихся в коллоидном дисперсном состоянии АГ с АТ. РП позволяют выявлять незначительные количества АГ. Они очень чувствительны, и их применяют для тонкого иммунохимического анализа, выявляющего отдельные компоненты в смеси с АГ. Метод имеет много разновидностей.
Реакция кольцепиципитации. На слой антисыворотки наслаивают жидкость, содержащую АГ, и чрез несколько секунд наблюдают образование кольца преципитата.
Реакции микропреципитации применяют для нефелометрического выявления АТ в небольших образцах сыворотки.
Преципитация в геле – на агаре с ее помощью определяют токсигенность выделенных бактерий. При дифтерии, стаф.токсикозе, для определения клеточного иммуноглобулина в сыворотке крови.
Реакция преципитации характеризуется высокой чувствительностью и специфичностью. Она позволяет обнаружить минималейшие следы белка – антигена ( до разведения 1:100000 и выше), благодаря чему преципитация практически стала важной реакцией в химии, биологии и т.д.
Чрезвычайно большое значение реакция преципитации имеет в судебномедицинской практике для распознавания видовой принадлежности крови не только в свежем и жидком состояниях, но также и в высушенном, например, в пятнах очень давнего происхождения на одежде.
В санитарной практике реакция преципитации является методом для определения фальсификации мясных, мучных и других препаратов.
Для серологического диагноза пользуются реакцией преципитации в тех случаях, когда АГ может быть получен только в жидком состоянии, например в вытяжке из инфицированных органов, в спинномозговой жидкости, в моче больного и т.д.
Реакции преципитации можно ставить как с веществами белковой природы – полноценными АГ, так и гаптенами – неполноценными АГ, которые сами по себе не могут вызывать образование АТ, но могут вступать в соединение с ними.
Постановка реакции. Для постановки реакции преципитации необходимо иметь:
- преципитирующую сыворотку, приготовленную путем иммунизации кроликов соответствующим антигеном;
- исследуемый АГ в виде отцентрифугированного или профильтрованного прозрачного раствора ( экстракт их микробных тел, патологических субстратов от больного, органов, кровяных пятен, сывороточные белки и т.д.) Перед постановкой реакции разводят АГ – физиологическим раствором не менее чем на 1:1000;
- физиологический раствор ( для разведения сыворотки и АГ);
- специальные узкие (не шире 0,75 см) пробирки с конусообразным дном и очень прозрачного стекла;
- пастеровские пипетки;
Обязательным условием является полная прозрачность участвующих в реакции агглютинации ингредиентов – сыворотки и АГ. В противном случае результаты реакции будут не ясны.
В пробирку наливают 0,2 мл преципитирующей сыворотки; затем при помощи пастеровской пипетки осторожно наслаивают на сыворотку 0,2 мл АГ ( спускают жидкость по стенке пробирки так, чтобы она не смешивалась с сывороткой, а образовала над ней верхний слой). Добавив АГ. Пробирку ставят в штатив. При положительном результате реакции сразу же или в течение 5-10 минут на границе обеих жидкостей образуется мутное кольцо от выпавшего в осадок АГ. Степень реакции оценивается по величине кольца и времени его проявления.
К опыту ставится несколько контролей, а именно: 1) заведомо известны АГ + специфическая преципитирующая сыворотка; 2) преципитирующая сыворотка + физиологический раствор; 3) нормальная сыворотка + исследуемый АГ.
25Реакция иммунного лизиса как один из механизмом иммунитета. Компоненты реакции, практическое использование.
Одним из защитных свойств иммунной сыворотки при инфекции является ее способность растворять (лизировать) м/о или другие клеточные элементы, поступившие в организм. Специфические АТ, обуславливающие лизис ( растворение) клеток, носят названия лизинов. В зависимости от АГ они точнее называются бактериолизинами, спирохетолизинами, цитолизинами и т.д.
Лизины способны проявлять свое лизирующее действие на АГ только в присутствии дополнительного фактора – комплемента. Комплемент является составной частью любой свежей сыворотки, как нормальной, так и иммунной. При хранении или подогревании сыворотки комплемент разрушается.
Т.о. реакция лизиса происходит при участии двух компонентов: одного специфического, содержащегося в иммунной сыворотке (АТ), и другого неспецифического, присущего любой сыворотке, как иммунной, так и нормальной (комплемент).
Свежеизвлеченная из организма иммунная сыворотка способна к лизису, так как содержит и АТ и комплемент. Если же пользуются иммунной сывороткой, стоявшей или подвергнутой подогреванию и вследствие этого утратившей комплемент, то лизис произойдет только при условии добавления комплемента, т.е. свежей сыворотки. Для обеспечения постоянства результатов иммунную сыворотку заранее инактивируют нагреванием при 56 градусов в течение 30 минут ( для разрушения имеющегося в ней комплемента) и прибавляют к ней строго определенное количество комплемента. В качестве комплемента принято пользоваться свежей сывороткой нормальной морской свинки.
При дифференциации холерных и холероподобных вибрионов.
26. Реакция связывания комплемента в диагностике инфекционных заболеваний. Практическое применение, компоненты реакции.
Данная реакция используется для серодиагностики и обнаружения АГ в исследуемом материале, сероидентификации выделенных культур. Она характеризуется высокой чувствительностью и достаточной специфичностью, а также возможностью применения как корпускулярных, так и растворимых Г. Последнее связано с тем, что комплемент связывается с Fc- фрагментом АТ независимо от их специфичности. Таким образом, способность комплемента связываться только с комплексом АГ-АТ за счет Fc-фрагментов последнего и на вызывать гемолиз сенсибилизированных эритроцитов (тест-система) послужила основой для широкого применения РСК в лабораторной практике в течение прошедшего столетия.
Для постановки РСК требуется предварительная подготовка ингредиентов реакции, особенно комплемента, в качестве которого используют сыворотку морской свинки с установкой рабочей дозы. Однако за последние десятилетия выпускается сухой оттитрованный комплемент, что значительно облегчило постановку реакции. Исследуемые сыворотки крови и антигены обязательно контролируются на антикомплиментарность.
Постановку основного опыта производят в пробирках путем внесения в нее определенных объемов сыворотки крови, антигена и рабочей дозы комплемента. Смесь инкубируют в термостате при температуре 37 градусов в течение часа. Регистрацию результатов реакции проводят по гемолизу сенсибилизированных эритроцитов барана. Их приготавливают при смешивании гемолитической сыворотки кролика с эритроцитами барана. При внесении комплемента в эту смесь происходит реакция гемолиза. Т.о в тех случаях, когда комплемент не связывается с исследуемой системой АГ-АТ, т.е. остается свободным, наблюдается полный гемолиз бараньих эритроцитов, который свидетельствует об отрицательной реакции. Отсутствие гемолиза указывает на связывание комплемента системой АГ-АТ, т.е на положительную реакцию, которая обозначается крестами. Интенсивность задержки гемолиза оценивается по четырехкратной системе, при этом полное отсутствие гемолиза обозначается ++++
27Неполные антитела. Реакция Кумбса (прямая и непрямая). Обнаружение антител к резус фактору у беременных женщин.
Неполные АТ – АТ, имеющие только один активный центр – являются одновалентными.
Реакция Кумбса.
Метод выявляет неполные (одновалентные) АТ, образующиеся при бруцеллезе, резус-конфликте или системных коллагенозах. Для постановки реакции необходима антиглобулиновая сыворотка, содержащая полные ( как минимум двухвалентные) АТ.
Неполные антитела в отличии от нормальных моновалентны, поскольку они имеют один активный центр, способный взаимодействовать только с одним эпитопом: в то время как другие эпитопы остаются не связанными. В результате этого не происходит образования крупных комплексов, выпадающих в осадок в растворе электролита. Последние проявляются только в реакциях с бивалентными АТ. Для исправления этого положения вводится антиглобулиновая сыворотка (АГС), содержащая бивалентные АТ к глобулину, которая свяжет между собой моновалентные АТ. Содержащиеся в исследуемом материале. Таким образом произойдет визуально видимая гемагглютинации или агглютинация, свидетельствующая о наличии в исследуемой сыворотке неполных (моновалентных) антител. Например, в случае беременности резус-отрицательной женщины резус-положительным плодом у нее в сыворотке крови появятся неполные антитела. Для их выявления в пробирку с исследуемой сывороткой крови вносят резус- положительные эритроциты, а затем АГС. Появление гемагглютинации свидетельствует о положительной реакции.
28. Реакция иммунофлюоресценции (РИФ). Разработана А. Кунсом и носит
его имя (метод Кунса). Это один из методов исследования, в котором
используются меченные антитела. В качестве метки используется краситель,
дающий свечение в ультрафиолетовых лучах (изоцианат флюоресцеина или
просто флюорохром). Риф используется в двух модификациях: прямой
метод Кунса и непрямой метод Кунса. Прямой метод: исследуемый
материал, зафиксированный на предметном стекле, обрабатывается меченой
флюорохромом диагностической сывороткой; обязательный этап реакции –
отмывка от непрореагировавших антител; если в исследуемом материале есть
искомый антиген, меченные антитела фиксируются на антигене и после
отмывки такой комплекс выявляется по свечению при просматривании
препарата под люминесцентным микроскопом. Непрямой метод: в этом
случае реакция идет в два этапа – на первом этапе используется немеченая
диагностическая сыворотка, на втором этапе используется меченая
флюорохромом антиглобулиновая сыворотка; с помощью непрямого метода
можно выявлять в исследуемом материале как наличие антигена, так и
наличие и титр специфических антител.
Люминесцирующие (флюоресцирующие) сыворотки представляют собой
иммунные сыворотки, содержащие специфические антитела, меченые
флюоресцирующими красителями. При приготовлении люминесцирующих
сывороток проводят присоединение к глобулиновой фракции иммунной
сыворотки флюорохромов путем прочной химической связи. Люминес
цирующие сыворотки используют при постановке РИФ.
29. Реакция нейтрализации – способность антител нейтрализовать токсины,
вирусы, яды змей. Используется для индикации и идентификации токсинов,
для идентификации вирусов, и др. РН не дает видимого результата in vitro,
поэтому она учитывается по биопробе на животных или в культуре ткани. РН
in vivo может быть использована для определения степени напряженности
антитоксического иммунитета в организме человека (проба Шика).
Токсин – яд микробного происхождения. Токсины микробов делятся на
эндотоксины и экзотоксины. Характеристика токсинов см. тема №6.
Анатоксин – обезвреженный токсин. Получают из экзотоксинов путем их
обработки формалином и теплом. Анатоксин не обладает ядовитостью, при
этом сохраняет антигенные и иммуногенные свойства токсина. Сила
действия анатоксина измеряется в ИЕ. ИЕ (иммуногенная единица) – это
такое количество анатоксина, которое в смеси с 1 АЕ сыворотки дает
инициальную флоккуляцию. Титр анатоксина – количество ИЕ в 1 мл.
Анатоксины титруют в реакции флоккуляции. Анатоксин используется в
качестве вакцины для создания активного антитоксического иммунитета.
Примером таких вакцин являются дифтерийный анатоксин, столбнячный
анатоксин и др. Анатоксин используется также дл получения
антитоксических сывороток.
Антитоксин или антитоксическая сыворотка – сыворотка, содержащая
антитела к токсину. Антитоксические сыворотки – это гетерологичные
сыворотки, их получают путем гипериммунизации лошадей
соответствующими анатоксинами с последующим взятием у животных крови
и получения сыворотки. Содержание антитоксина в антитоксических
сыворотках выражается в международных единицах (ME), принятых ВОЗ.
Например, 1 ME противостолбнячной сыворотки соответствует ее
минимальному количеству, нейтрализующему 1000 минимальных
смертельных доз (DLm) столбнячного токсина для морской свинки массой
350 г. 1 ME противоботулинического антитоксина - наименьшее количество
сыворотки, нейтрализующее 10000 DLm ботулинического токсина для
мышей массой 20 г. 1 ME противодифтерийной сыворотки соответствует ее
минимальному количеству, нейтрализующему 100 DLm дифтерийного токси-
на для морской свинки массой 250 г.
30. Реакция флоккуляции (РФ) - используется для титрования
антитоксических сывороток, токсинов и анатоксинов. В реакции
флоккуляции в качестве антигена участвует токсин или анатоксин. При
смешивании их в эквивалентных соотношениях с антитоксической
сывороткой появляется помутнение, а затем рыхлый осадок. Реакции возможны только с лошадиными (но не с кроличьими) антитоксическими сыворотками или антитиреоглобулиновыми человеческими антисыворотками. Механизм РФ
сходен с таковым реакции преципитации.
В реакциях нейтрализации и флоккуляции участвуют в качестве компонентов
токсины, анатоксины, антитоксины (антитоксические сыворотки
31. Иммуноферментный анализ — лабораторный иммунологический метод качественного или количественного определения различных соединений, макромолекул, вирусов и пр., в основе которого лежит специфическая реакция антиген-антитело. Выявление образовавшегося комплекса проводят с использованием фермента в качестве метки для регистрации сигнала.
Классификация по типу иммунохимического взаимодействия на первой стадии анализа (в которой происходит связывание определяемого вещества). Если в системе присутствуют только анализируемое соединение и соответствующие ему центры связывания (антиген и специфические антитела), то метод являетсянеконкурентным. Если же на первой стадии в системе одновременно присутствует анализируемое соединение и его аналог (меченное ферментом анализируемое соединение или анализируемое соединение, иммобилизованное на твердой фазе), конкурирующие за ограниченное количество центров специфического связывания, то метод является конкурентным.
Среди конкурентных схем твердофазного ИФА существует два основных формата:
1. Прямой конкурентный формат ИФА использует иммобилизованые на твердой фазе специфические антитела, а меченый ферментом и немеченый антигенконкурируют за связь с иммобилизованным антителом.
В непрямом конкурентном формате ИФА используются меченные ферментом антитела (специфические или вторичные) и иммобилизованный на твердой фазе конъюгат антиген-белок-носитель.
Таким образом, за счёт несомненных преимуществ иммуноферментного анализа: удобства в работе, быстроты, объективности за счёт автоматизации учёта результатов, возможности исследования иммуноглобулинов различных классов (что важно для ранней диагностики заболеваний и их прогноза) в настоящее время является одним из основных методов лабораторной диагностики.
Основные типы тест-систем (диагностических наборов) в зависимости от используемых антигенов
В зависимости от того, какие антигены используются, иммуноферментные тест-системы подразделяются на:
1. Лизатные — в которых используется смесь нативных антигенов (лизированный или обработанный ультразвуком возбудитель инфекции, полученный в культуре);
2. Рекомбинантные — в которых используются полученные генно-инженерным способом белки-аналоги определённых белковых антигенов возбудителя;
3. Пептидные — использующие химически синтезированные фрагменты белков.
32.
33. 1) Эрлиха теория иммунитета ( теория боковых цепей) — одна из первых теорий антителообразования, согласно которой у клеток имеются антигенспецифические рецепторы, высвобождающиеся в качестве антител под действием антигена.
2) Клонально-селективная теория, теория Бернета — теория, согласно которой в организме возникают клоны клеток, иммунокомпетентных в отношении различных антигенов; антиген избирательно контактирует с соответствующим клоном, стимулируя выработку им антител.
1. Антитела и лимфоциты с необходимой специфичностью уже существуют в организме до первого контакта с антигеном.
2. Лимфоциты, участвующие в иммунном ответе, имеют ан