ВНИМАНИЕ: Соблюдать меры безопасности при работе с концентрированной серной кислотой и кипячением на водяной бане.
ХОД РАБОТЫ.
а) Биуретовая реакция на полипептиды.
К 5 каплям гидролизата добавляют 10 капель 10% раствора NaOH, затем 2 капли 1% раствора CuSO4. Образуется комплекс фиолетового цвета.
б) Серебряная проба на пуриновые основания.
К 10 каплям гидролизата приливают 10 капель концентрированного аммиака (!), затем добавляют 10 капель 2% аммиачного раствора нитрата серебра. При стоянии через 3-5 минут образуется светло-коричневый осадок серебряных солей пуриновых оснований.
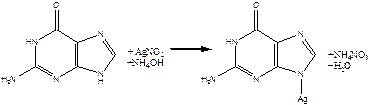
в) Качественная реакция на пентозу (Молиша).
 К 5 каплям гидролизата добавляют 3 капли 1% спиртового раствора тимола, перемешивают и по стенке пробирки осторожно наслаивают 20 капель концентрированной серной кислоты (!). При встряхивании на дне пробирки образуется продукт конденсации фурфурола с тимолом красного цвета.
К 5 каплям гидролизата добавляют 3 капли 1% спиртового раствора тимола, перемешивают и по стенке пробирки осторожно наслаивают 20 капель концентрированной серной кислоты (!). При встряхивании на дне пробирки образуется продукт конденсации фурфурола с тимолом красного цвета.
г) Качественная реакция на углеводы.
К 5 каплям гидролизата дрожжей приливают 3 капли 0,2% спиртового раствора альфа-нафтола и 20 капель концентрированной серной кислоты (!). Наблюдают появление розово-фиолетового окрашивания.
д) Реакция на дезоксирибозу и рибозу.
К 5 каплям гидролизата дрожжей добавляют 20 капель 1% раствора дифениламина и кипятят на водяной бане в течение 15 минут, при этом образуется сине-зеленое окрашивание, поскольку дифениламин с дезоксирибозой дает синее окрашивание, а с рибозой - зеленое.
е) Молибденовая проба на фосфорную кислоту.
К 10 каплям гидролизата дрожжей приливают 20 капель молибденового реактива и кипятят несколько минут на открытом огне спиртовки. При этом жидкость окрашивается в желтый цвет. Пробирку сразу охлаждают в струе холодной воды. На дне пробирки появляется кристаллический лимонно-желтый осадок фосфорномолибденовокислого аммония.
Порядок оформления работы: результаты лабораторной работы записывают в тетрадь в виде таблицы:
| Открываемое соединение | Используемые реактивы | Продукты реакции | Чем обусловлена реакция? |
| 1) | |||
| 2) | |||
| 3) | |||
| 4) | |||
| 5) | |||
| 6) |
ВЫВОДЫ:
ЗАНЯТИЕ 22
ТЕМА: Белки 5. Биосинтез белка. Регуляция биосинтеза. Патология белкового обмена.
Цель занятия: сформировать представления об этапах биосинтеза белка, механизмах его регуляции и молекулярных аспектах основных нарушений азотистого обмена. Освоить рефрактометрический метод определения концентрации белка в сыворотке крови.
Исходный уровень знаний и навыков:
Студент должен знать:
1. Строение, классификацию и свойства основных классов нуклеиновых кислот
2. Строение рибосом
3. Механизмы регуляции активности ферментов
4. Структуру и функцию иммуноглобулинов
5. Энзимопатии (общая характеристика)
Студент должен уметь:
1. Проводить исследование на рефрактометре
Структура занятия:
1. Теоретическая часть.
1.1. Принципиальное отличие биосинтеза белка от биосинтеза других молекул. Общая схема биосинтеза белка - необходимые предпосылки:
1.1.1. информационный поток - схема передачи информации (центральная догма молекулярной биологии). Репликация и транскрипция ДНК - ферменты, механизм. Обратная транскрипция, роль ревертаз. Процессинг и сплайсинг иРНК. Характеристика генетического кода, кодон, антикодон.
1.1.2. пластический поток - механизм активации аминокислот, строения тРНК, характеристика АРС-аз - кодаз.
1.1.3. энергетический поток. Роль макроэргов АТФ, ГТФ и др. в биосинтезе белка.
1.2. Рибосомы - принципы организации, строение, состав. Механизм трансляции - этапы рибосомального цикла:
1.2.1. инициация, факторы инициации. Образование инициаторного комплекса.
1.2.2. элонгация, факторы элонгации.
1.2.3. терминация.
1.3. Виды и механизмы посттрансляционной модификации (процессинга) пробелков:
1.3.1. химическая модификация (виды, примеры);
1.3.2. ограниченный протеолиз;
1.3.3. самосборка белка.
1.4. Регуляция биосинтеза белка у прокариот. Особенности регуляции биосинтеза белка у эукариот:
1.4.1. избирательная транскрипция.
1.4.2. альтернативный сплайсинг иРНК.
1.4.3. модификация гистоновых и негистоновых белков.
1.5. Строение иммуноглобулинов (Ig). Характеристика основных классов Ig - (IgA, IgD, IgE, IgG, IgM). Регуляция экспрессии генов Ig и причины их разнообразия.
1.6. Патология белкового обмена. Нарушение переваривания и всасывания, последствия ахилии. Белковое голодание, квашиоркор, их последствия и основные проявления. Биосинтез дефектных белков. Первично- и вторично-дефектные белки. Относительно патологические белки. Поврежденные белки.
2. Практическая часть - выполнение лабораторной работы:
2.1. Определение общего белка сыворотки крови рефрактометрическим методом.
3. Решение задач и проведение контроля конечного уровня
Литература основная:
1. Материал лекций.
2. Березов Т. Т., Коровкин Б.Ф. Биологическая химия, М., Медицина, 1990, стр. 354-364; Медицина, 1998, стр. 509-544.
3. Николаев А. Я. Биологическая химия, М., Высшая школа, 1989, стр. 92-156.
дополнительная:
4. Марри Р. и др. Биохимия человека, М., Мир, 1993, том 2, стр. 94-126, 321-325.
5. Филиппович Ю.Б. Основы биохимии, М., Высшая школа, 1993, стр. 272-297.
6. Албертс Б. и др. Молекулярная биология клетки, М., Мир, 1994, том 2, стр. 176-253.
7. Ленинджер А. Основы биохимии, М., Мир, 1985, том 3, стр. 926-994.
8. Троицкий В.Г. Дефектные белки - постсинтетическая модификация, Киев, Наукова думка, 1991, стр. 48-226.
ЗАДАЧИ:
1. Активация аминокислот происходит с помощью фермента:
| а) лигаза | в) РНК-аза | д) синтетаза |
| б) фосфатаза | г) пептидаза | е) лиазы |
2. Аминокислоты в белках ковалентно связаны:
| а) силами Ван-дер-Ваальса | г) фосфоэфирными связями |
| б) пептидными связями | д) водородными связями |
| в) гидрофобными связями | е) координационными связями |
3. Какие белки узнают терминирующие кодоны мРНК?
| а) факторы освобождения | в) факторы элонгации |
| б) ферменты рестрикции | г) CAP-связанные белки |
4. Характерной чертой рибосом эукариот является:
| а) наличие двух субъединиц - 30 и 50 S | г) присутствие ДНК |
| б) наличие двух субъединиц - 40 и 60 S | д) наличие фосфолипидов |
| в) высокая АТФ-азная активность | е) наличие гистонов |
5. Точковая мутация мРНК будет наиболее вероятной причиной:
а) распада мРНК
б) инактивации рибосом
в) изменения первичной структуры белка
г) незавершенной транскрипции
д) подавления сплайсинга
6. Внутривенное введение радиоактивной меченой аминокислоты взрослому животному приводит к:
а) инкорпорации эквивалентных количеств меченой аминокислоты во все белки организма
б) инкорпорации различных количеств меченой аминокислоты в отдельные белки организма
в) меченая аминокислота не инкорпорируется в белок
г) быстрой и полной экскреции меченой аминокислоты
д) вытеснению и экскреции равного количества немеченной аминокислоты
7. Белки синтезируются:
| а) от N-конца к С-концу | г) с матрицы иРНК |
| б) от С-конца к N-концу | д) от 3’-конца к 5’-концу РНК |
| в) с матрицы рРНК | е) от 5’-конца к 3’-концу РНК |
8. Основные каталитические функции в рибосоме осуществляют:
| а) факторы инициации | г) р-РНК |
| б) факторы элонгации | д) синтетазы |
| в) факторы терминации | е) рибосомальные белки |
9. Каждая рибосома в полисоме:
а) движется по мРНК в направлении 3`®5`
б) движется по мРНК в направлении 5`®3`
в) синтезирует многие полипептидные цепи
г) синтезирует только одну полипептидную цепь
д) диссоциирует по окончании синтеза
е) подавляется актиномицином Д
10. Укажите основной фермент ответственный за реализацию информации генома ретровирусов:
| а) ДНК-лигаза | г) РНК-полимеразы |
| б) ДНК-полимераза | д) АРС-аза |
| в) обратная транскриптаза (ревертаза) |
11. Какая из нуклеиновых кислот в животной клетке отличается большей стабильностью?
| а) мРНК | г) мяРНК |
| б) рРНК | д) предшественники тРНК |
| в) ДНК | е) гяРНК |
12. Денатурированная ДНК лимфоцитов человека не будет гибридизироваться с:
| а) рРНК лимфоцитов | в) денатурированной ДНК митохондрий |
| б) тРНК почки | г) мРНК мозга |
13. Дифтерийный токсин подавляет биосинтез белка на этапе и путем:
| а) инициации | е) рибозилирования ФЭ-2 |
| б) элонгации | ж) ограниченного протеолиза |
| в) терминации | з) аденилирования белка |
| г) процессинга иРНК | и) метилирования белка |
| д) сплайсинга иРНК | к) фосфорилирования белка |
Практическая часть:
Лабораторная работа №1: Определение общего белка сыворотки крови рефрактометрическим методом.
ПРИНЦИП МЕТОДА: В основе рефрактометрии лежит различная преломляющая способность жидких сред, количественно выражаемая коэффициентом преломления (отношение синуса угла падения (a) к синусу угла преломления (b):
Sin a
n =¾¾¾¾,
Sin b
который в сыворотке крови обусловлен в основном количеством, качеством растворенного белка и температурой. Влияние других компонентам сыворотки крови на коэффициент преломления значительно меньше. Определение коэффициента преломления проводят с помощью рефрактометров.
Содержание белка (%) в плазме (сыворотке) крови
| Коэффициент преломления | Содержание белка (%) | Коэффициент преломления | Содержание белка (%) |
| 1,33705 | 0,63 | 1,34575 | 3,68 |
| 1,33743 | 0,86 | 1,34612 | 5,90 |
| 1,33781 | 1,08 | 1,34650 | 6,12 |
| 1,33820 | 1,30 | 1,34687 | 6,34 |
| 1,33858 | 1,52 | 1,34724 | 6,55 |
| 1,33896 | 1,74 | 1,34761 | 6,77 |
| 1,33934 | 1,96 | 1,34798 | 6,98 |
| 1,33972 | 2,18 | 1,34836 | 7,20 |
| 1,34000 | 2,40 | 1,34873 | 7,42 |
| 1,34048 | 2,62 | 1,34910 | 7,63 |
| 1,34086 | 2,84 | 1,34947 | 7,85 |
| 1,34124 | 3,06 | 1,34984 | 8,06 |
| 1,34162 | 3,28 | 1,35021 | 8,28 |
| 1,34199 | 3,50 | 1,35058 | 8,49 |
| 1,34237 | 3,72 | 1,35095 | 8,71 |
| 1,34275 | 3,94 | 1,35132 | 8,92 |
| 1,34313 | 4,16 | 1,35169 | 9,14 |
| 1,34350 | 4,38 | 1,35205 | 9,35 |
| 1,34388 | 4,60 | 1,35242 | 9,57 |
| 1,3442 | 4,81 | 1,35279 | 9,78 |
| 1,34463 | 5,03 | 1,35316 | 9,99 |
| 1,34500 | 5,25 | 1,35352 | 10,20 |
| 1,34537 | 5,47 | 1,35388 | 10,41 |
РАСЧЕТ: Определив показатель преломления по таблице, вычисляют процент содержания белка в сыворотке крови, для перехода к единицам системы СИ (г/л), результат следует умножить на 10.
НОРМА: содержание общего белка в плазме (сыворотке) крови здорового человека составляет 6.5-8.5 % или 65-85 г/л.
ВЫВОД:
ЗАНЯТИЕ 23
ТЕМА: Контрольное занятие по теме “Белки”.
Контрольные вопросы:
1. Биологическая ценность белка. Нормы белка в питании.
2. Заменимые и незаменимые аминокислоты. Биосинтез заменимых аминокислот из глюкозы. Другие источники синтеза аминокислот.
3. Обмен простых белков. Переваривание белков в желудке.
4. Состав и свойства желудочного сока. Значение компонентов желудочного сока в переваривании белков (HCl, пепсин, слизь).
5. Кишечный сок. Ферменты сока и значение в переваривании пищи. Значение определения в клинической практике.
6. Механизм переваривания и всасывания в ЖКТ. Роль градиента pH различных отделов ЖКТ в переваривании белков.
7. Гниение белков в толстом кишечнике.
8. Обезвреживание продуктов гниения в печени.
9. Пути утилизации аминокислот в тканях. Аминокислотный пул клетки. Пути поступления и утилизации аминокислот в организме.
10. Прямое окислительное дезаминирование аминокислот. Ферменты, участвующие в этих процессах. Биологическая роль дезаминирования.
11. Переаминирование аминокислот. Ферменты. Коферменты. Значение этого процесса для клетки. Определение активности трансаминаз с диагностической целью.
12. Непрямое окислительное дезаминирование. Механизм. Значение.
13. Аммиак, его токсичность. Пути детоксикации аммиака (восстановительное аминирование, образование ГЛН, АСН). Аммониогенез.
14. Образование мочевины. Локализация процесса. Реакции. Ферменты.
15. Биологическая роль цикла мочевинообразования. Врожденные дефекты ферментов орнитинового цикла. Локализация ферментов и основные клинические проявления.
16. Связь цикла синтеза мочевины с ЦТК и обменом аминокислот. Энергетическая емкость цикла синтеза мочевины.
17. Декарбоксилирование аминокислот. Ферменты. Коферменты. Биогенные амины, их роль.
18. Пути превращения безазотистого остатка аминокислот. Гликогенные и кетогенные аминокислоты. Пути вступления аминокислот в ЦТК.
19. Обмен серина и глицина. Роль ТГФК в обмене (биосинтез холина, этаноламина, пуриновых оснований, гема, креатина, ПВК, глутатиона, коллагена, гиппуровой кислоты, желчных кислот). Нарушения обмена ГЛИ.
20. Глутаминовая кислота. Дезаминирование. Трансаминирование. Ферменты. Биологическое значение. Адаптивная, антигипоксическая и антиоксидантная роль глутаминовой кислоты.
21. Реакции гидроксилирования. ПРО, ЛИЗ, ФЕН (значение микросомального окисления, роль аскорбата, NADPH, цитохрома Р450).
22. Особенности обмена ПРО. Биосинтез, распад. Нарушение обмена ПРО (клинические проявления).
23. Аспарагиновая кислота. Трансаминирование. Декарбоксилирование. Биологическая роль в биосинтезе мочевины, пуриновых и пиримидиновых оснований, детоксикации аммиака.
24. Особенности обмена цистеина - его биологические функции, антитоксическая, антиоксидантная и радиопротекторная роль. Нарушения обмена. Основные клинические проявления.
25. Особенности обмена метионина. S-аденозилметионин, его роль в синтезе холина, адреналина, карнитина, креатинина, в реакциях детоксикации и др.
26. Особенности обмена фенилаланина и тирозина. Биосинтез катехоламинов, тиреоидных гормонов. Нарушения обмена фенилаланина, тирозина (фенилкетонурия, алкаптонурия, альбинизм).
27. Обмен гистидина. Образование гистамина, дипептидов ансерина, карнозина. Протекторная роль гистидина.
28. Пути обмена триптофана. Клинические проявления в нарушении обмена.
29. Пути обмена аргинина. Адаптивная роль системы аргинин - аргиназа - мочевина.
30. Применение аминокислот в медицине.
31. Интеграция углеводного, липидного и белкового обменов. Общие метаболиты.
32. Сложные белки. Строение. Классификация. Биологическая роль.
33. Строение нуклеопротеидов. Особенности строения рибосом и хромосом.
34. Обмен нуклеопротеидов. Переваривание, всасывание. Судьба нуклеотидов, нуклеозидов, свободных пуриновых и пиримидиновых оснований.
35. Биосинтез и распад пиримидиновых нуклеотидов. Оротовая кислота. Роль ТГФК в синтезе пиримидиновых нуклеотидов.
36. Биосинтез и распад пуриновых нуклеотидов. Исходные субстраты синтеза. Регуляция синтеза. Роль продуктов распада пуринов в инициации перекисных процессов.
37. Нарушения обмена пуринов. Образование мочевой кислоты. Значение определения содержания мочевой кислоты в крови и в моче в клинической практике.
38. Строение нуклеиновых кислот: ДНК и РНК. Первичная и вторичная структура. Формы и типы ДНК.
39. Особенности строения транспортной тРНК. Участие ее в процессе активирования аминокислот.
40. Матричный механизм синтеза ДНК (репликация и репарация). Ферменты. Субстраты.
41. Роль ДНК в синтезе различных РНК. Процессинг и сплайсинг РНК.
42. Перенос генетической информации с ДНК на белок. Общая схема биосинтеза белка.
43. Информационный поток биосинтеза белка (репликация, транскрипция ДНК, процессинг, сплайсинг). Роль ревертазы в биосинтезе вирусных белков. Характеристика генетического кода.
44. Пластический поток. Механизмы активации аминокислот. Характеристика ферментов.
45. Энергетический поток. Роль АТФ, ГТФ.
46. Механизмы трансляции, рекогниции, инициации, элонгации, терминации.
47. Процессинг пробелков. Виды. Механизмы: химическая модификация, ограниченный протеолиз, самосборка молекул.
48. Регуляция биосинтеза. Особенности регуляции биосинтеза у эукариот - избирательная транскрипция, альтернативный сплайсинг иРНК. Химическая модификация гистоновых и негистоновых белков.
49. Полиморфизм белков на примере иммуноглобулинов. Структура иммуноглобулинов. Регуляция экспрессии генов иммуноглобулинов. Особенности биосинтеза иммуноглобулинов
50. Патология белкового обмена: белковое голодание, квашиоркор, биосинтез дефектных белков, первичные и вторичные протеинопатиии, поврежденные белки.