Потенційні можливості застосування людських стовбурових клітин
Людські стовбурові клітини можуть бути застосовані в багатьох фундаментальних та клінічних дослідженнях, проте є багато технічних перепон для їх реалізації.
Дослідження людських стовбурових клітини може дати інформацію про ті складні процеси, які відбуваються під час розвитку людини.
Деякі серйозні захворювання, такі як злоякісні пухлини чи аномалії розвитку людини виникають внаслідок неправильного поділу клітин та їх диференціації.
Краще розуміння генетичних та молекулярних механізмів контролю цих процесів може допомогти зрозуміти як виникають ці захворювання та які нові стратегії їх лікування можуть бути. Суттєвою перепоною на цьому шляху є недостатність інформації про сигнали, які включають та виключають відповідні гени і впливають на диференціацію стовбурових клітин.
Людські стовбурові клітини можуть також застосовуватися для тестування нових ліків. Наприклад, безпечність нових медикаментів можна перевіряти на диференційованих клітинах утворених з плюріпотентних клітинних ліній. Інші типи клітинних ліній вже застосовуються в даний час. Наприклад, клітинні лінії ракових клітин застосовуються для тестування потенційних протиракових препаратів. А легка доступність плюріпотентних стовбурових клітин дасть можливість проводити дослідження на багатьох різних типах клітин.
Для проведення ефективного тестування медикаментів важливо, щоб при порівнянні двох ліків були забезпечені одинакові умови. Тому, необхідно точно контролювати процес диференціації стовбурових клітин у специфічні клітини, на яких буде проводитися тестування ліків. Теперішній рівень знань є недостатнім для забезпечення умов для отримання ідентичних диференційованих клітин для кожного випробування ліків.
Одним з найважливіших застосувань людських стовбурових клітин є генерування клітин та тканин, які можна було би застосовувати при клітинних методах лікування. Зараз для заміни хворих чи знищених тканин часто застосовуються донорські органи і тканини, але потреба у тканинах та органах для трансплантації далеко перевищує пропозицію. Стовбурові клітини, спрямовані диференціюватися в специфічні типи клітин, могли би бути джерелом для отримання клітин та тканин, необхідних для лікування багатьох захворювань, включаючи хворобу Паркінсона та Альцгеймера, травму спинного мозку, інсульти, опіки, захворювання серця, діабет, остеоартрит та ревматоїдний артрит.
Наприклад, імовірно, що скоро буде можливість створити в лабораторії здорові клітини серцевого м’язу і потім пересадити ці клітини пацієнту з хронічним захворюванням серця. Попередні дослідження на мишах та інших тваринах показують, що стовбурові клітини з кісткового мозку, при пересадці їх в пошкоджене серце можуть генерувати клітини серцевого м’язу, та успішно замінити тканини серця. Інші дослідження, проведені на культурах клітин показали можливість керованої диференціації ембріональних стовбурових клітин чи дорослих стовбурових клітин з кісткового мозку в клітини серцевого м’язу.
У пацієнтів з цукровим діабетом першого типу клітини підшлункової залози, які в нормі виробляють інсулін, руйнуються власною імунною системою пацієнта. Нові дослідження вказують на можливість спрямовувати диференціацію людських ембріональних стовбурових клітин в культурі клітин на формування інсулін продукуючих клітин, які можуть бути застосовані для трансплантаційного лікування діабету.
Для реалізації можливостей клітинної терапії для лікування цих важких та інвалідизуючих захворювань необхідно вміти легко та надійно управляти стовбуровими клітинами для їх успішної диференціації, трансплантації та приживлення. Внизу приведено перелік кроків, необхідних для успішного втілення клітинної терапії в практику. Для цього необхідно, щоб стовбурові клітини могли:
• Інтенсивно розмножуватися та генерувати достатню кількість тканини;
• Диференціюватися в бажаний тип клітин;
• Виживати в реципієнта після трансплантації;
• Інтегруватися в оточуючі тканини після трансплантації;
• функціонувати відповідним чином протягом життя реципієнта;
• Жодним чином не шкодити реципієнту.
Також, для вирішення проблеми імунного відторгнення, вивчаються різні стратегії створення тканин, які не будуть відторгненими.
Підсумовуючи можна сказати, що майбутнє застосування стовбурових клітин є дуже багатообіцяючим, але необхідні ще роки інтенсивних досліджень для того, щоб їхнє використання було максимально безпечним. [3]
3.Регенереція(Оновлення)
Одним із основних процесів життєдіяльності клітин є процес відновлення, тобто регенерація.
Регенерація (від лат. regeneratio — відродження) — процес відновлення організмом втрачених або пошкоджених структур.
Здатність відновлювати цілісність організму є фундаментальною властивістю живих істот. Регенерація зустрічається у всіх розгалуженнях філогенетичного дерева — від найпростіших до вищих ссавців і протягом всього онтогенезу — від раннього ембріона на стадії дроблення до найстаріших представників в популяції. Чому будь-який орган у одного виду здатний до регенерації, а у близького виду ні — ці обставини є загадковими. Розрізняють дві форми регенерації:
1. Внутрішньоклітинна — молекулярна, внутрішньоорганоїдна та органоїдна регенерації.
2. Клітинна регенерація — в основі має прямий та непрямий поділ клітин.
3.1.Фізіологічна регенерація
Відбувається протягом усього життя організму і характеризується оновленням клітин слизових, серозних оболонок, внутрішніх органів, різних тканин, залежно від зміни умов їх існування в процесі виконання тих або інших функцій. Подібна регенерація постійно відбувається, наприклад, у покривному епітелії, в якому періодично спостерігається десквамація зроговілих клітин із заміною їх клітинами глибших шарів, що розмножуються; аналогічним чином відбувається також розмноження та дозрівання в кістковому мозку еритроцитів, лейкоцитів тощо.У високодиференційованих клітинах, де регенерація за рахунок клітинного поділу неможлива, цей процес характеризується періодичним оновленням тих або інших внутрішньоклітинних органел (головний мозок, серце тощо). Репаративна (відновна) регенерація є по суті посиленою фізіологічною регенерацією у хворому організмі. Іншими словами, під час захворювання фізіологічна регенерація «трансформується» в репаративну, яка після одужання хворого знову повертається в рамки фізіологічної.
3.2.Репаративна регенерація
Буває у двох формах. У першому випадку некроз, що є наслідком патологічного процесу, поступово заміщується тканиною, ідентичною тій, що загинула, і місце пошкодження зникає безслідно. Такий вид регенерації називають повним, або реституцією. Подібна форма особливо характерна для тих органів і тканин, в яких регенерація відбувається тільки в клітинній формі (кістковий мозок, епідерміс, епітелій слизових оболонок та ін.).
Але в окремих випадках вона може спостерігатись і там, де репаративна регенерація відбувається як шляхом поділу клітин, так і за рахунок гіперплазії внутрішньоклітинних структур. Ці зміни зникають безслідно при одужанні хворого, причому структура окремих клітин та тканин не відрізняється від норми. В інших випадках нормалізація порушених функцій забезпечується за рахунок гіперплазії клітин (та внутрішньоклітинних структур) не в місці пошкодження, а в навколишніх тканинах. Сама ж ділянка некрозу поступово заповнюється сполучною тканиною, яка в подальшому трансформується в рубець. Така форма називається неповною регенерацією, або субституцією. Цей вид регенерації найчастіше відбувається в органах, де переважає внутрішньоклітинна «ГГ форма» (центральна нервова система, серце).
Так, наприклад, в міокарді ділянки некрозу завжди організуються з формуванням кардіосклерозу, а відновлення скоротливої функції серцевого м'яза забезпечується збільшенням кількості ядерних та цитоплазматичних ультраструктур у життєздатних клітинах, які таким чином гіпертрофуються.
3.3.Патологічна регенерація
Патологічна регенерація це така, що перебігає не так, як у звичайних умовах. Виникає при спотворенні ходу регенераторного процесу. Це спостерігається при порушенні харчування (білкова, вітамінна недостатність), нервової регуляції, гормональних розладах, пригніченні імунних реакцій і характеризується сповільненням або спотворенням регенерації. У цих випадках загоєння рани, перелому кістки затримується і набуває в'ялого перебігу, виникають виразки, що не загоюються, колоїдні рубці, несправжні суглоби та ін. Патологічна регенерація спостерігається, як правило, при відсутності загальних та місцевих умов. Основними загальними умовами є вік і стан хворого. У молодому віці репаративні процеси перебігають значно інтенсивніше, ніж у похилому і старечому.
В ослабленої, виснаженої хворобою людини процеси репарації є в'ялими і нерідко набувають форми патологічної регенерації. I навпаки, у фізично здорових людей звичайно спостерігають інтенсивний перебіг процесів відновлення тканин. Велику роль в цьому відіграє повноцінна регуляція репаративних процесів нейроендокринною системою. Серед місцевих умов, що визначають перебіг процесу регенерації, слід назвати характер агента що завдав шкоди й особливості пошкодження тканини.
Протягом життя дорослого організму відбувається безперервна зміна клітин: одні відмирають, інші розмножуються, поповнюючи цю спад. У людини щодня гине близько 2% клітин (500 млрд.) і стільки ж утворюється знову. Цей процес називають фізіологічною регенерацією. У ряді тканин і органів він не виражений (клітини центральної нервової системи, органи чуття, м’язи). Тому клітини цих тканин і органів розглядають як оновлюються на субклітинному або молекулярному рівні.
У тих тканинах, де має місце фізіологічна регенерація, швидкість зміни диференційованих клітин і, отже, тривалість їх життя різні. Одні клітини швидко гинуть і замінюються новими (ентероцита тонкого кишечника – 1-2 діб, епідермоціти – 4-10 діб, гранулоцити – 3-7 діб, еритроцити – 3-4 міс), інші – значно повільніше (клітини багатьох паренхіматозних органів).
Регенерація супроводжується поділом клітин шляхом мітозу, ендомітозу і різноманітними клітинними змінами. Клітини можуть переміщатися пасивно або активно: наприклад, переміщення клітин з нижнього у верхні шари епідермісу і пересування клітин крові. Зміни можуть носити або прогресивний (дозрівання клітин молока), або регресивний (зроговіння еппдермоцітов) характер.
До змін клітин можна віднести і їх відокремлення від оточуючих клітин, яке або призводить клітку до загибелі (злущування клітин ворсинок кишечнику), або не супроводжується негайною загибеллю (клітини крові).
Процес фізіологічної регенерації може бути безперервним або періодичним. При безперервній регенерації в одній групі органів відбувається зміна клітин або структур, що гинуть в результаті диференціювання. Гинучи, ці клітини виконують певну функцію. Так, ороговілі клітини епідермісу грають захисну і теплорегулірующую роль, клітини сальних залоз служать як жирового мастила і т. п.
В іншій групі органів відбувається зміна відриваються клітин, яка може розглядатися теж як диференціювання, оскільки клітини при цьому починають виконувати іншу функцію (зрілі клітини периферичної крові, статеві клітини). У третій групі органів виявляється зміна зношуються клітин або структур. Мається на увазі оновлення клітинного складу мсрокрінових залоз (підшлункова, слізні, слинні та ін) і паренхіматозних органів (печінка, нирки, легені та ін.)
Періодична або циклічна регенерація властива деяким органам і структурам, які існують лише певний період, після чого настає їх дегенерація (структури в репродуктивних органах і пов’язані з ними статеві ознаки, волосся та ін); циклічна регенерація стосується, як правило, оновлення цілих органних структур.[4]
4.Диференціація клітин
Це надзвичайно важливий процес, у якому клітини отримують певний тип або «фенотип». Завдяки йому спочатку утворюються популяції клітин, а згодом тканини, з яких формуються органи…
Клітини відрізняються один від одного не тільки характером диференціації, але і її ступенем. Одні клітини стають високодиференційованими (нервові клітини, клітини поперечносмугастих м’язів), інші – залишаються порівняно малодиференційовані (епітеліоцити базального шару багатошарового епітелію, деякі види сполучнотканинних клітин).
Малодиференційовані клітини енергійно розмножуються, тоді як висока диференціація, як правило, призводить до втрати клітиною здатності ділитися (клітини периферичної крові, верхніх шарів епідермісу, кісткові, нервові). Однак існують високодиференційовані клітини, здатні ділитися (клітини печінки, нирок, підшлункової залози). Основний спосіб розподілу тканинних клітин – це мітоз. У міру збільшення числа клітин виникають клітинні групи, або популяції, об’єднані спільністю локалізації у складі зародкових листків (ембріональних зачатків) і володіють подібними гістогенетичноми потенціями. Клітинний цикл регулюється численними поза-і внутрішньоклітинними механізмами. До позаклітинних відносяться вплив на клітину цитокінів, факторів росту, гормональних і нейрогенних стимулів.
Роль внутрішньоклітинних регуляторів грають специфічні білки цитоплазми. Протягом кожного клітинного циклу існують кілька критичних точок, відповідних переходу клітини з одного періоду циклу в інший. При порушенні внутрішньої системи контролю клітина під впливом власних факторів регуляції елімінується апоптозом, або на деякий час затримується в одному з періодів циклу.
Метод радіографічного аналізу клітинних циклів в різних тканинах виявив особливості співвідношення клітинної репродукції і диференціювання. Наприклад, якщо в тканинах (кровотворні тканини, епідерміс) є постійний фонд проліферуючих клітин, за рахунок яких забезпечується безперервне виникнення нових клітин замість тих, хто гине, то ці тканини відносяться до тих, що оновлюється. Інші тканини, наприклад, деякі сполучні, характеризуються тим, що в них збільшення кількості клітин відбувається паралельно з їхньою диференціюванням, клітини в цих тканинах характеризуються низькою мітотичної активністю. Це зростаючі тканини. Нарешті, нервова тканина характеризується тим, що всі основні процеси репродукції закінчуються в період ембріонального гістогенезу (коли формується основний запас стволових клітин, достатній для подальшого розвитку тканини). Тому вона віднесена до стабільних (стаціонарним) тканинам. Тривалість життя клітин в оновлюються, що ростуть і стабільних тканинах різна. [5]
Поряд з оновленням клітинної популяції, в самих клітинах постійно спостерігається оновлення внутрішньоклітинних структур (внутрішньоклітинна фізіологічна регенерація).
5.КЛІТИННА ПОПУЛЯЦІЯ
Детально розглянувши характер росту та розвитку клітини як окремої одиниці, перейдемо до групи однорідних за визначеним критерієм клітин – клітинних популяцій.
Так, за здатністю до оновлення виділяють три типи клітинних популяцій:
1. Стабільні клітинні популяції - нездатні до оновлення шляхом мітотичного поділу (напр., нейроцити ссавців).
2. Клітинні популяції, які ростуть - здатні не тільки оновлюватись, але рости і збільшувати масу тканини за рахунок збільшення числа клітин та їх поліплоїдизації (напр., клітини печінки-рис.2).
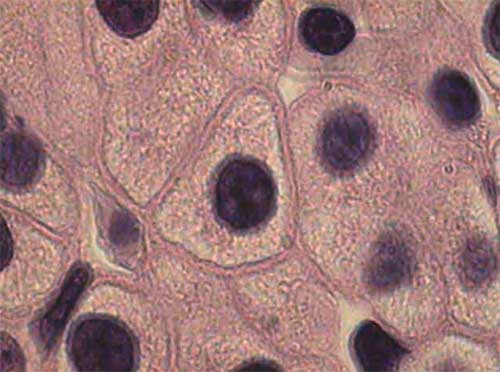
Рис.2 Клітини печінки здорової людини
3. Клітинні популяції, які оновлюються - характеризуються закономірним оновленням клітин: скільки загинуло, стільки з'явилося за рахунок поділів і спеціалізації слабодиференційованих клітин (напр., клітини кишкового епітелію, крові). [6]
6.Популяції пухлинних клітин
За роки вичення біології, хімії та інших природничих наук, я переконалася в тому, що немає нічого лишнього, все працює чітко і злагоджено у світі природи. Але за певних умов навіть найдосконаліша система дає збій.
На клітинному рівні організації живого таким «збоєм» є пухлинні клітини(рис.3).
Рис.3 Стовбурові пухлинні клітини
Яка причина утворення цих клітин? Чому нормально функціонуюча одиниця живого раптом змінює свої властивості?
У всіх тканинах (особливо в епітеліальній, із якої виникають раки, що складають до 90% злоякісних пухлин), відбувається постійне ділення, утворення нових клітин замість тих, що відмирають. У нескінченному колооберті обновлення неминуче виникають помилки, "клітинний брак" із видимих і невидимих для нас причин. Це відбувається у всіх живих істот, і людей у тому числі, безліч разів щодня. Звичайно, чим більше циклів ділення пройшла клітина, тим більша ймовірність появи "бракованих" клітин у її "потомстві". Це пояснює різкий ріст імовірності виникнення онкологічних захворювань із віком для більшості пухлин. Більше 50% всіх випадків рака виявляються в людей у віці 65 років і старше. Статистичні дані показують, що якщо прийняти смертність від рака в 20-річному віці за одиницю, то в 50-59 років ризик померти від цього захворювання збільшиться в 50 разів, а в 60 років і старіших - ймовірність цього зростає ще більше: для чоловіків - у 119, для жінок - у 78 разів.
Організм має спеціальні механізми для розпізнавання й знищення такого "браку", клітин, що є по суті чужорідними для організму. Він бореться з ними так само, як із клітинами, що потрапили ззовні (бактеріями або пересадженими органами) за допомогою імунної системи. Але в один "прекрасний" день імунна система дає збій, по якимсь недостатньо вивченим причинам пропускає "браковану" клітину, здатну до безперервного розмноження і неконтрольованого росту.
Найімовірніше саме порушення імунної системи є визначальними в розвитку пухлин, оскільки виникнення клітинного браку неминуче, і все залежить від того, наскільки безвідмовно й ефективно він розпізнається і вчасно знищується.
Концепція про роль імунних механізмів у розвитку злоякісних новоутворень була висунута у 1909 р. Ерліхом, а потім розширена багатьма дослідниками. Дослідження останніх років підтвердили істотне значення фактора імунодепресії у розвитку пухлин. Роль порушень імунної системи в розвитку злоякісних пухлин підтверджується більш частим розвитком пухлин при порушеннях імунологічного контролю в організмі (імунодефіцитні синдроми - агаммаглобулінемії, атаксія- телеангіоектазія й ін.; тривале застосування імунодепресивних засобів у випадку трансплантації органів і при деяких хворобах). Такі хворі також потребують більш частого лікарського контролю для своєчасного виявлення пухлин. [7] [8]
6.1.Канцерогенні фактори