ХАРАКТЕРИСТИКА МИКРОБНОГО СООБЩЕСТВА ПОЧВЫ
Министерство образования и науки РФ
Федеральное государственное автономное образовательное учреждение
Высшего профессионального образования
«КАЗАНСКИЙ (ПРИВОЛЖСКИЙ) ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ»
ИНСТИТУТ ФУНДАМЕНТАЛЬНОЙ МЕДИЦИНЫ И БИОЛОГИИ
КАФЕДРА МИКРОБИОЛОГИИ
Специальность: 012400 (ОКСО 020209) – микробиология
Отчёт
ХАРАКТЕРИСТИКА МИКРОБНОГО СООБЩЕСТВА ПОЧВЫ
Выполнили:
Студенты 3 курса
Группы 102
Липатникова А.А.
Данилова М.А.
Преподаватели:
Зеленихин П.В.
Мочалова Н.К.
Казань - 2013
ВВЕДЕНИЕ
Почвенные микроорганизмы- совокупность разных групп микроорганизмов, для которых естественной средой обитания служит почва. Почвенные микроорганизмы играют важную роль в круговороте веществ в природе, почвообразовании и формировании плодородия почв. П. м. могут развиваться не только непосредственно в почве, но и в разлагающихся растительных остатках. В почве встречаются также некоторые болезнетворные микробы, водные микроорганизмы и др., которые случайно попадают в почву (при разложении трупов, из желудочно-кишечного тракта животных и человека, с поливной водой или др. путями) и, как правило, быстро в ней погибают. [Виноградский С. Н., Микробиология почвы, М., 1952]
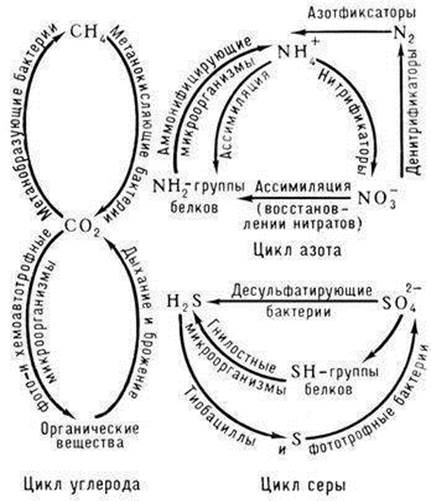
Цель работы: охарактеризовать микробное сообщество почвы.
Используемые материалы: пробирки с 9 мл водопроводной воды, колба с 45 мл водопроводной воды, чашки Петри, пипетки с отколотыми концами, среды – МПА, Гаузе, Чапека, Эшби, Гетчинсона (твердые), Гильтея и Виноградского I и II (жидкие).
Ход работы:
Подготовка сред:
1. МПА МПБ, агар – 20 г/л
2. Среда Чапека (г/л), pH 4,2-4,5 :
| Компонент: | Масса, г: |
| Сахароза | 30,0 |
| NaNO3 | 2,0 |
| KH2PO4 | 1,0 |
| MgSO4*7H2O | 0,5 |
| KCl | 0,5 |
| FeSO4 | 0,01 |
| CaCO3 | 3,0 |
| агар-агар | 20,0 |
| дист. вода | 1000,0 |
| молочная кислота | 2 мл/л |
3. Среда Гаузе, (г/л) pH=7,2-7,4
| Компонент: | Масса, г: |
| крахмал | 20,0 |
| K2HPO4 | 0,5 |
| MgSO4 | 0,5 |
| KNO3 | 1,0 |
| NaCl | 0,5 |
| FeSO4 | 00,1 |
| агар-агар | 20,0 |
| дист. вода | 1000,0 |
4. Среда Эшби (г/л)
| Компонент: | Масса, г: |
| Сахароза, или маннит | 20,0 |
| K2HPO4 | 0,2 |
| MgSO4*7H2O | 0,2 |
| KH2PO4 | 0,1 |
| NaCl | 0,2 |
| CaCO3 | 0,5 |
| агар-агар | 20,0 |
| дист. вода | 1000,0 |
5. Среда Гетчинсона (г/л), pH=7,2-7,3:
| Компонент: | Масса, г: |
| K2HPO4 | 1,0 |
| CaCl2*6H2O | 0,1 |
| MgSO4*7H2O | 0,3 |
| NaCl | 0,1 |
| FеCl3*6H2O | 0,01 |
| NaNO3 | 2,5 |
| агар-агар | 20,0 |
| дист. вода | 1000,0 |
6. Среда Гильтея (г/л). Готовят два раствора:
| Компонент: | Масса, г: |
| I) KNO3 | 2.1 |
| аспарагин | 1.0 |
| дист.вода | |
| II) Лимоннокислый натрий | 5.0 |
| KH2PO4 | 2.0 |
| MgSO4*7H2O | 2.0 |
| CaCl2 | 2.0 |
| FеCl3 | 0.01 |
| дист.вода |
· после растворения солей растворы сливают вместе;
· устанавливают pH 6,8 - 7,0;
· доводят объем до 1000 мл;
· добавляют индикатор (бромтимоловый) синий до появления зеленого цвета;
· среду разливают по 9 мл в пробирки, опускают поплавки для улавливания газов и стерилизуют при 0,5 атм 20 мин.
7. Среда Виноградского (г/л):
| Для первой фазы нитрификации: | Для второй фазы нитрификации: | ||
| Компонент: | Масса, г: | Компонент: | Масса, г: |
| (NH4)2SO4 | 2,0 | NaNO2 | 1,0 |
| K2HPO4 | 1,0 | Na2CO3 | 1,0 |
| MgSO4*7H2O | 0,5 | NaCl | 0,5 |
| NaCl | 2,0 | K2HPO4 | 0,5 |
| FeSO4 | 0,4 | MgSO4*7H2O | 0,3 |
| CaCO3 | 5,0 | FeSO4 | 0,4 |
1)Взвешиваем 5 г почвы (образец № 2), используя стерильный шпатель, и помещаем почву в ступку, предварительно простерилизованную методом фламбирования, наливаем из колбы немного воды, растираем почву пальцем, надев резиновый напальчник, очищаем от посторонних фрагментов и очищенную гомогенную почвенную массу перемещаем обратно в колбу с 45 мл воды (перед этим производим посев на среды Гетчинсона и Эшби, выкладывая кусочки почвы в шахматном порядке). В течение 3 минут круговыми движениями перемешиваем почву.
2)Далее производим ряд разведений – пипеткой переносим 1 мл почвенной вытяжки из колбы в пробирку с 9 мл воды, перемешиваем и переносим 1 мл жидкости в следующую пробирку. Таким образом доводим до разведения 10.
3)Далее производим посев на среды:
o Глубинный посев на МПА из разведения 10. Ставим в термостат на 28°С на 72 часа, после чего производим визуальный анализ колоний и микроскопируем препараты «раздавленная капля», «висячая капля» и «фиксированный мазок».
o Посев газоном на Гаузе и Чапека из разведения 10². Чашки Петри со средой Чапека инкубируют при 24-26°C 3-5 суток, со средой Гаузе – при 28°С 14 суток.
o В среды Гильтея, Виноградского I и Виноградского II вносим 1 мл суспензии из разведения 10, В среде Гильтея должны находиться стеклянные поплавки или кусочки ваты, после посева среду Гильтея заливаем 0,5-1 мл вазелина для создания анаэробных условий. Инкубируем при температуре 28-35°С, учет изменений производим через 7, 14, 21 дней.
o На теплую, но уже застывшую среду Гетчинсона выкладываем диски из фильтровальной бумаги, после чего на неё и на среду Эшби выкладываем по 25-30 комочков почвы в шахматном порядке, избегаю слишком близкого расположения. Инкубации производится во влажной камере при температуре 28-30° в течение 2-х недель.
РЕЗУЛЬТАТЫ:
1. Учет бактерий на мясо-пептонном агаре (МПА)
Описание колоний
| № | Размер, см | Форма | Край | Цвет | Структура | Микроорганизм |
| 0,7 | Круглая | Ровный | Кремовый, бежевый, белое пятно в середине | Неоднородная | Актиномицет | |
| 0,9 | Круглая | Ровный | Розовато- кремовый | Однородная | Бациллы, короткие палочки средней толщины, собраны в пары, с округлыми краями | |
| 0,4 | Круглая | Неровные, волнистые, округлые | Телесно – бежевый | Однородная, волокнистая | Бациллы, среднего размера, с закругленными краями | |
| 1,3 | Неровный круг | Неровные, обрывистые, волнистые | Жемчужно- розовый | Посередине однородная, по краям волокнистая, морщинистая | Палочки в цепочках, средние, бочковидные, со спорами | |
| 1,1 | Круглая | Ровные | Цвет слоновой кости | Однородная | Бациллы, толстые, крупные, с прозрачными вышедшими спорами | |
| Неровный круг | Мелко - зубчатые | Бледно - желтый | Однородная, слегка зерниста | Бациллы со спорами, расположенными ближе к полюсу. Есть тонкие, есть толстые, расположены попарно. |
| 1-0.5 | овальная | перистый | Белый | Волоскнистая | B. micoides | |
| 0.5 | округлая | неровный волнистый | Нежно-розовый | Складчатая | Очень мелкие палочки | |
| округлая | ровный | Бледно-голубой | Ровная, однородная | Микрококки, диплококки | ||
| округлая | ровный | Бледно-белый | Вогнутая | Средних размеров пачлочки, спор не обнаружено | ||
| 0.3 | округлая | ровный | Кремово-розовый | Выпуклая | Сарцины | |
| 0.5 | округлая | ровный | Ярко-желтый | Скалдчатая, не блестит | Небольшие палочки, спор не обнаружено, распологаются поодиночке | |
| округлая | неровный волнистый | Серовато-белый | Складчатая, блестит | Палочки со спорами |
Количество микроорганизмов на 1 г воздушно-сухой почвы:
а = б*в*10/г , где:
а - число клеток в микроорганизмов на 1 г воздушно-сухой почвы;
б - среднее число выросших колоний;
в - соответствующее разведение;
10 -коэффициент пересчета на 1 г почвы;
г - содержание абсолютно сухой почвы на 1 г исходной почвы.
Среднее количество колоний 105.
2. Учет микромицетов на среде Чапека
| № | Воздушный мицелий | Субстратный пигмент |
| Белый | Желтый, яркий | |
| желтый | желтый |
Расчет количества грибных зачатков в почве:
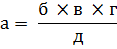
а- число грибных зачатков на 1г почвы;
б- среднее кол-во колоний на чашках;
в- разведение;
г- кол-во капельв 1 мл суспензии;
д- вес почвы, взятой на анализ.
Среднее количество колоний 37.
3. Учет актиномицетов на среде Гауза
| Колония № | Субстратный мицелий | Воздушный мицелий | Пигмент | Микроскопия |
| Шоколадно - коричневый | Бледно - розовый | - |   
| |
| Темно-коричневый | Белый, чистый | - |    
| |
| Темно - зеленый | Бежево - коричневый | - |    
| |
| Бежево – коричневый | Бежево - кремовый | - |      
|
Расчет количества грибных зачатков в почве:
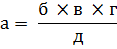
а- число грибных зачатков на 1г почвы, б- среднее кол-во колоний на чашках , в- разведение, г- кол-во капель в 1 мл суспензии, д- вес почвы, взятой на анализ.
Среднее количество колоний 14.
4. Выделение азотобактера методом посева почвенных комочков на агаризованную среду Эшби
Перед микроскопирование делаем окраску по Гимсу:
1.На обезжиренное предметное стекло помещается капля черной туши, в которую вносится культура;
2. Тушь растирается при помощи другого стекла, мазок высушивается и фиксируется в смеси Никифорова в течение 5-10 минут;
3. После производится окраска фуксином цилия (1:3) 2-3 минуты, затем краситель смывается водопроводной водой.
Микроскопируем с иммерсией.

На темном фоне малиновые клетки, расположенные попарно, вокруг них находится капсула.
Процент содержания азотобактера (Х):
а – общее кол-во комочков почвы;
в – число комочков с ростом азотобактера.
Х = 100%
5. Определение аэробных целлюлозоразрушающих бактерий в почве методом посева комочков
Тип разрушения целлюлозы: изменение цвета – становится желтой, бурой, коричневой, происходит рост грибов.

 Микроскопия:
Микроскопия:
1.
 |

 Мицелий без спор.
Мицелий без спор.
2. 


Мицелий, споры Fusarium или Aspergillus.
Процент содержания целлюлозоразрушающих бактерий: 100%.
6. Наблюдение денитрификации и получение накопительной культуры на среде Гильтея
Денитрификация






1. Диссимиляционная денитрификация;
2. Ассимиляционная денитрификация.
Цвет среды Гильтея из зеленого превратился в голубой, что говорит об изменении pH среды, так как в процессе ассимиляционной денитрификации образуется аммоний; в стеклянном колпачке скапливается газ – азот, что говорит о прохождении процесса диссимиляционной денитрификации.
Для определения продуктов жизнедеятельности денитрифицирующих бактерий из культуральной жидкости делают пробы:
1. На нитрат (NO3) с дифениламином;
2. На нитрит (NO2) с цинк-йод-крахмалом или реактивом Грисса;
3. На аммиак (NH3) с реактивом Несслера.
| Дефиниламин + H2SO4 | Реактив Грисса | Реактив Несслера | |
| 7 суток | мало | нет | есть |
| 14 суток | нет | нет | есть |
| 21 суток | нет | нет | есть |
Это говорит о том, что в среде процесс денитрификации идет очень быстро, и нитраты быстро восстанавливаются бактериями до аммония и азота.
При микроскопировании (фиксированный препарат) обнаружились мелкие палочки, Pseudomonas.
7. Выделение нитрифицирующих бактерий из среды Виноградского I и II
| Дефиниламин + H2SO4 | Реактив Грисса | Реактив Несслера | |||||||
| Среда Виноградского I | |||||||||
| 7 суток | нет | мало | немного | ||||||
| 14 суток | мало | есть | есть | ||||||
| 21 суток | есть | есть | есть | ||||||
| Среда Виноградского II | |||||||||
| 7 суток | есть | есть | нет | ||||||
| 14 суток | есть | есть | нет | ||||||
| 21 суток | есть | нет | нет | ||||||
Это говорит о том, что процесс нитрификации идет крайне медленно.
При микроскопировании (фиксированный препарат) обнаружились кокки, бациллы: Nitrobacter, Nitrospira, Nitrococcus, Bacillus.