Кристаллическое строение металлов
ВНУТРЕННЕЕ СТРОЕНИЕ МЕТАЛЛОВ И СПЛАВОВ
У веществ в твердом состоянии строение кристаллическое или аморфное. В кристаллическом веществе атомы расположены по геометрически правильной схеме и на определенном расстоянии друг от друга, в аморфном же (стекле, канифоли) атомы расположены беспорядочно.
У всех металлов и их сплавов строение кристаллическое. На рис.12 показана структура чистого железа. Кристаллические зерна неопределенной формы не похожи на типичные кристаллы - многогранники, поэтому их называют кристаллитами, зернами или гранулами. Однако строение кристаллитов столь же закономерно, как и у развитых кристаллов.
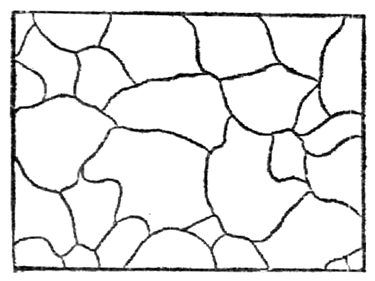
Рис.12. Микроструктура чистого железа (х - 150)
Виды кристаллических решеток. При затвердевании атомы металлов образуют геометрически правильные системы, называемые кристаллическими решетками. Порядок расположения атомов в решетке может быть различным. Многие важнейшие металлы образуют решетки, простейшие (элементарные) ячейки которых представляют форму центрированного куба (a- и b - железо, хром, молибден, вольфрам, ванадий, марганец), куба с центрированными гранями (g - железо, алюминий, медь, никель, свинец) или гексагональную, как у шестигранной призмы, ячейку (магний, цинк, a - титан, a - кобальт).
Элементарная ячейка повторяется непрерывно в трех измерениях, образуя кристаллическую решетку, поэтому положение атомов в элементарной ячейке определяет структуру всего кристалла.
Элементарная ячейка центрированного куба (рис.13) состоит из девяти атомов, из которых восемь расположены по вершинам куба, а девятый — в его центре.
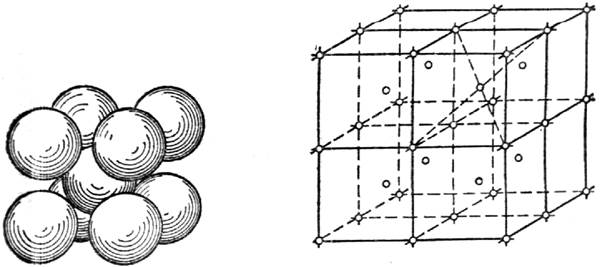
Рис.13.Элементарная ячейка Рис.14.Часть пространственной решет-
центрированного куба ки центрированного куба
Для характеристики кристаллической решетки (атомной структуры кристалла) применяют пространственную решетку, которая является геометрической схемой кристаллической решетки и состоит из точек (узлов), закономерно расположенных в пространств.
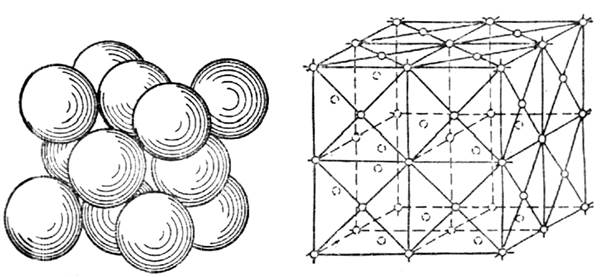
Рис.15.Элементарная ячейка куба Рис.16.Часть пространственной ре-
с центрированными гранями шетки куба с центрированными
гранями
На рис.14 приведена часть пространственной решетки центрированного куба. Здесь взяты восемь смежных элементарных ячеек; узлы, расположенные по вершинам и в центре каждой ячейки, отмечены кружками. Элементарная ячейка куба с центрированными гранями (рис.15) состоит из 14 атомов, из них 8 атомов расположены по вершинам - куба и 6 атомов — по граням.
На рис.16 приведена часть пространственной решетки куба с центрированными гранями ( гранецентрированного куба). На схеме имеется восемь элементарных ячеек; узлы расположены по вершинам и по центрам граней каждой ячейки. Гексагональная ячейка (рис.17) состоит из 17 атомов, из них 12 атомов расположены по вершинам шестигранной призмы, 2 атома — в центре оснований и 3 атома — внутри призмы. Для измерения расстояния между атомами кристаллических решеток пользуются специальной единицей, называемой ангстремом  см.
см.

Рис.17.Гексагональная ячейка
Параметр решеток (сторона или шестигранника) у меди 3,6 А, а у алюминия 4,05 А, у цинка 2,67 А и т. д.
Каждый атом состоит из положительно заряженного ядра и нескольких слоев (оболочек) отрицательно заряженных и движущихся вокруг ядра электронов. Электроны внешних оболочек атомов металлов, называемые валентными, легко отщепляются, быстро движутся между ядрами и называются свободными. Вследствие наличия свободных электронов атомы металлов являются положительно заряженными ионами.
Таким образом, в узлах решеток, обозначенных кружками рис.14 и 16, находятся положительно заряженные ионы. Ионы, однако, не находятся в покое, а непрерывно колеблются положения равновесия. С повышением температуры амплитуда колебаний увеличивается, что вызывает расширение кристаллов, а при температуре плавления колебания частиц усиливаются настолько, что кристаллическая решетка разрушается.
Во всех кристаллах наблюдаются небольшие отклонения от идеальной решетки — незанятые узлы и различного рода смещения атомов.
Анизотропность и спайность кристаллов. В отдельных кристаллах свойства различны в разных направлениях. Если взять большой кристалл (существуют лабораторные и даже производственные методы выращивания крупных кристаллов) вырезать из него несколько одинаковых по размеру, но различно ориентированных образцов, и испытать их свойства, то иногда наблюдается весьма значительная разница в свойствах между отдельными образцами. Например, при испытании образцов, вырезанных из кристалла меди, относительное удлинение изменялось в пределах от 10 - 50 %, а предел прочности—от 14 до 35 кГ/мм2 для различных образцов. Это свойство кристаллов называют анизотропностью. Анизотропность кристаллов объясняется особенностями расположения атомов в пространстве.
Следствием анизотропности кристаллов является спайность, которая выявляется при разрушении. В местах излома кристаллов можно наблюдать правильные плоскости, указывающие на смещение частиц под влиянием внешних сил не беспорядочное, а правильными рядами, в определенном направлении, соответственно расположению частиц в кристалле. Эти плоскости называются плоскостями спайности.
Аморфные тела изотропны, т. е. все их свойства одинаковы во всех направлениях. Излом аморфного тела всегда имеет неправильную искривленную, так называемую, раковистую поверхность.
Металлы, затвердевшие в обычных условиях, состоят не из одного кристалла, а из множества отдельных кристаллитов, различно ориентированных друг к другу, поэтому свойства литого металла приблизительно одинаковы во всех направлениях; это явление называют квазиизотропностью (кажущейся изотропностью).
Аллотропия металлов (или полиморфизм) — их свойство перестраивать решетку при определенных температурах в процессе нагревания или охлаждения. Аллотропию обнаруживают все элементы, меняющие валентность при изменении температуры: например, железо, марганец, никель, олово и др. Каждое аллотропическое превращение происходит при определенной температуре. Например, одно из превращений железа происходит при температуре 910°С, ниже которой атомы составляют решетку центрированного куба (см. рис.14 ), а выше — решетку гранецентрированного куба (см. рис.16).
Та или иная структура называется аллотропической формой или модификацией. Различные модификации обозначают греческими буквами a, b, g и т. д., причем буквой a обозначают модификацию, существующую при температурах ниже первого аллотропического превращения. Аллотропические превращения сопровождаются отдачей (уменьшением) или поглощением (увеличением) энергии.
Кристаллизация металлов. Кристаллизацией называется образование кристаллов в металлах (и сплавах) при переходе из жидкого состояния в твердое (первичная кристаллизация). Перекристаллизацию из одной модификации в другую при остывании эатвердевшего металла называют (вторичной кристаллизацией). Процесс кристаллизации металла легче всего проследить с помощью счетчика времени и термоэлектрического пирометра, который представляет собой милливольтметр, подключенный к термопаре. Термопару (две разнородные проволоки спаянные концами) погружают в расплавленный металл. Возникающий при этом термоток пропорционален температуре металла и стрелка милливольтметра отклоняется, указывая эту температуру по градуированной шкале.
Показания пирометра автоматически записываются во времени и по полученным данным строят кривые охлаждения в координатах «температура — время» (такие кривые вычерчивает самописец).
Температура, соответствующая какому-либо превращению в металле, называется критической точкой.
На рис.18, а приведена кривая нагрева металла. Здесь точкаа - начало плавления, точка b— окончание плавления.

Рис.18.Кривые нагревания (а) и охлаждения (б - без петли,
в- с петлей) металла
Участокаb указывает на неизменность температуры во времени при продолжающемся нагревании. Это показывает, что тепловая энергия затрачивается на внутреннее превращение в металле, в данном случае. на превращение твердого металла в жидкий (скрытая теплота плавления).
Переход из жидкого состояния в твердое при охлаждении сопровождается образованием кристаллической решетки, т. е. кристаллизацией. Чтобы вызвать кристаллизацию, жидкий металл нужно переохладить несколько ниже температуры плавления. Поэтому площадка на кривой охлаждения (рис.19,6) находится несколько ниже tплпри температуре переохлаждения tпр.
У некоторых металлов переохлаждение (tпл — tпр) может оказаться весьма значительным (например, у сурьмы до 40°С) и при температуре переохлаждения tпр (рис. 18, в) сразу бурно начинается кристаллизация, в результате чего температура скачком повышается почти до tпл. В этом случае на графике вычерчивается петля теплового гистерезиса.
При затвердевании и при аллотропическом превращении в металле вначале возникают зародыши кристалла (центры кристаллизации), вокруг которых группируются атомы, образуя соответствующую кристаллическую решетку.
Таким образом, процесс кристаллизации складывается из двух этапов: образования центров кристаллизации и роста кристаллов.
У каждого из возникающих кристаллов кристаллографические плоскости ориентированы случайно, кроме того, при первичной кристаллизации кристаллы могут поворачиваться, так как они окружены жидкостью. Смежные кристаллы растут навстречу друг другу и точки их соприкосновения определяют границы кристаллитов (зерен).
Кристаллизация железа. Рассмотрим в качестве примера кристаллизацию и критические точки железа.

Рис.19. Кривые охлаждения и нагревания железа
На рис.19 приведены кривые охлаждения и нагревания чистого железа, которое плавится при температуре 1539 0С. Наличие критических точек при меньших температурах указывает на аллотропические превращения в твердом железе.
Критические точки обозначаются буквой А, при нагревании обозначают Аc и при охлаждении Ar индексы 2, 3, 4 служат для отличия аллотропических превращений (индекс 1 обозначает превращение на диаграмме состояния Fe - Fe3C.
При температурах ниже 768 0С железо магнитно и имеет кристаллическую решетку центрированного куба. Эту модификацию называют a-железо; при нагревании она в точке Ас2 переходит в немагнитную модификацию b-железо. Кристаллическая структура при этом не меняется.
В точке Ас3 при температуре 910 0С b-железопереходит в g-железос кристаллической решеткой гранецентрированного куба.
В точке Ас4 при температуре 1401 0С g-железопереходит в d-железо, причем кристаллическая решетка вновь перестраивается из гранецентрированного куба в центрированный куб.
При охлаждении происходят те же переходы, только в обратной последовательности.
Из перечисленных превращений наибольшее практическое значение имеют превращения А3 как при нагреве (Ас3), так и при охлаждении (Аr3).
Превращение в точке А3 сопровождается изменением объема, так как плотность кристаллической решетки g-железабольше плотности решетки a-железа, в точке Ас3объем уменьшается, в точке Ar3 - увеличивается.