Гесс заыны салдарын мысалдар келтіре отырып длелдеіз.
Химиялы термодинамиканы 1 заына сйеніп Гесс зіні заын былай тжырымдады: реакцияны жылу эффектісі тек ана алашы заттар мен реакция німдеріні табиатына жне бастапы заттар мен реакция німдіріні соы жне алашы кйлеріне туелді, реакция жретін жолдарына туелді емес. Мысалы, 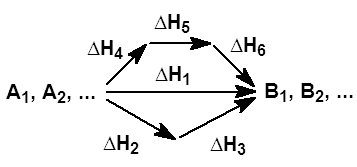 Суретте Гесс заыны маынасы сызбанса трінде крсетілген.Мысалы, алашы А жне Б заттар реакция нтижесінде С мен Д заттарды береді делік. Егер
Суретте Гесс заыны маынасы сызбанса трінде крсетілген.Мысалы, алашы А жне Б заттар реакция нтижесінде С мен Д заттарды береді делік. Егер  рбір затты тзілу жылулары болса, Гесс заы бойынша
рбір затты тзілу жылулары болса, Гесс заы бойынша  Бдан шыатын орытынды: тжірибе жасамай а реакцияны жылу эффектісін есептеуге болады. Гесс заы бойынша:
Бдан шыатын орытынды: тжірибе жасамай а реакцияны жылу эффектісін есептеуге болады. Гесс заы бойынша:  яни реакцияны жылу эффектісі аралы сатыларды жылу эффектілеріні осындысына те. Гесс заынан мынадай маызды орытынды шыады; реакцияны жылу эффектісі реакция німдеріні тзілу жылулары мен алашы заттарды тззілу жылуларыны алгебралы айырмасына те.
яни реакцияны жылу эффектісі аралы сатыларды жылу эффектілеріні осындысына те. Гесс заынан мынадай маызды орытынды шыады; реакцияны жылу эффектісі реакция німдеріні тзілу жылулары мен алашы заттарды тззілу жылуларыны алгебралы айырмасына те.
27. Газ кйіндегі жне шыш заттарды молекулалы массасын табу дістері.Газ кйіндегі заттарды молекулалы массасын табуды дістерімен тансысалы. Авагадро заына сйене отырып, газды баса газбен салыстырандаы тыыздыынан молекулалы массасын есептеп шыаруа болады. Бірдей жадайда, газдарды бірдей клеміндеріндегі молекулалар саны те болатынын білеміз. Олай болса, клемдерін бірдей етіп алан екі газды массаларыны атынасы, оларды молярлы массаларыны атынасындай болады:  =
=  мнда m-бір газды, m1-екінші газды массалары, М мен М1- соларды молярлы массалары. Клемдерін бірдей етіп алан екі газды бірдей жадайда лшегендегі массаларыны атынасы сол газды біреуіні екіншісімен салыстыран тыыздыы деп аталады. Салыстырмалы тыыздыты Д рпімен белгілесек , жааы жазыан тедеу мынадай трге кшеді: D=
мнда m-бір газды, m1-екінші газды массалары, М мен М1- соларды молярлы массалары. Клемдерін бірдей етіп алан екі газды бірдей жадайда лшегендегі массаларыны атынасы сол газды біреуіні екіншісімен салыстыран тыыздыы деп аталады. Салыстырмалы тыыздыты Д рпімен белгілесек , жааы жазыан тедеу мынадай трге кшеді: D=  M=D*M1 Яни, газды молярлы массасы баса газбен салыстырандаы тыыздыы мен сол баса газды молярлы массасыны кбейтіндісіне те. Іс жзінде газдарды тыыздыын не сутекпен, немесе ауамен салыстырып табады. Сонда молярлы массаны есептеп шаруды формулалары мынадай болады: М=2*D г/моль (сутек арылы) М=29*D г/моль (ауа арылы) 1-мысал. Аммиакты сутек арылы табылан тыыздыыы 8,5.Молярлы массаны табыыз: Шешуі: М=2*8,5=17 г/моль Біра бір газды молекулалы массасын табу шін белгілі бір клемін алып лшегенде алыпты жадайдан баса жадайда лшейміз, ондайда газды клемі, рине, алыпты жадайындаыдан басаша, оны ылпты жадайындаы клемін табу шін Бойль-Мариот пен Гей-Люссакты задарын біріктірген Клапейрон тедеуін пайдаланады PV=
M=D*M1 Яни, газды молярлы массасы баса газбен салыстырандаы тыыздыы мен сол баса газды молярлы массасыны кбейтіндісіне те. Іс жзінде газдарды тыыздыын не сутекпен, немесе ауамен салыстырып табады. Сонда молярлы массаны есептеп шаруды формулалары мынадай болады: М=2*D г/моль (сутек арылы) М=29*D г/моль (ауа арылы) 1-мысал. Аммиакты сутек арылы табылан тыыздыыы 8,5.Молярлы массаны табыыз: Шешуі: М=2*8,5=17 г/моль Біра бір газды молекулалы массасын табу шін белгілі бір клемін алып лшегенде алыпты жадайдан баса жадайда лшейміз, ондайда газды клемі, рине, алыпты жадайындаыдан басаша, оны ылпты жадайындаы клемін табу шін Бойль-Мариот пен Гей-Люссакты задарын біріктірген Клапейрон тедеуін пайдаланады PV=  Бл тедеуді пайдаланып, олярлы массасын тікелей есептеп шыаруа болады. М=
Бл тедеуді пайдаланып, олярлы массасын тікелей есептеп шыаруа болады. М= 
28. Резерфорд сынан атомны ядролы моделін, оларды жетістіткері мен кемшіліктерін длелдеіз.Тжірибеде алынан нтижелерді зерделей отырып Резерфорд з моделін сынды. Ол атомны о заряды оны ортасында орналасан радиусы шамамен 1015 м те аз клемге жинаталан деген орытындыа келді. Бл орталы блшекті Резерфорд ядро деп атады. Атомны массасы тгел дерлік ядрода шоырланан. Ядроныайнала р трлі орбиталармен электрондар озалып жреді. Е шеткі электрон орбитасыны радиусы атомны радиусына те, Ra1010 м. Бл лгі Кн жйесінірылымына сайтын боландытан, оны атомны планетарлы моделі деп те атайды. Модель бойынша атом клеміні басым кпшілік блігі "бос" болып шыады, ядроны радиусы атомны радиусынан 100 000 есе кіші. Орбиталардаы электрондарды теріс зарядтарыны осындысы ядроны о зарядына те, атом электрлік бейтарап. Атомны ішіндегі бос кеістік "те лкен". Сондытан, фольга арылы ткенде альфа-блшектеріні кбі ядродан алыс теді де, шашырамайды. Электрондар альфа-блшектен 8 мы еседей жеіл боландытан, оны озалыс траекториясын згерте алмайды. Тек ядроа тікелей арсы келіп алан альфа-блшектер ана онымен серлесіп, кері шады. Мндай блшектер саны ядро радиусыны атом радиусына атынасымен аныталады. Жоарыда біз тжірибеге тек сапалы талдау жргіздік. Резерфорд сонымен атар з моделіні жне Томсон моделіні негізшде есептеу жмыстарын жргізді, оларды нтижесі Резерфорд лгісіні дрыстыын крсетті. Біра классикалы физика трысынан мндай атомны орныты болуы ммкін емес. Бдан брын айтыландай, зарядталан блшек демелі озалса, міндетті трде сулеленуі (электромагниттік толындар шыаруы) керек. Бл сулеленуді жиілігі электронны ядро маында айналу жиілігіне те болуы тиіс. Электрон ядроны айнала дгелек орбитамен озалса, оны центрге тартыш деуі бар. Олай болса, электрон суле шыара отырып, з энергиясын азайтуы тиіс. Энергияны (орбиталы жылдамдыты) азаюы электронны ядроа кулон кшіні серінен біртіндеп жаындап, аыры оан лап тсуіне кеп соады. Бан бар боланы 108 с-ка те уаыт кетеді екен жне классикалы теория бойынша мндай атомны сулелену спектрі ттас болу керек, ал шын мнінде атомды спектрді сызыты болатынын алдыы таырыпта айтып кеттік. Сайып келгенде, бл жерде классикалы физиканы задары жрмейтін болып шыты. Тіпті жоарыда гіме болан атомны планетарлы моделі, дл айтанда ол бар боланы наыз атомны механикалы лгісі екеніне біртіндеп кзіміз жетеді.
29)Гайтлер-Лондон ебегіне сай валенттік байланыс (ВБ) тзілуін талдаыз.Ковалентті байланысты табиатын арастыруда азіргі уаытта екі діс олданылады-валенттік байланыс дісі жне молекулалы орбитальдар дісі. Екі блшекті электрон блттары бркеісп, жйені толы энергиясы азайанда болатын екі атомны рекеттесуін химиялы байланыс дейміз. 1927 жылы Гейтлер жне Лондон сутегі молекуласы шін Шредингер тедеуін жуы шамамен шешті. Олар Шредингер тедеуі бойынша байланысты екі трлі сипатын – энергия мен ядро – аралы зындыты есептеді. Бл есептеулер іс жзіндегі нтижелермен бірдей болып шыты. Олар сутек атомыны электроныны 1s тріндегі толынды функциясын алды. Егер екі атом бір-біріне сер етпейтін ашытыта болса, екі атомны толынды функцияларыны кбейтіндісі арылы жазылады.
ВБ-дісі молекулада атомдар жбы бір немесе бірнеше орта электронды жптар арылы сталып трады деген ыма негізделген. Нерлым атомдарды электронды блттары кбірек айасатын болса, атом арасындаы химиялы байланыс сорлым мыты болады. детте екі атомды осатын сызы бойындаы электрон блттарыны айасуы біршама жасы болады. Сонымен, спиндері арама-арсы электрон блттары бір-бірімен айасып химиялы байланыс тзіледі де, спиндері параллель электрон блттары арасындаы тыызды кеміп химиялы байланыс тзілмейді. Егер атомдар арасында бір орта жп болса, коваленттк байланыс бірлік, екі жп болса – екілі жне ш жп болса – штік байланыс болады. Электрон блттарыны айасуы бойынша , , – байланыстар тзіледі. Электрон блттары атомдарыны центрлерін байланыстыратын тзу бойынша айналса, -байланыстар тзіледі. Егер р- немесе d-блттары атомдарды байланыстыратын тзуді екі жаында айналса, онда -байланыстар тзіледі, немі дара байланыс. Еселі байланыстарды біреуі -байланыс, ал басалары -байланыстар.1928 жылы неміс алымдары В.Гейтлер жне Ф.Лондон валенттік байланыстар (ВБ) дісін сынып, онымен сутек молекуласына квантты механикапы есептеулерін жргізді. Кейінірек бл діс Слейтер, Ван Флек, Л.Полинг ебектерінде жетіле тсті. Валенттік байланыстар дісі келесі ережелерге негізделген:
1. Байланыстарды тзуге тек сырты электрон кабатындаы электрондар (валеннтік электрондар) катысады;
2. Химиялык байланыстара тсуші атомдар зара электрондарымен алмасады да, бл электрондар байланыстырушы жптарды тзеді;
3. Химиялы байланыс Паули аидасына сйкес, тек антипараллельді спиндегі электрондар арасында ана тзіледі, мндайда атом ядроларыны арасында электронды тыызды жоарылаан айма пайда болады.
4. Химиялык байланысты сипаттамалары (энергиясы, зындыы, йектігі жне т.б.) атомдык орбитальдарды айта жабылу типімен аныталады;
5. Молекулалар тзілген кезде электронды рылым (сырткы кабаттан басасы) жне рбір атомны химиялы зінділігі саталынады.
Валенттік байланыс теориясына сйкес коваленттік байланыстар рекеттесуші атомдарды АО максималды кайта жабу жаына баытталан.
Химиялы байланыстарды тзумен атар атомны осып алу жне баска атомдарды белгілі саныны орнын басу абілеттілігін валенттілік деп атайды. Валенттік байланыстар дісіні алмасымды механизміне орай ортак электронды жп (коваленттік байланыс) тзуге рбір атом жптаспаан бір электроннан береді. Валенттік байланыстар дісінде алмасымдык механизміндегі валенттілікті сандык лшемі ретінде атомны негізгі немесе оздырылан кйде болатын ттаспаан электрондар санын есептейді. Бл сырткы электронды абатты жптаспаан электрондары з- жне р-элементте, сі-элементтерді сырты жне оны ішкері жаындаы абатта, сол сиякты элементтерді сырты ш кабаттарында болады (орналасады).
Атомны оздырылан кйге ауысуы элемент валенттілігіні артуына жне ауыспалы валенттілікті бар болуына ммкіндік жасайды. Мысалы оттек пен фтор атомдарындаы электронды жптар бліне (ажыраса) апмайды, йткені екінші абатта бос орбитальдар жо. Олардан згеліктері, ккірт пен хлор ЗД-абатшаны бос орбиталіне ажыраса алады, тиісінше кікірт 1 жне 2 валенттіліктен (негізгі кйінде) баса таы да 4 жне 6 валенттілікте (оздырылан кйінде) болады, ал хлор 1 валенттіліктен (негізгі кйінде) баса 3,5 жне 7 валенттілікте (коздырылан кйінде) болады.
1.ВБ дісі кптеген молекулаларды геометриялы рылысын тсіндіруге ммкіндік береді.
2.Гибридті орбиталдарды кеістікте орналасуы зара электрон блттарыны приципіне баынады.
3.Гибридтеліну коволентті баланысты ерекше асиеті байланысты баытталынуын сипаттайды.Ковалентті байланысты ионды байланыстан басты айырмашылыы ионды байланыса баытталу асиеті тн еме
30)Коваленттік байланыс тзілуіні донорлы-акцепторлы механизмін талдаыз NH4+ мысалында.
Химиялы байланысты табиаты-химияны е негізгі мселелеріні бірі.Коваленттік байланысты екі трге бледі: полярлы жне полярлы емес. Молекулаларды атомдардан электрондар жбы арылы тзілуін ковалентті байланыс деп атайды. Бл байланыс екі трлі механизм бойынша тзіледі:алмасу механизмі - р элемент байланыса зіні эектронын береді, мысалы,сутегі молекуласы тзілгенде Н× + ×Н ® Н : Н; Коваленттік байланыс сонымен атар донорлы-акцепторлы механизммен тзілуі ммкін. Донорлы-акцепторлы байланыс – бл жадайда химиялы байланыс бір атомны ос электронды блты (донор) мен баса атомны бос орбиталь (акцептор) арылы тзіледі.Бл жадайда химиялы байланыс бір атомны екі электрон блттары мен баса атомны бос орбиталі нтижесінде тзіледі (NH4+).ВБ дісі бойынша коваленттік байланыс осылатын атомдарды жалы электроны орбитальдарыны бркесуі нтижесінде жасалады.Жалы электронды орбитальдар бркескенде осылушы екі атомны екеуіне де орта электрон жбы тзіледі.Орта жп осылатын атомдарды біреуіні ос электронды орбиталі екіншісіні бос орбиталімен бркескенде де тзіледі.Бны мысалы ретінде аммоний ионыны тзілуін келтіруге болады:
 +
+  = NH4+
= NH4+
Аммоний ионы аммиак молекуласы сутек ионын осып аланда тзілетіндіктен аммиак молекуласы мен сутек ионыны электронды рылысын еске тсіреміз.
2S 
Азот атомыны жалы электронды  орбитальдары ш сутек атомыны 1S-орбитальдарымен бркескенде тзіледі.Аммиак молекуласындаы азот атомыны байланыс тзуге атыспаан ос электронды 2S–орбиталі бар, яни пайдаланылмаан электрон жбы бар. Сутек атомыны 1 S-орбиталі бос.Сутек катионыны бос рбиталі аммиак молекуласындаы азот атомыны ос электронды орбиталімен жптасып,оларды арасындаы коваленттік байланыс тзіледі.
орбитальдары ш сутек атомыны 1S-орбитальдарымен бркескенде тзіледі.Аммиак молекуласындаы азот атомыны байланыс тзуге атыспаан ос электронды 2S–орбиталі бар, яни пайдаланылмаан электрон жбы бар. Сутек атомыны 1 S-орбиталі бос.Сутек катионыны бос рбиталі аммиак молекуласындаы азот атомыны ос электронды орбиталімен жптасып,оларды арасындаы коваленттік байланыс тзіледі.
| H |
| H |
| HhHH |
| N |

Сутекионыны алдындаы яшы сутек ионыны бос орбиталі бар дегенді білдіреді.Аммоний ионында тртковаленттік байланыс бар:оны шеуі жалы электронды орбитальды ,ал тртіншісі ос электронды орбиталь мен бос орбитальді бркесуі арылы жасалан.Бір атомны ос электронды жбы екінші атомны бос орбиталімен бркескенде(жптасанда )тзілетін коваленттік байланыс доноры-акцепторлы не болмаса координациялы байланыс деп те аталады.Донор –бл ос екі электронды блты бар атом, ал акцептор –бл электрон жбын абылдауа абілетті бос орбиталы бар блшек.Бізді жадайымызда донор-аммиак молекуласындаы азот,акцептор-сутек катионы. Донорлы-акцепторлы механизм -бір атомны электрон жбы (донор) орта болады, ал екінші атомнан бос орбитал ( акцептор) болады: Н+ + :NH3 ® NH+4 . Бл жадайда химиялы байланыс бір атомны екі электрон блттары мен баса атомны бос орбиталі нтижесінде тзіледі.