Общая характеристика методов испарения, классификация.
Общая характеристика методов испарения, классификация.
Основные количественные характеристики.
Отгонка.
Ректификация.
Молекулярная дистилляция.
Сублимация.
Фракционная перегонка.
Общая характеристика методов испарения, классификация.
ЛЕКЦИЯ 2
Испарение — процесс перехода вещества из жидкого состояния в парообразное или газообразное, происходящий на поверхности жидкого или твердого вещества (тела). При этомкинетическая энергия испаряющихся молекул превышает потенциальную энергию взаимодействия молекул.
С точки зрения молекулярно-кинетической теории эти процессы объясняются следующим образом. Молекулы жидкости, участвуя в тепловом движении, непрерывно сталкиваются между собой. Это приводит к тому, что некоторые из них приобретают кинетическую энергию, достаточную для преодоления молекулярного притяжения. Такие молекулы, находясь у поверхности жидкости, вылетают из неё, образуя над жидкостью пар (газ). Молекулы пара, двигаясь хаотически, ударяются о поверхность жидкости. При этом часть из них может перейти в жидкость. Эти два процесса вылета молекул жидкости и их обратное возвращение в жидкость происходят одновременно. Если число вылетающих молекул больше числа возвращающихся, то происходит уменьшение массы жидкости, т.е. жидкость испаряется, если же наоборот, то количество жидкости увеличивается, т.е. наблюдается конденсация пара. Возможен случай, когда массы жидкости и пара, находящегося над ней, не меняются. Это происходит, когда число молекул, покидающих жидкость, равно числу молекул, возвращающихся в неё. Такое состояние называется динамическим равновесием.
При испарении жидкость покидают наиболее быстрые молекулы, вследствие чего средняя кинетическая энергия поступательного движения оставшихся молекул уменьшается, а следовательно, и температура жидкости понижается. Поэтому, чтобы температура испаряющейся жидкости оставалась постоянной, к ней надо непрерывно подводить определённое количество теплоты.
Конденсация – (процесс, обратный испарению) – вещество переходит из парообразного состояния в жидкое.
Процесс испарения зависит от:
- интенсивности теплового движения молекул: чем быстрее движутся молекулы, тем быстрее происходит испарение;
- скорости внешней (по отношению к веществу) диффузии, а также свойства самого вещества: к примеру, спирт испаряется гораздо быстрее воды;
- площади поверхности жидкости, с которой происходит испарение: из узкого стакана оно будет происходить медленнее, чем из широкой тарелки;
- внешних условий (температура, давление, движение воздуха и др.).
В основе всех методов испарения лежит различие в давлении паров разделяемых компонентов или основного соединения и примеси или, другими словами, различие в коэффициентах распределения макро- и микрокомпонентов в системах жидкость-пар или твердое тело-пар (газ). Система жидкость-пар реализуется при простой отгонке, ректификации и молекулярной дистилляции. Эти методы часто объединяют под общим названием методы испарения:
• Дистилляция
• Сублимация (возгонка)
• Отгонка - простое выпаривание
- отгонка с химическим превращением
• Ректификация
• Фракционная перегонка
• Перегонка при пониженном давлении
• Лиофильная сушка
Главные достоинства методов - простота, доступность, экспрессность, малая поправка на холостой опыт, большая степеньабсолютного концентрирования.
2. Количественные характеристики методов.
СЛАЙД 3
Пусть нагревают смесь веществ А и В, обладающих разной температурой кипения. Газовая (паровая) фаза обогащается более летучим компонентом А. Молярные доли компонентов в обеих фазах связаны соотношением 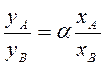
где yА , yВ – молярные доли в газовой фазе, – коэффициент (относительная летучесть).
СЛАЙД 4
Для успешного разделения методом испарения необходимо, чтобы >>1. Учитывая, что хВ = 1 - хА и уВ = 1 - уА, то
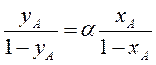
Следовательно, при увеличении относительной летучести паровая фаза обогащается более летучим компонентом. Величина, обратная , называется коэффициентом распределения:

Если дистилляцию используют для удаления макрокомпонета, то микрокомпонент концентрируют в жидкой фазе. Тогда можно допустить, что коэффициент распределения микрокомпонента не зависит от состава смеси и при заданной температуре – величина постоянная и равна
D = х / у.
Это допущение обоснованно, т.к. содержание микрокомпонента намного меньше содержания макрокомпонента, и следовательно х 1 и у 1.
Коэффициент распределения зависит от природы и состава разделяемой смеси, а также температуры. При заданной температуре D - величина постоянная. Чем больше D отличается от 1, тем больше эффективность разделения: если D>1, то микрокомпонент концентрируется в жидкой фазе, при D< 1 — в паре.
Скорость испарения вещества определяется количеством вещества, испаряемого с единицы площади в 1 сек, и выражается формулой:
СЛАЙД 5

где Vисп - скорость испарения, г/ (см2·сек); рs - давление насыщенного пара (10-2 мм рт. ст.); М - молекулярный вес испаряемого вещества, г/моль; Т - температура испарения вещества, К.
СЛАЙД 6
Удельная теплота парообразования – это физическая величина, которая показывает количество теплоты, нужное, чтобы превратить жидкость массой 1 кг в пар при температуре кипения. Обозначается удельная теплота парообразования буквой L. А единицей измерения является джоуль на килограмм (1 Дж/кг):
L=Q/m,
где Q – это количество теплоты, m – масса тела.
В реальных условиях часто требуется определить количество теплоты, необходимое для превращения в пар определенной массы какой-либо жидкости, поэтому чаще приходится иметь дело с формулой вида: Q=Lm,
а значения удельной теплоты парообразования для конкретного вещества берут из готовых таблиц.
2. Отгонка
Метод отгонки основан на образовании «летучих» соединений, под которыми понимают вещества, существующие в газообразном состоянии при температуре и давлении проведения отгонки, а в более общем случае - вещества, имеющие высокое давление паров над раствором или самим веществом в жидком или твердом состоянии. Чем выше давление паров, т. е. чем ближе температура отгонки к температуре фазового перехода в газообразное состояние, тем эффективнее процесс разделения. Наиболее распространен вариант отгонки из раствора, хотя найдены решения для случая отгонки из твердой фазы при взаимодействии с газообразным реагентом.
Простая отгонка (или выпаривание) - одноступенчатый процесс разделения и концентрирования микрокомпонентов, когда коэффициент распределения сравнительно велик. Наиболее часто используют отгонку матрицы, особенно в тех случаях, когда она обладает более высокой летучестью, чем летучесть определяемых микрокомпонентов (удаление упариванием воды, летучих кислот или органических растворителей из сравнительно разбавленных растворов).
Отгонка микрокомпонентов из раствора практически не проводится, потому что они редко находятся в форме готовых летучих соединений. Обычно такие соединения нужно сначала тем или иным способом получить, т. е. провести химические превращения (отгонка с предварительным химическим превращением) как основы, так и примесей в легколетучие соединения в результате химических реакций. Один из таких методов - сжигание органических и биологических проб (сухая и мокрая минерализация).
Сухую минерализацию проводят путем сжигания вещества в трубчатых печах в атмосфере воздуха или кислорода. Образующиеся летучие соединения CO, CO2, N2, SO2, SO3, H2O и другие улавливают с помощью адсорбционных систем и определяют.
Мокрую минерализацию проводят в растворах анализируемых веществ, получая легколетучие соединения добавлением концентрированных кислот, их смесей или сильных окислителей (H2O2, KClO3, KMnO4 и др.).
Способ обогащения упариванием наиболее целесообразен при групповом отделении, так как позволяет использовать концентрат для спектрального анализа почти на весь комплекс определяемых микрокомпонентов. В процессе упаривания до небольшого объема (либо досуха) в раствор в ряде случаев вводят подходящие реагенты (коллекторы) для уменьшения потерь микрокомпонентов вследствие их летучести или сорбции стенками посуды. В качестве коллекторов используют серную кислоту, соли металлов, угольный порошок спектральной чистоты. Введение коллекторов облегчает последующее полное растворение остатка за счет образования растворимых солей определяемых следов элементов, либо они используются в качестве носителя.
Концентрат примесей можно получить и путем отгонки основы в вакууме. Так, при определении примесей в таллии высокой чистоты его после растворения в азотной кислоте отгоняют в виде нитрата таллия, а остаток примесей после добавления угольного порошка и высушивания подвергают спектральному анализу. Такая отгонка обеспечивает концентрирование с высоким коэффициентом извлечения для элементов Bi, Cd, Fe, Ni, Co, Mg
и Pb.
Недостатки метода отгонки из раствора связаны с недостаточной селективностью и универсальностью, невозможностью использования его для разделения сложных смесей веществ на индивидуальные компоненты. Метод не пригоден для избирательных методов анализа, так как определяемый микрокомпонент в концентрате не отделяется от возможных мешающих его определению примесей. При испарении растворителя или матричных элементов (нагревание раствора пробы в чашке, стакане или тигле) возможна потеря микрокомпонентов вследствие их механического захвата жидкими или твердыми частицами матрицы, сорбции стенками посуды или образования нерастворимого в кислотах остатка, содержащего микрокомпоненты. Кроме того, при высоких температурах могут наблюдаться значительные загрязнения проб из материалов посуды. Поэтому упаривание всегда следует проводить в одной и той же посуде, а не пользоваться большим набором посуды. Наиболее подходит для проведения упаривания посуда из фторопласта, так как этот материал очень устойчив
к действию различных реагентов, даже «царской водки» при нагревании до 300-400 °С. Благодаря этому стенки и дно посуды не являются источниками загрязнения упариваемого раствора.
3. Ректификация.
Ректификация - многоступенчатый процесс разделения и концентрирования - осуществляется многократным испарением и конденсацией в насадочных, тарельчатых или пленочных колонках при противотоке пара и жидкости с частичным возвратом дистиллята (флегмой) при установившихся массо- и теплообмене. При ректификации жидкую исходную смесь помещают в нагреваемую нижнюю часть колонки. Образующийся пар поднимается вверх и конденсируется в охлаждаемом дефлегматоре. Часть конденсата (флегма) возвращается на орошение в верхнюю часть колонки, а оставшаяся жидкость отбирается. Таким образом, флегма, возвращаясь в перегонную колбу, обогащается менее летучим компонентом, а газовая фаза, поступающая вверх, — более летучим.
Температура кипения, которая во время перегонки одного компонента держится постоянной, скачкообразно повышается при появлении
в дистилляте другого компонента с более высокой температурой. Многократное повторение актов испарения - конденсации при достаточной высоте колонки приводит к получению почти чистого легколетучего компонента. Для более полного разделения поверхность соприкосновения флегмы с паром увеличивают, заполняя колонку стеклянными бусами или «завитками».
Методом ректификации разделяют компоненты с весьма близкими свойствами, например изотопы одного и того же элемента. Его широко применяют для технологического либо препаративного разделения разнообразных смесей органической и неорганической природы (бензин, керосин, спецмасла), для выделения индивидуальных веществ (кислород, азот, этанол, бензол и др.). В неорганическом анализе этот метод применяют эпизодически, ибо чаще всего анализируют объекты с заметно различающимися по летучести макро- и микрокомпонентами. Успешное использование испарения из жидкости зависит от химической устойчивости макро- и микрокомпонентов при длительном нагревании.
5. Молекулярная (вакуумная) дистилляция.
При разделении химически неустойчивых веществ или веществ с высокой температурой кипения используют специальные системы вакуумирования для проведения процесса при пониженном давлении (до 10-1 -10-2 Па). Такое разделение называют молекулярной или вакуумной дистилляцией.
В отличие от условий разделения смесей с помощью обычной дистилляции, молекулярная дистилляция зависит не только от давлений паров чистых компонентов при температуре процесса, но и от их молярной массы. Это позволяет разделять смеси, используя различие молярных масс компонентов при относительно низких температурах.
Процесс молекулярной дистилляции включает в себя перенос молекул испаряющегося компонента из объёма жидкости к поверхности испарения, испарение молекул, перенос их в объёме паровой фазы от поверхности испарения к поверхности конденсации и конденсацию.
Таким образом, при молекулярной дистилляции изменение состава пара по сравнению с составом жидкости определяется различием скоростей испарения компонентов. Поэтому этим способом можно разделять смеси, компоненты которых обладают одинаковым давлением паров. При заданной температуре жидкости и соответствующем ей давлении паров скорость молекулярной дистилляции растёт с понижением давления в аппарате.
Этот метод используют, например, для концентрирования нелетучих микропримесей в тетрахлориде кремния SiCl4 (жидкость) и тетрахлориде титана TiCl4 (жидкость) с последующим атомно-эмиссионным определением (предел обнаружения примесей 10-6•10-8%); для снижения предела обнаружения хлора в металлическом натрии матрицу отделяют молекулярной дистилляцией, а ионы хлора в остатке (~10-4%) определяют кулонометрическим титрованием.
6. Сублимация
Сублимация (возгонка) представляет собой процесс испарения вещества путем непосредственного перехода его из твердого состояния в парообразное. Поэтому сублимация возможна в том случае, когда вещество, будучи нагрето до температуры ниже точки его плавления, характеризуется достаточно высоким давлением паров. При сублимации примеси более летучие, чем вещество основы, могут быть отогнаны при низкой температуре, а менее летучие примеси сосредоточены в остатке.
Положительным при сублимации является то, что этот процесс разделения и очистки может проводиться при относительно низких температурах и применим, в частности, к тугоплавким металлам. Недостаток сублимации заключается в том, что в отличие от методов испарения (система жидкость - пар, где тепловое движение молекул приводит к установлению равновесия между фазами и выравниванию концентрации внутри всей фазы) при сублимации достижение равновесия зависит от однородности распределения микрокомпонентов в объеме частицы (кристалла); диффузионные процессы происходят в нем крайне медленно. Поэтому по мере испарения нелетучие примеси накапливаются в наружном слое очищаемого металла, что замедляет возгонку основного металла. По мере увеличения концентрации примесей в поверхностном слое давление паров менее летучих компонентов возрастает и может достигнуть в пределе равновесного давления паров соответствующих чистых металлов в составе основы. Это способствует испарению менее летучих компонентов и может приводить к загрязнению ими возгона. Поэтому сублимацией целесообразно отделять основной летучий компонент от небольшой доли содержащихся в нем менее летучих примесей. В противном случае пробу перед анализом следует как можно тщательнее измельчать.
7. Фракционная перегонка
С помощью однократной простой перегонки, как правило, не удается чисто разделить на компоненты смесь двух или нескольких жидкостей с разницей в температурах кипения менее 80 °С. При нагревании таких смесей вместе с легколетучей жидкостью испаряется также некоторое количество компонента с более высокой температурой кипения. В отличие от простой перегонки, при которой разделение составляющих смесь продуктов происходит только на стадии испарения, фракционная перегонка предусматривает частичную конденсацию образующихся паров и возвращение их обратно в перегонный сосуд.
Конденсации и возврату в перегонную колбу подвергаются в первую очередь пары высококипящего компонента, а очищенные пары летучего продукта далее полностью конденсируются в холодильнике и собираются в приемнике. Так поэтапно перегоняется вся жидкость.
Перегонка называется фракционной потому, что вся перегоняемая жидкость собирается в разные приемники отдельными порциями, которые называются фракциями. Первые фракции содержат преимущественно вещество с самой низкой температурой кипения, последние— с самой высокой. Чистота разделения на отдельные фракции зависит от природы веществ, составляющих перегоняемую смесь, и от конструкции конденсирующих приборов — дефлегматоров или ректификационных колонок. В лабораториях при фракционной перегонке обычно применяют дефлегматоры.
Перегонка при пониженном давлении (в вакууме): Перегонка под вакуумом применяется с целью снижения температуры кипения веществ. Это бывает необходимо в тех случаях, когда соединения разлагаются в процессе их перегонки при атмосферном давлении или их температура кипения выше 200°С. Фракционная перегонка при пониженном давлении нередко позволяет добиться лучшей очистки. Объясняется это тем, что снижение температуры кипения с понижением давления у веществ из различных классов, например у кислот и эфиров, спиртов и углеводородов, происходит не строго пропорционально. Поэтому в вакууме разница в температурах кипения компонентов разделяемой смеси может оказаться даже большей, чем при атмосферном давлении. Фракционная вакуум-перегонка может оказаться полезной также при разделении некоторых азеотропных смесей.
Лиофильная сушка – разновидность испарения – сушка под вакуумом в замороженном состоянии. При этом вода удаляется путем сублимации льда, т. е. превращения его в пар, минуя жидкую фазу. Лиофилизованные ткани и препараты при увлажнении восстанавливают свои первоначальные свойства.