Направленность ковалентной связи
Взаимное перекрывание облаков может происходить разными способами, ввиду их различной формы. Различают -, - и -связи.
Сигма – связи образуются при перекрывании облаков вдоль линии, проходящей через ядра атомов. Пи – связи возникают при перекрывании облаков по обе стороны от линии, соединяющей ядра атомов. Дельта – связи осуществляются при перекрывании всех четырех лопастей d – электронных облаков, расположенных в параллельных плоскостях.
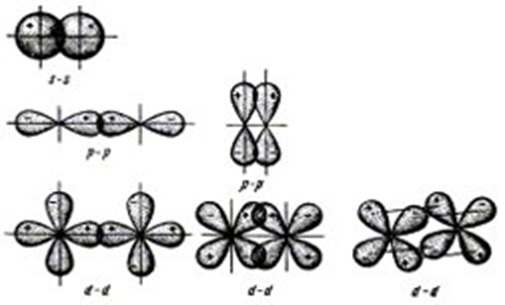
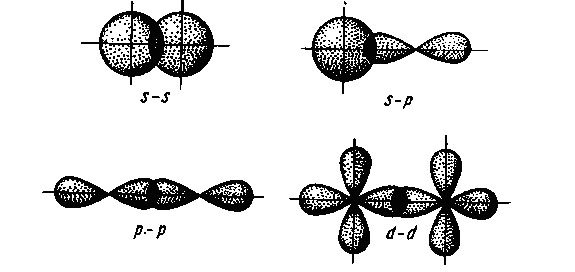
– связь может возникнуть при перекрывании вдоль линии, соединяющей ядра атомов в следующих орбиталей: s—s -, s— р-, р– р-, d— d -орбиталей , а также d— s-, d— р– орбиталей. (все центры орбиталей лежат на одной плоскости)
– связь может образовываться при перекрывании по обе стороны от линии, соединяющей ядра атомов следующих орбиталей:р—р-, р—d-, d—d-, f—p-, f—d— и f—f— орбиталей. (все центры орбиталей параллельны)
связь образуется при перекрывании d-орбиталей всеми четырьмя лепестками.
s— элементы способны к образованию только – связи, р— элементы — – и – связи, d— элементы — –, – и связи. При совместном образовании – и - связей получается двойная связь. Если же одновременно возникают две –и - связь, то образуется тройная связь. Количество возникших связей между атомами, называется кратностью связи.
Донорно-акцепторный способ трактовки ковалентной связи
Для образования этого вида ковалентной связи оба электрона предоставляет один из атомов — донор. Второй из атомов, участвующий в образовании связи, называется акцептором. В образовавшейся молекуле формальный заряд донора увеличивается на единицу, а формальный заряд акцептора уменьшается на единицу. Этот вид донорно-акцепторного взаимодействия — основной способ образования комплексных соединений. Подобное взаимодействие отвечает за многие кислотно-основные превращения, связанные с переносом иона водорода (акцептора).
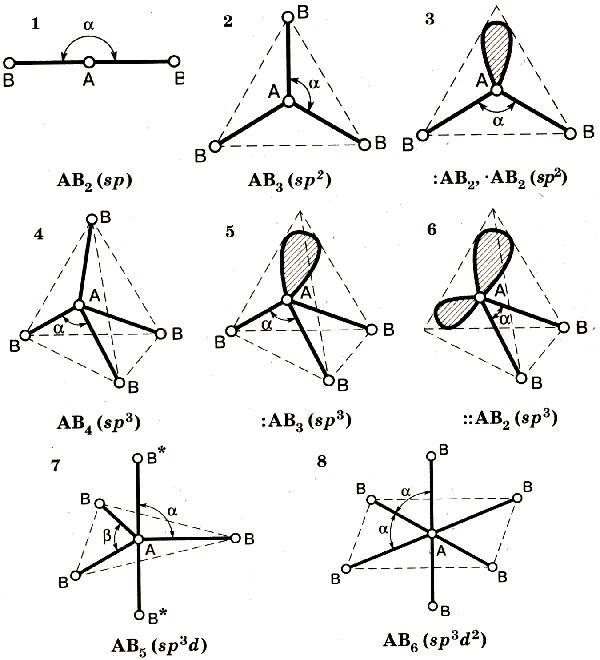
Гибридизация атомных орбиталей и соответствующие им симметрии и формы молекул
Число гибридных орбиталей определяется числом одинарных связей, а также количеством неподеленных электронных пар в молекуле. Эти электроны находятся на гибридных орбиталях. Когда же происходит перекрывание негибридных орбиталей двух атомов, то образуется кратная связь.
sp- Гибридизация . Одна s- орбиталь и одна p- орбиталь превращаются в две одинаковые "гибридные" орбитали, угол между осями которых равен 180°. Молекулы, в которых осуществляется sp- гибридизация, имеют линейную геометрию.
sp 2 - Гибридизация . Одна s- орбиталь и две p- орбитали превращаются в три одинаковые "гибридные" орбитали, угол между осями которых равен 120°. Молекулы, в которых осуществляется sp 2 - гибридизация, имеют плоскую геометрию.
s p 3 - Гибридизация . Одна s- орбиталь и три p- орбитали превращаются в четыре одинаковые "гибридные" орбитали, угол между осями которых равен 109°28'. Молекулы, в которых осуществляется sp 3 - гибридизация, имеют тетраэдрическую форму
| Набор атомных орбиталей | Набор гибридных орбиталей | Геометрическое расположение гибридных орбиталей | Примеры |
| s,p | sp | Линейное (угол 180°) | Be(CH3)2, HgCl2 MgBr2, СаН2, ВаF2, C2H2 |
| s,p,p | sp2 | Плоское тригональное (угол 120°) | BF3,GaCl3, InBr3,TeI3, C2H4 |
| s,p,p,p | sp3 | Тетраэдрическое (угол 109,5°) | CH4, AsCl4—, TiCl4, SiCl4, GeF4 |
| s,p,p,d | sp2d | Плоскоквадратнoe (угол 90°) | Ni(CO)4, [PdCl4]2— |
| s,p,p,p,d | sp3d | Тригонально-бипирамдальное (углы 120° и 90°) | PF5, PCl5, AsF5 |
| s,p,p,p,d,d | sp3d2 | Октаэдрическое ( угол 90°) | SF6, Fe(CN)63-, CoF63- |
Резонансные структуры
РЕЗОНАНСА ТЕОРИЯ, теория электронного строения хим. соединений, в основе к-рой лежит представление о том, что электронное распределение, геометрия и все др. физ. и хим. св-ва молекул должны быть описаны не одной возможной структурной ф-лой, а сочетанием (резонансом) всех альтернативных структур. Идея такого способа описания электронного строения принадлежит Л. Полингу (1928).
Примеры:
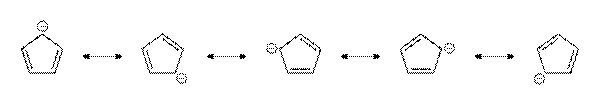
Резонансные структуры циклопентадиенид-иона

Резонансные структуры бензола


Определение константы химического равновесия на основе закона действующих масс
Константа равновесия — величина, определяющая для данной химической реакции соотношение между термодинамическими активностями (либо, в зависимости от условий протекания реакции, парциальными давлениями, концентрациями) исходных веществ и продуктов в состоянии химического равновесия (в соответствии с законом действующих масс). Зная константу равновесия реакции, можно рассчитать равновесный состав реагирующей смеси, предельный выход продуктов, определить направление протекания реакции.
https://ru.wikipedia.org/wiki/%D0%97%D0%B0%D0%BA%D0%BE%D0%BD_%D0%B4%D0%B5%D0%B9%D1%81%D1%82%D0%B2%D1%83%D1%8E%D1%89%D0%B8%D1%85_%D0%BC%D0%B0%D1%81%D1%81
По этой ссылке формулы и описание к ним. В ворд оно не копируется, почему-то. И вообще эту тему не поняла особо, но вроде это оно