Стандартизация лекарственных средств и метрология», специальность 5В110300 - «Фармация», 5 курс, 2016-2017 уч. год. 374 тестов
~Образцы вагинальных таблеток считают распавшимися, если … .
|на перфорированном диске не осталось осадка или оставшийся осадок состоит только из мягкой или пенообразной массы, не имеющей твердого ядра
|на сетке нет остатка
|на сетке есть остаток, состоящий из мягкой массы, не имеющей ощутимо твердого несмачиваемого ядра
|наблюдается полное растворение
|расплавленные жировые вещества собрались на поверхности жидкости, нерастворимые порошкообразные вещества осели на дно, а растворимые компоненты растворились
~Для определения однородности содержания действующего вещества применяется метод прямого определения и метод … .
| расчетно-массовый
| расчетно-объемный
| косвенного определения
| обратного определения
| расчетный
~Определение однородности содержания действующего вещества расчетно-массовым методом применяется для … .
| мягких капсул с жидким содержимым и гранул
| глазных пленок
| суппозиториев и пессариев
| трансдермальных пластырей
| таблеток, покрытых оболочкой и без оболочки
~… каждого кролика является наивысшей зарегистрированной температурой у данного кролика в течение 3 ч после инъекции.
| «Максимальная температура»
| «Исходная температура»
| «Минимальная температура»
| «Средная температура»
| «Суммарная температура»
~… определяют методом неподвижной воронки и воронки с виброустройством.
| Текучесть твердых веществ
| Насыпной объем порошка
| Извлекаемый объем раствора
| Истираемость таблетки
| Распадаемость таблетки
~Лекарственные препараты являются …,если они содержат одинаковое количество одной и той же активной субстанции в одной и той же лекарственной форме, отвечают требованиям одних и тех же или сходных стандартов.
| фармацевтически эквивалентными
| биологически эквивалентными
| терапевтически эквивалентными
| эквивалентными in vitro
| взаимозаменяемыми
~Два лекарственных препарата являются …, если они фармацевтически эквивалентны и будут иметь одинаковый клинический эффект и одинаковый профиль безопасности при использовании пациентами в соответствии с указаниями на этикетке.
| терапевтически эквивалентными
| биологически эквивалентными
| фармацевтически эквивалентными
| эквивалентными in vitro
| взаимозаменяемости
~Два лекарственных препарата являются …, если обеспечивают одинаковую биодоступность, под которой понимают количество неизмененного действующего вещества, достигающего системного кровотока, относительно исходной дозы
| биологически эквивалентными
| терапевтически эквивалентными
| фармацевтически эквивалентными
| эквивалентными in vitro
| взаимозаменяемости
~Определение … предназначено для оценки эквивалентности профилей растворения в трех средах со значениями рН 1,2; 4,5 и 6,8 исследуемого лекарственного препарата и препарата сравнения или лекарственные препараты одного производителя в различных дозировках.
| эквивалентности in vitro
| терапевтической эквивалентности
| фармацевтической эквивалентности
| биологической эквивалентности
| взаимозаменяемости
~Характеристикой … является отношение максимальной дозы лекарственных средств, зарегистрированной к медицинскому применению, (D, мг) к растворимости (S, мг/мл) при данном значении pH.
| биофармацевтической растворимости
| фармакопейной растворимости
| высокой растворимости
| проницаемости
| низкой растворимости
~Мерой интенсивности процессов размывания в методе высокоэффективной жидкостной хроматографии является … .
| высота, эквивалентная теоретической тарелке
| коэффициент емкости
| относительное удержание
| время удержания
| критерий разделения
~Для повышения эффективности разделения в методе высокоэффективной жидкостной хроматографии предпочтительнее менее вязкие растворители, так как в них больше … и меньше сопротивление колонки.
| коэффициент диффузии
| коэффициент емкости
| плотности
| полярности
| неполярности
~На регистрацию в Европейское агентство лекарственных средств подается одна заявка в формате Общего технического документа ... .
| международная конференция по гармонизации (ICH)
| надлежащая производственная практика (GMP)
| надлежащая лабораторная практика (GLP)
| Европейский союз (ЕС)
| надлежащая клиническая практика (GCP)
~Многосторонними процедурами регистрации препаратов являются: ..., децентрализованная и процедура взаимного признания.
| централизованная
| полная
| смешанная
| зависимая национальная
| независимая
~Директивы, регламентирующие содержание остаточных растворителей применяются ко всем ... .
| дозированным лекарственным формам
| новым активным субстанциям
| вспомагательным веществам
| ЛП, находящимся на стадии клинических испытаний
| ЛП, присутствующим на рынке
~Согласно Европейской фармакопее, нормы распадаемости для ректальных суппозиториев на гидрофильной основе, вагинальных пессариев составляет ... минут.
| 60
| 30
| 15
| 5
| 20
~Согласно Европейской фармакопее, нормы распадаемости для ректальных суппозиториев на липофильной основе, вагинальных пессариев составляет ... минут.
| 30
| 60
| 15
| 5
| 20
~Определение однородности содержания действующего вещества расчетно-массовым методом применяется для … .
| жидких лекарственных средств орального применения
| глазных пленок
| суппозиториев и пессариев
| трансдермальных пластырей
| таблеток, покрытых оболочкой и без оболочки
~Определение однородности содержания действующего вещества расчетно-массовым методом применяется для … .
| лиофилизированных лекарственных средств
| глазных пленок
| суппозиториев и пессариев
| трансдермальных пластырей
| таблеток, покрытых оболочкой и без оболочки
~Определение однородности содержания действующего вещества методом прямого определения применяется для … .
| глазных пленок
| лиофилизированных лекарственных средств
| жидких лекарственных средств орального применения
| мягких капсул с жидким содержимым
| гранул, порошков, содержащих действующее вещество
~ … используют для определения скорости растворения активных ингредиентов при анализе таблеток.
| Тест растворение
|Однородность дозирования
| Истираемость
| Распадаемость
| Однородность массы
~Под термином «…» подразумевают количество действующего вещества, передшего в раствор за 45 минут из твердой дозированной лекарственной формы.
| Растворение
| Однородность дозирования
| Истираемость
| Распадаемость
| Однородность массы
~Тест «Растворение» для твердых дозированных лекарственных форм проводится для …. единиц(ы) испытуемого препарата.
| шести
|двух
| десяти
| двадцати
| одной
~При проведении тест «Растворение» в приборе с лопастью и корзинкой за … минут для каждой единицы испытуемого препарата в раствор перешло не менее 75% и не более 115% действующего вещества.
|45
|15
|60
|30
|1
~Определение относительной плотности методом 1 применяют в случае определения плотности (г/см3) жидкостей с точностью до … .
|10-3
|0,01
|0,1
|10-5
|0,001
~При определении относительной плотности методом 2 применяют в случае определения плотности (г/см3) жидкостей с точностью до … .
|0,01
|10-3
|0,1
|10-5
|0,001
~Осмоляльность определяют по понижению температуры … раствора при отсутствии других указаний в частной статье.
|замерзания
|кипения
|плавления
|затвердевания
|каплепадения
~Глазные капли, предназначенные для использования при хирургических процедурах, не должны содержать ... и должны выпускаться в однодозовых контейнерах.
|антимикробных консервантов
|разбавляющих веществ
|связывающих веществ
|скользящих веществ
|красители
~Распадаемость ... считается распавшейся, если после прекращения выделения газа вокруг таблетки или ее фрагментов растворилась, или диспергировалась в воде без агломератов частиц.
|шипучих таблеток
|таблетки без оболочки
|таблетки, покрытые оболочкой
|таблетки кишечно-растворимые
|таблетки диспергируемые
~... испытанию на распадаемость не подлежат.
|таблетки для разжевывания
|таблетки без оболочки
|таблетки, покрытые оболочкой
|таблетки кишечно-растворимые
|таблетки диспергируемые
~Приведенная методика испытаний настойки боярышника: «В плоскодонную чашку вносят испытуемый экстракт, выпаривают досуха на водяной бане, сушат в сушильном шкафу при 100-1050C в течение 3 ч, охлаждают в эксикаторе над силикагелем безводным и взвешивают» используется ГФ РК для определения ... .
|сухого остатка
|содержания этанола
|количественного содержания
|специфических примесей
|тяжелых металлов
~Приведенная методика испытаний настойки боярышника: «10,0 мл настойки упаривают досуха, прибавляют 1 мл кислоты серной, осторожно сжигают, остаток прокаливают в муфельной печи, охлаждают, прибавляют раствор аммония ацетата, фильтруют, доводят объем фильтрата до 100 мл» используется ГФ РК для определения ... .
|тяжелых металлов
|содержания этанола
|количественного содержания
|специфических примесей
|радионуклеидов
~В соответствии с требованиями ГФ РК относительную плотность настойки календулы по методу 2 с точностью до 0.01 измеряют с помощью ... .
| ареометра
| гидростатических весов
| пикнометра
| цифрового денситометра
|осциллографического датчика
~В соответствии с требованиями ГФ РК этанол в настойке календулы по методу А определяют после отделения этанола от растворенных веществ методом дистилляции и измерением его содержания ... .
| с помощью пикнометра
| с помощью гидростатических весов
| методом парофазной газовой хроматографии
| методом газовой хроматографии
|методом высокоэффективной жидкостной хроматографии
~В соответствии с требованиями ГФ РК этанол в настойке календулы по методу А определяют после отделения этанола от растворенных веществ методом дистилляции и измерением его содержания ... .
| с помощью ареометра
| с помощью гидростатических весов
| методом парофазной газовой хроматографии
| методом газовой хроматографии
|методом высокоэффективной жидкостной хроматографии
~В соответствии с требованиями ГФ РК содержание этанола в настойке женьшеня по методу В определяют ... .
| газовой хроматографией
| высокоэффективной жидкостной хроматографией
| с помощью ареометра
| парофазной газовой хроматографией
| с помощью пикнометра
~В соответствии с требованиями ГФ РК на приборе, представленном ниже, определяют … .
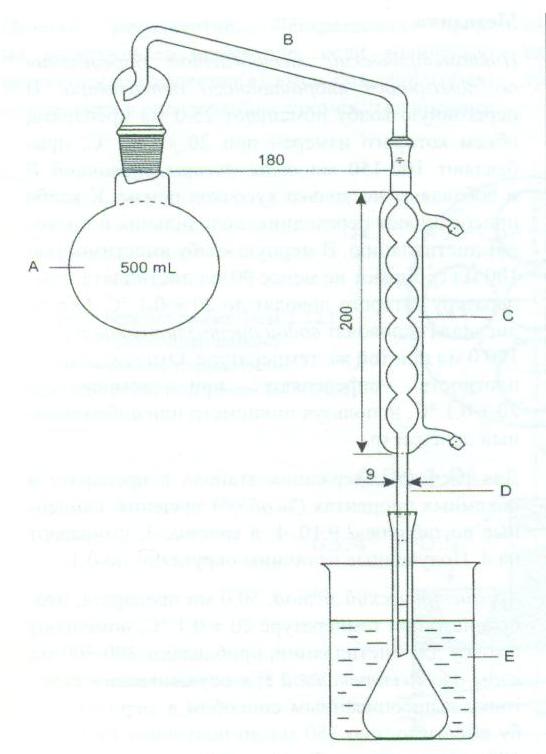
|содержание этанола
|относительную плотность
|однородность массы для единицы дозированного лекарственного средства
|распадаемость таблеток и капсул
|однородность содержания действующего вещества
~В соответствии с требованиями ГФ РК в спиртсодержащих жидких экстрактах допускается содержание метанола и 2-пропанола не более … .
|0,05%
|5%
|1,05%
|3%
|10%
~В соответствии с требованиями ГФ РК в настойках допускается содержание метанола и 2-пропанола не более … .
|0,05%
|5%
|1%
|3,05%
|10%
~Приведенная методика испытаний таблеток: «Точную навеску порошка растертых таблеток обрабатывают теплой водой, жидкость отфильтровывают через беззольный фильтр, фильтр с остатком высушивают, сжигают, прокаливают и взвешивают с точностью до 0,1 мг» используется ГФ РК для определения ... .
|талька
|содержания этанола
|количественного содержания
|специфических примесей
|тяжелых металлов
~ В соответствии с требованиями ГФ РК при проведении испытаний таблеток, покрытых кишечно-растворимой оболочкой на распадаемость, время устойчивости таблеток в кислой среде 0,1М кислоты хлороводородной должно составлять ... .
| от 2 ч до 3 ч
|от 15 мин до 30 мин
|от 45 до 60 мин
| не менее 1 ч
|не менее 2 ч
~В соответствии с требованиями ГФ РК при проведении испытаний таблеток, покрытых кишечно-растворимой оболочкой на распадаемость, время устойчивости таблеток в жидкой среде фосфатного буферного раствора с рН 6,8 должно составлять ... .
| не более 60 мин
|от 15 до 30 мин
|от 10 до 15 мин
|не менее 15 мин
|не менее 30 мин
~В соответствии с требованиями ГФ РК при проведении испытаний таблеток, покрытых оболочкой, за исключением пленочной, на распадаемость, время устойчивости таблеток в жидкой водной среде должно составлять ... .
|не более 60 мин
|от 15 до 30 мин
|от 10 до 15 мин
|не менее 15 мин
|не менее 30 мин
~В соответствии с требованиями ГФ РК при проведении испытаний таблеток, покрытых оболочкой, за исключением пленочной, на распадаемость, время устойчивости таблеток в жидкой среде 0,1М кислоты хлороводородной должно составлять ... .
| не более 60 мин
|от 15 до 30 мин
|от 10 до 15 мин
| не менее 15 мин
|не менее 30 мин
~В соответствии с требованиями ГФ РК при проведении испытаний таблеток без оболочки на распадаемость, время устойчивости таблеток в жидкой водной среде должно составлять ... .
| не более 15 мин
|от 15 до 30 мин
|от 2 ч до 3 ч
|не менее 15 мин
|не менее 30 мин
~В соответствии с требованиями ГФ РК испытание таблеток на «Однородность содержания действующего вещества в единице дозированного лекарственного средства» не проводится для таблеток ... .
|поливитаминных препаратов
|покрытых кишечно-растворимой оболочкой
|покрытых пленочной оболочкой
|диспергируемых в полости рта
|с модифицированным высвобождением
~В соответствии с требованиями ГФ РК испытание таблеток на «Однородность содержания действующего вещества в единице дозированного лекарственного средства» не проводится для таблеток ... .
|содержащих микроэлементы
|покрытых кишечно-растворимой оболочкой
|покрытых пленочной оболочкой
|диспергируемых в полости рта
|с модифицированным высвобожде-нием
~В соответствии с требованиями ГФ РК для оценки способности таблеток
выдерживать трение в упаковке и пригодности их к транспортированию проводят испытание на … .
| истираемость
|распадаемость
|устойчивость к раздавливанию
|растворение
|однородность содержания
~В соответствии с требованиями ГФ РК прибор, представляющий собой два расположенные друг против друга зажима с плоскими сдавливающими поверхностями, перпендикулярными направлению движения, один из которых может перемещаться по направлению к другому, используют для определения … таблеток.
| устойчивости к раздавливанию
|распадаемости
|истираемости
|однородности дозирования
|средней массы
~В соответствии с требованиями ГФ РК тест «Растворение» не является обязательным для … .
| поливитаминных лекарственных препаратов
|таблеток с модифицированным высвобождением
| таблеток, покрытых оболочкой
|таблеток без оболочки
| капсул в мягкой оболочке
~В соответствии с требованиями ГФ РК тест «Растворение» не является обязательным для … .
|жевательных таблеток
|таблеток с модифицированным высвобождением
|таблеток, покрытых оболочкой
|таблеток без оболочки
| капсул в мягкой оболочке
~...- количество действующего вещества, которое в стандартных условиях за определенное время должно перейти в раствор из твердой дозированной лекарственной формы.
|Растворение
|Распадаемость
|Номинальный объем
|Средняя масса
| Извлекаемый объем
~Приведенная методика испытаний инъекционных и внутривенных инфузионных растворов: «С контейнера удаляют наклеенные этикетки, моют его снаружи, сушат. Плавно вращая или переворачивая контейнер, избегая образования воздушных пузырьков, просматривают в течение 5 с перед белым экраном» используется ГФ РК для определения ... .
|механических включений
|цветности
|степени опалесценции
|прозрачности
|номинального объема
~При микроскопическом исследовании лекарственного растительного сырья используется раствор … для обнаружения слизи в клетках.
|рутения красного
|глицерина
|хлоралгидрата
|флороглюцина
|кислоты молочной
~При микроскопическом исследовании лекарственного растительного сырья используется раствор … для обнаружения лигнина в клетках или тканях.
|флороглюцина
|глицерина
|хлоралгидрата
|рутения красного
|кислоты молочной
~При микроскопическом исследовании лекарственного растительного сырья используется раствор … для обнаружения крахмала и инулина.
|глицерина
|рутения красного
|хлоралгидрата
|флороглюцина
|кислоты молочной
~При микроскопическом исследовании лекарственного растительного сырья используется раствор … для обнаружения различных элементов.
|кислоты молочной
|глицерина
|хлоралгидрата
|флороглюцина
|рутения красного
~… – это предел содержания примеси, при превышении которого примесь должна подлежать идентификации.
|Предел идентификации
|Предел исключения
|Идентифицированная примесь
|Предел регистрации
|Определяемая примесь
~… примесь - это примесь, которая теоретически может образовываться в процессе производства или хранения.
|Возможная
|Определяемая
|Идентифицированная
|Неидентифицированная
|Неопределяемая
~… примесь - это примесь неустановленной структуры, определяемая исключительно по качественным аналитическим параметрам.
|Неидентифицированная
|Определяемая
|Идентифицированная
|Возможная
|Неопределяемая
~… в качестве среды растворения рекомендуется использовать, если изменения рН не оказывают влияния на растворение.
| Воду
|0,1М кислоту хлороводородную
|Ацетатный буфер
|Фосфатный буфер
|Искусственный кишечный сок
~При выполнении испытания «Растворение» проводится … во избежание образования пузырьков газа в проточной ячейке.
|дегазация среды
|выбор среды растворения
|выбор скорость вращения
|выбор скорость потока жидкости
|выбор объем среды растворения
~Допускается приготовление хлороводородных сред растворения с использованием … вместо натрия хлорида.
|калия хлорида
|морфина гидрохлорид
|новокаина гидрохлорид
|магния хлорида
|кальция хлорида
~. … - инициатива, объединяющая как равных партнеров, регуляторные органы и фармацевтическую промышленность, в научной и технической дискуссии о процедурах тестирования, необходимых для достижения безопасности, качества и эффективности лекарственных препаратов.
|International conference of harmonization ( ICH)
|Food and Drug Administration (FDA)
|Good Participation Practice (GPP)
|European Medicines Agency (EMEA)
|Good Manufacturing Practice (GMP)
~ В нормативном документе ICH определению стабильности ЛП посвящен раздел … .
|Q1
|M4
|E5
|Q10
|Q9
~В нормативном документе ICH определению примесей в новых фармацевтических субстанциях посвящен раздел … .
|Q3A(R2)
|Q2(R1)
|Q3C(R3)
|Q3B(R2)
|Q1A(R2)
~В нормативном документе ICH раздел Q2(R1) посвящен … .
|Валидации аналитических методик
|Разработке фармацевтических продуктов
|Качеству биотехнологических препаратов
|GMP для активных фармацевтических компонентов
|Управлению рисками, связанными с качеством
~В нормативном документе ICH определению планирования фармаконадзора посвящен раздел … .
|E2E
|E2B(R3)
|E2A
|E2D
|E2C(R1)
~Создать продукт высокого качества и соответствующий производственный процесс, обеспечивающий клиническое действие продукта, предусмотренное его дизайном – это … .
|цель фармацевтической разработки
|инструмент управления рисками
| метод технологического процесса
|основная задача стандарта GLP
|требование стандарта GVP
~В нормативном документе ICH определению фармакопей посвящен раздел … .
|Q4
|Q2
|Q8
|Q9
|Q1
~Обязательными требованиями при разработке новых ЛП в ICH являются:
|безопасность, качество, эффективность ЛП и мультидисциплинарность
|стабильность, безопасность ЛС
|специфичность, линейность, селективность и повторяемость методик
|безопасность, качество и эффективность ЛС
|генотоксичность и мутагенность
~Наблюдателем в составе ICH является:
|World Health Organization (WHO)
|The International Federation of Pharmaceutical Manufacturers and Associations (IFPMA)
|European Union (EU)
| Pharmaceutical Research and Manufacturers of America (PhRMA)
|Food and Drug Administration, USA (FDA)
~ICH состоит из … .
|непосредственно вовлеченных Сторон (ICH Parties), Наблюдателей (Observers) и IFPMA
|наблюдателей (Observers), регулируемых органов и IFPMA
|непосредственно вовлеченных Сторон (ICH Parties) и Наблюдателей (Observers)
|регулируемых органов и членов-учредителей, Наблюдателей и ВОЗ
|главного регулируемого органа, непосредственно вовлеченных сторон и EFTA
~В нормативном документе ICH определению разработки фармацевтических продуктов посвящен раздел … .
|Q8
|M4
|E5
|Q9
|Е9
~В нормативном документе ICH определению GCP посвящен раздел … .
|E6(R1)
|E2B(R3)
|E2A
|E2D
|E2C(R1)
~В нормативном документе ICH раздел S2B посвящен … .
|Генотоксичности
|Разработке фармацевтических продуктов
|Валидации аналитических методик
|GMP для активных фармацевтических компонентов
|Качеству биотехнологических препаратов
~ В нормативном документе ICH определению необходимости в исследовании мутагенности препаратов посвящен раздел … .
|S1A
|М1B
|E2A
|S2B
|Q3A
~В нормативном документе ICH раздел M1 посвящен … .
|Медицинской терминологии
|Элементам данных и образцов для лекарственных словарей
|Валидации аналитических методик
|Общему техническому документу (ОТД)
|Электронным образцам для переноса регулятивной информации
~…- это сознательное изменение рецептуры производства лекарственного средства.
|Фальсификат
|Оригинал
|Генерик
|Биоссимуляр
|Контрофакт
~… - лекарственное средство, не соответствующее по составу, свойствам и другим характеристикам оригиналу или воспроизведенному лекарственному средству (генерику) изготовителя, противоправно и преднамеренно снабженное поддельной этикеткой
|Фальсифицированное лекарственное средство
|Новое лекарственное средство
|Воспроизведенное лекарственное средство (генерик)
|Лекарственное растительное сырье
|Оригинальное лекарственное средство
~Препятствующим фактором, влияющим на оборот фальсифицирующих лекарственных средств в развивающихся странах является … .
|легкость и дешевизна разработки, регистрации и производства ЛС внутри страны
|низкая себестоимость производства ЛС
|свободный ввоз в страну ЛС
|слабая законодательная база и отсутствие контроля за выполнением законов
|высокая стоимость ЛС, импортируемых из развитых стран
~ … представляет собой качественный и количественный состав действующего вещества, соответствующей маркировке, сфальсифицированной торговой маркой производителя ЛП.
|«Белый» фальсификат
|Фальсифицированное лекарственное средство
|«Черный» фальсификат
|Воспроизведенное лекарственное средство (генерик)
|Биоссимиляр
~… представляет собой качественный и количественный состав действующего вещества, не соответствующей маркировке, с фальсифицированной торговой маркой, технологией производителя ЛП.
|«Черный» фальсификат
|«Белый» фальсификат
|Биоссимиляр
|Воспроизведенное лекарственное средство (генерик)
|Фальсифицированное лекарственное средство
~ Ведущей организацией в области международной стандартизации является … .
|международная организация по стандартизации (ИСО)
|госстандарт РК
|международная электротехническая комиссия (МЭК)
|Европейский комитет по стандартизации (СЕН)
|Межскандинавская организация по стандартизации (ИНСТА)
~Конечным результатом работ по стандартизации является … .
|повышение степени соответствия объектов стандартизации к целевому назначению
|гармонизация национальных стандартов всех стран
|обновление действующих и разработка новых стандартов
|всеобщее применение международных стандартов
|получение сертификата соответствия
~ГФ РК и ее законодательный статус регламентированы... .
|Кодексом Республики Казахстан«О здоровье народа и системе здравоохранения»
|Законом РК «О лекарственных средствах»
|Законом РК «О стандартизации»
|Гражданским процессуальным Кодексом РК
|Кодексом Республики Казахстан«О административным правонарушениям»
~Из каждой единицы продукции, отобранной для вскрытия, берут, избегая измельчения, 3 точечные пробы … .
|сверху, снизу и из середины
|сверху, из середины
|из середины, снизу
|с верхнего слоя и со дна ящика
|после удаления сырья примерно до половины ящика
~При определении ... прибор калибруют, используя дисперсионные взвеси стандартного образца (СО) ГФ РК сферических частиц размером от 5мкм до 25мкм.
|механических включений
|родственных примесей
|взвешенных частиц
|остаточных растворителей
|неорганических примесей
~В соответствии с требованием ГФ РК температурное значение от 2° до 8°С соответствует термину «...» .
|в холодильнике
|глубокое охлаждение
|в холодном или прохладном месте
|при комнатной температуре
|в холодном месте
~В соответствии с требованием ГФ РК температурный значение -15°С соответствует термину «...» .
|глубокое охлаждение
| в холодильнике
|в холодном или прохладном месте
|при комнатной температуре
|в холодном месте
~В соответствии с требованием ГФ РК температурное значение от 8° до 15°С соответствует термину «...» .
| в холодном или прохладном месте
| глубокое охлаждение
|в холодильнике
|при комнатной температуре
|в холодном месте
~В соответствии с требованием ГФ РК температурное значение от 15° до 25°С соответствует термину «...» .
|при комнатной температуре
|глубокое охлаждение
|в холодном или прохладном месте
|в холодильнике
|в холодном месте
~В монографии ГФ РК первый раздел определенных и потенциальных примесей называют «...» примесями.
|специфическими
|инородными
|чужеродными
|взвешенными
|общетехнологическими
~ В монографии ГФ РК второй раздел определенных и потенциальных примесей называют «...» примесями.
|инородными
|специфическими
|чужеродными
|взвешенными
|общетехнологическими
~По требованию ГФ РК если невскрытый контейнер хранится по условиям сопроводительного документа, то гарантируется его использование в течение ... .
|6 месяцев
|1 года
|2 лет
|2 месяцев
| 2 недель
~В соответствии с монографией ГФ РК при определении степени опалесценции жидкостей визуальным методом параллельно проводят инструментальные методы ... .
|турбидиметрия, нефелометрия
| рефрактометрия, поляриметрия
| спектрофотометрия, полярография
| рефрактометрия, полярография
|полярография, поляриметрия
~В соответствии с монографией III тома ГФ РК ... называются субстанции, при определении степени гигроскопичности которых увеличивается масса на 15% и более.
|хорошо гигроскопичными
|абсолютно сухими
|гигроскопичными
|мало гигроскопичными
|очень хорошо гигроскопичными
~... стандартные образцы не аттестируются в сравнении с первичными стандартными образцами.
|Первичные
|Вторичные
|Международные
|Европейской фармакопеи (ЕФ)
|Химические вещества ЕФ
~... стандартные образцы аттестируются в сравнении с первичными стандартными образцами.
|Вторичные
|Первичные
|Международные
|Европейской фармакопеи (ЕФ)
|Химические вещества ЕФ
~В соответствии с ГФ РК в испытаниях на подлинность используется валидационная характеристика … .
|специфичность
|правильность
|прецизионность
|линейность
предел обнаружения
~Под специфичностью понимают … .
|способность достоверно определять анализируемое соединение в присутствии других компонентов образца
|степень близости результатов для серии измерений, выполненных на различных пробах одного и того же образца
|степень соответствия справочной величиной и значением, полученным по данной методике
|минимальное количество анализируемого вещества в образце, которое может быть обнаружено
|предел количественного содержания
~Валидация аналитической методики - … .
|экспериментальное доказательство того, что методика пригодна для решения предполагаемых задач
|соответствие лекарственного средства требованиям фармакопейной статьи
|способ проведения анализа, детальное изложение всех операций, необходимых для выполнения испытания
|мера взаимосвязи измеренных явлений
|степень соответствия справочной величиной и значением, полученным по данной методике
~Приемлемое значение коэффициента корреляции (r) при определении показателя «Линейность» составляет … .
|r 0,99
| r < 0,95
|r = 0,95
| r > 1
|r < 3,2
~Валидационную характеристику «Предел количественного определения» определяют при … .
|количественном определении посторонних примесей
|проведении испытания на подлинность
|количественном определении основного действующего вещества
|количественном определении вещества в тесте «растворение»
|количественном определении вспомогательных веществ
~Валидационная характеристика «Прецизионность» определяет меру … .
|случайных ошибок
|систематических ошибок
|случайных и систематических ошибок
|взаимосвязи измеренных явлений
|относительного стандартного отклонения
~Основная характеристика линейности - … .
|коэффициент корреляции (r)
|уравнение градуировочного графика
|параметр b градуировочной функции
|коэффициент a градуировочной функции
| относительное стандартное отклонение
~Для оценки прецизионности используют расчет … .
| относительного стандартного отклонения
| открываемости
|коэффициента корреляции
|предела обнаружения
| параметра b градуировочной функции
~Правильность характеризует … .
|cтепень соответствия между известным истинным значением или справочной величиной и значением, полученным по данной методике
|минимальное количество анализируемого вещества в образце, которое может быть обнаружено по данной методике
|способность достоверно определять анализируемое соединение в присутствии других компонентов образца
|степень близости результатов для серии измерений, выполненных на различных пробах одного и того же образца
|максимальное количество анализируемого вещества в образце, которое может быть обнаружено
~Критерием правильности аналитической методики служит … .
|расчет открываемости
|расчет коэффициента корреляции
|стандартного отклонения
|относительного стандартного отклонения
|предел обнаружения
~Доклинические исследования лекарственных средств проводятся согласно Международного стандарта … .
|Правила доклинических исследований безопасности и эффективности лекарственных средств (Good Laboratory Practice, GLP)
|Надлежащая клиническая практика (Good Clinical Practice, GCP)
|Правила оптовой торговли (Good Distribution Practice, GDP)
|Правила фармацевтической (аптечной) практики (Good Pharmacy Practice, GPP)
|Правила организации производства и контроля качества лекарственных средств (Good Manufacturing Practice, GMP)
~Клинические испытания проводится в соответствии с Международным стандартом … .
| Надлежащая клиническая практика (Good Clinical Practice, GCP)
|Правила доклинических исследований безопасности и эффективности лекарственных средств (Good Laboratory Practice, GLP)
|Правила оптовой торговли (Good Distribution Practice, GDP)
| Правила фармацевтической (аптечной) практики (Good Pharmacy Practice, GPP)
|Правила организации производства и контроля качества лекарственных средств (Good Manufacturing Practice, GMP)
~… - препарат, не зарегистрированный для лечения определенных заболеваний у людей.
|экспериментальное лекарство
|плацебо
|контрольный препарат
|дженерик
|балк-продукт
~Регистрация дженерика проводится без … .
|обязательного проведения четырёх фаз клинических исследований
|информации о соответствии правилам GMP
|сведений об отклонении фармакокинетических свойств от оригинала в
пределах 20%
|обязательного проведения дорегистрационных рандомизированных
сравнительных исследований эффективности и безопасности
|сведений об отклонении фармакодинамических свойств от оригинала в
пределах 20%
~Согласно требованиям GMP валидация на фармацевтическом производстве проводится с целью … .
|обеспечения стабильного выпуска продукции, отвечающей установленным требованиям
|улучшения качества выпускаемой продукции
|повышения работоспособности предприятия
|обеспечения стабильности выпуска готовой продукции
|обеспечения непрерывного производственного процесса
~Основной задачей валидации фармацевтического производства согласно требованиям GMP является получение … .
|документированных доказательств, что все системы, оборудование и технологический процесс соответствуют установленным требованиям
|доказательств, что все элементы производственного процесса отвечают заданным параметрам
|документированных доказательств, что технологическое оборудование функционирует в соответствии со спецификациями поставщика
| записей о состоянии технологического процесса
|качественной продукции
~Права и безопасность субъектов исследования по правилам GLP гарантирует … .
|Хельсинская декларация
|свод законов РК
|клятва Гиппократа
|клятва провизора
|Болонская декларация
~Качество лекарственного средства конкретного предприятия-производства регламентирует … .
|аналитический нормативный документ
|временный аналитический нормативный документ
|временная фармакопейная статья
|фармакопейная статья
|государственная фармакопея
~Качество нового лекарственного средства конкретного предприятия-производства регламентирует … .
|временный аналитический нормативный документ
|аналитический нормативный документ
|временная фармакопейная статья
|фармакопейная статья
|государственная фармакопея
~ … регламентирует качество лекарственного средства, пересматривается через каждые пять лет.
|Фармакопейная статья
|Аналитический нормативный документ
|Временная фармакопейная статья
|Временный аналитический нормативный документ
|Государственная фармакопея
~Определение: «Степень воспроизводимости результатов измерений, полученных при анализе одинаковых образцов при разных минимальных изменениях условий выполнения методики» соответствует валидационной характеристике … .
|робастность
|специфичность
|воспроизводимость
|прецизионность
|линейность
~Определение: «Способность методики получать результаты, которые прямо пропорциональны концентрации (количеству) вещества в пробе» соответствует валидационной характеристике … .
|линейность
|робастность
|специфичность
|воспроизводимость
|прецизионность
~Определение: «Способность методики определять анализируемое вещество в присутствии других компонентов в пробе» соответствует валидационной характеристике… .
|специфичность
|робастность
|линейность
|воспроизводимость
|правильность
~В НД в раздел «Описание» на субстанцию для ядов и сильнодействующих веществ не следует включать описание … .
|вкуса, запаха
|физического состояния
|гигроскопичности
|отношения к действию света и воздуха
|цвета
~В НД в разделе «Растворимость» на субстанцию не рекомендуется использование … растворителей.
|легкокипящих и легковоспламеняющихся
|полярных
|неполярных
|окрашенных
|летучих
~В НД в разделе «Растворимость» на субстанцию указывают показатели растворимости в растворителях, различных по … .
|полярности
|летучести
|цветности
|токсичности
|воспламеняемости
~В НД раздел «Остаточные органические растворители» на субстанцию вводится в случае использования при синтезе….
|токсичных растворителей на последней стадии производства
|легкокипящих и легковоспламеняющихся растворителей
|окрашенных растворителей на последней стадии производства
|летучих растворителей
|двух и более растворителей
~Пределы содержания действующего вещества в лекарственной субстанции согласно требованиям НД выражаются в … .
|единице массовой доли (в процентах) или активности в единицах действия на миллиграмм (ЕД/мг)
|моль растворённого вещества в 1 литре раствора
|числе грамм-эквивалентов вещества в одном литре раствора
|числе граммов растворённого вещества, содержащихся в одном ml раствора.
|мольной доле - числе молей растворённого вещества на 1 моль раствора.
~В НД температурный режим хранения лекарственного средства указывают с использованием выражения … .
| «при температуре не выше/ ниже … 0с»
| «в прохладном месте»
| «при комнатной температуре»
| «при комфортной температуре»
| «при умеренной температуре»
~Химическое модифицирование структуры известных лекарственных веществ используют в фармацевтической химии для … лекарственных средств.
| направленного поиска новых
|фармацевтического анализа
| определения стабильности
| выделения биологические активных веществ из
| количественного анализа
~Стандартизация лекарственных средств – это процесс … лекарственных средств.
|установления единой системы показателей качества и методов испытания
|определения стабильности
|регистрации
|экспертизы
|проведения доклинических сипытаний
~Аналитический нормативный документ - это … .
|документ, устанавливающий обязательные требования к качеству лекарственного средства
|регистрационное досье на лекарственное средство
|перечень показателей качества
|методы анализа лекарственного средства
|методики испытаний качества
~Временный аналитический нормативный документ - это … .
|документ, разрабатываемый на первые промышленные (установочные) серии новых лекарственных средств
|регистрационное досье на лекарственное средство
|перечень показателей качества
|методы анализа лекарственного средства
|методики испытаний качества
~Сертификация лекарственных средств – это … .
|письменное подтверждение независимым от изготовителя органом соответствия, установленного в нормативных документах
|методы анализа лекарственного средства
|АНД, разрабатываемый на первые промышленные серии новых лекарственных средств
|регистрационное досье на лекарственное средство
|процесс установления единой системы показателей качества и методов испытания лекарственных средств.
~Сертификат соответствия – это … .
|документ, указывающий, что продукция соответствует требованиям нормативных документов
|аналитический нормативный документ, разрабатываемый на первые промышленные (установочные) серии новых лекарственных средств
|регистрационное досье на лекарственное средство
|процесс установления единой системы показателей качества и методов испытания лекарственных средств
|документ по определению стабильности
~Общее руководство работами по сертификации лекарственных средств осуществляет … .
|Госстандарт
|предприятие- изготовитель
|фармакопейный комитет
|фармакологический комитет
|комитет фармации
~Сертификацию лекарственных средств организует и проводит … .
|аккредитованный орган по сертификации
|предприятие - изготовитель
|фармакопейный комитет
|фармакологический комитет
|комитет фармации
~Органом по сертификации лекарственных средств в Казахстане является … .
|испытательный центр РГП «Национальный центр экспертизы лекарственных средств, изделий медицинского назначения и медицинской техники»
|Министерство Здравоохранения РК
|Комитет фармации Министерства Здравоохранения РК
|фармакопейный комитет РГП «НЦЭЛС»
|фармакологический комитет РГП «НЦЭЛС»
~Обязательной сертификации подлежат … лекарственные средства.
|импортируемые
|экспортируемые
|сильнодействующие
|гомеопатичесие
|анестизирующие
~Сертификаты получают юридическую силу после … .
|присвоения им регистрационного номера Реестра
|анализа полученных результатов и документации
|проведения экспертизы
|проведения доклинических испытаний
|проведения клинических испытаний
~Комитет фармации - это … .
|ведомство МЗ РК
|отдел при НЦЭЛС
|отдел при фармакологическом комитете
|отдел при фармакопейном комитете
|экспертный орган
~Комитет фармации МЗ РК осуществляет … функции в сфере обращения лекарственных средств.
|контрольно-надзорные и реализационные
|наблюдательные
|рекомендательные
|экспертные
|сертификационные
~Управление фармацевтического контролявходит в структуру … .
|Комитета фармации МЗ РК
|Национального центра экспертизы лекарственных средств, изделий медицинского назначения и медицинской техники
|фармакопейного комитета
|фармакологического комитета
|отдела экспертных работ
~Экспертные органы МЗ РК- это … .
|фармакологический и фармакопейный центры МЗ РК