рива титрування слабої кислоти сильною основою.
екція № 13
итриметричний аналіз.
риві титрування.
План.
1.Методи кривих титрування.
2. Криві титрування сильної кислоти сильною основою.
3. Крива титрування слабої кислоти сильною основою.
Крива титрування слабої підстави сильною основою.
Для того, щоб мати можливість вибрати індикатор для титрування, окрім якісних показників, необхідно використовувати методи, що дають кількісну характеристику цього процесу. До таких методів відноситься метод побудови «кривих титрування», метод обчислення індикаторної помилки, що здійснюється при титруванні.
1. Метод «кривих титрування». При збільшенні до 0,1 н. р-ру кислоти р-ра лугу такої ж нормальності (молярній концентрації еквівалентній) відбувається зміна реакції середовища з кислої в нейтральну, а потім в лужну. Кількість підлитого р-ра лугу відповідатиме певній величині pН і кольору індикатора.
Щоб мати можливість точно вивчити цей процес і вибрати потрібний індикатор використовують графічний метод. Для цього на осі абсцисс - кількість р-на NаOH (у мл). При цьому одержуємо криву, яка характеризуватиме зміни pН залежно від об'єму (мл) підлитого р-на. Розрізняють три випадки.
рива титрування сильної кислоти сильною основою.
Для побудови кривої в конічну колбу наливають 20 мл 0,1 н. р-на HСl із бюретки додають поступово 20 мл 0,1 н. р-на NаOH. Розраховують величину pН, виходячи залежно від прилитої кількості (мл) NаOH, і по точках будують криву. Спочатку знаходять початкову точку кривої НСl = 0,1н. = 0,1 м, тому [H+] = 0,1 =10-1моль/л і pН =1. Оскільки ступінь дисоціації HСlпри C= 0,1н. дорівнюватиме 1. V NaOH= 0, тоді початкова точка кривої матиме координати X1=0, Y1=1. Потім визначимо кінцеву точку кривої (точку еквівалентності) концентрація розчину рівна 0,1 н., тому на 20 мл HCl буде витрачено 20 мл NaOH і [H+] = [OH-] = 10-7, pH=7
У р-ні буде знаходиться сіль NaСl, яка не піддаватиметься гідролізу і координати точки будуть Х=20, pН(Y)=7.
Знаючи координати початкової і кінцевої точок, приступають до розрахунку проміжних крапок. Допустимо, що в точці 3 до 20 мл 0,1 н. р-на HСlдодають 18,60 мл 0,1 н. NаOH, тоді в р-ні залишилося 2 мл HСl, тобто в 10 разів менше і тому C3 HСl=0,1/10=0,1 і pН= - lg [H+]= - lg(10-2)=2. В т.ч. підлили 19,80 мл NаOH, тобто в розчині залишилося 0,2 мл HСlтобто в 100 разів менше ніж було, тому C4 HСl=0,1/100=0,01 [H+]=10-3 pН=3. Таким чином розраховують і інші проміжні точки. За даними (таблиця.) будують криву титрування сильної кислоти сильним гідроксидом.
По кривій титрування видно, що до кінця цього титрування відбувається сильна зміна величини phр-ра і спостерігається різкий стрибок. Якщо за час нейтралізації 99,9% кислот phзмінюється поступово від 1,0 до 4,0, то при додаванні вельми невеликої кількості р-на гідроксиду Na(0,1% до точки нейтралізації і 0,1% надлишкових) pН підвищується від 4 до 10.
Остання крапля доданого лугу викликає зміни pН на 6 одиниць, а [H+] в 1*10-6 разів, тому крива на цьому відрізку займає вертикальне положення - цю вертикальну ділянку називають стрибком pН на кривій титрування. Якщо після досягнення точки еквівалентності продовжувати додавати р-н NаOH, то [H+], зменшуватиметься і крива в другій половині буде такою ж пологою, як і в першій.
Крива титрування сильної кислоти сильним лугом характерні такими особливостями:
А) точка еквівалентності лежить на лінії нейтральності;
Б) стрибок pН на кривій титрування (при 0,1 н. р-рах) має великий інтервал - від pН = 4
до pН = 10
В) при титруванні р-налугу кислотою початкова точка була б при pН=13- в нижній області графіка.
На підставі кривої титрування (для 0,1 н. р-нів HСlі NаOH) можна зробити висновок, що в цьому випадку можна застосовувати наступні індикатори: метиловий оранжевий, метиловий червоний, нейтральний червоний і фенолфталеїн, тобто такі індикатори, показники титрування pТ які знаходяться в області значення pН на кривій W.
рива титрування слабої кислоти сильною основою.
В цьому випадку для обчислення pН в точці еквівалентності ми повинні мати на увазі, що в розчині буде сіль слабої кислоти і сильної основи, яка піддаватиметься гідролізу, і тому для розрахунку застосовують формулу що враховує ці явища .
Умова титрування ідентична 1-у випадку тобто беруть 20 мл 0,1 н. р-на CH3COOH і додають 20 мл р-ра 0,1 н. NаOH. Для визначення початкової точки кривою титрування перш за все обчислюють [H+] в 0,1 н. р-наCH3COOH
[H+]2= Kкисл.*Cкисл. и [H+]= 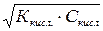
pH=1/2pKкисл. -1/2lgCкисл. pK кислоти дорівнює:
pKкисл.=-lg(1,74*10-5)= - (0,27 – 5) = 4,76
1/2pKкисл.=4,75/2=2,38
-1/2lgCкисл = - 0,5
pH=2,38+0,5=2,88
pН в точці еквівалентності в даному випадку розраховуватиметься з урахуванням явищ гідролізу CH3COONa + HOH CH3COOH + NaOHотже реакція р-на буде лужна і [OH-]=(Kводи*Ссолі)/kкисл., переходимо до значення
pН =14 - pОН =14 - (7 - pkкисл. - lgС солі.) = 7 + pkкисл. + lgСсолі.
pk= 4,76, а величина Cсолі Мінятиметься унаслідок розбавлення р-на і складу 0,1:2 тобто 0,05 а lg0,05 = lg5*10-2= - (0,7 - 2)= 1,3. Підставляючи набутих значень в основну формулу, отримуємо pН = 7+1/2 * 4,76-1/2*1,3=8,71
Для розрахунку pН в проміжних точках кривої титрування можна користуватися формулами, які служать для визначення [H+] і pН в р-рах слабих кислот і їх солей, а саме [H+]= Kкисл*Скисл/Ссолі і pН=pkкисл - lgСкисл/С солі
Допустимо, що перший раз додали 10 мл р-на NаOH, тоді кількість кислоти, що залишилась буде рівне (20-10) 10 мл, а об'єм в колбі збільшився і став 20+10, отже, концентрація кислоти
Cкисл= 0,1*(20-10) /20+10=0,03 мл/л
Концентрація солі ж стала
Cсолі= 0,1*10/30=0,03 мл/л
Підставляючи у формулу отримуємо pН=4,75- lg0.03/0,03=4,76
Тобто можна розрахувати всі потрібні проміжні крапки і побудувати криву титрування, яка характеризує наступні особливості:
а) точка еквівалентності лежить в лужній області pН=8,72
б) стрибок pН на кривій титрування невеликий від pН=8до pН=10
в) вихідна точка лежить в менш кислій зоні pН=3(2,87)
CH3COONa дає при гідролізі слаболужну середу, і тому точка еквівалентності не збігається з лінією нейтральності. Отже для данного випадку можна застосувати індикатор ф/ф pТ якого дорівнює 9.
Крива титрування слабої основи сильною кислотою
При титруванні слабої основи р-на аміаку у воді сильною кислотою для наочності беруть 20 мл 0,1 н. слабої основи і додають з бюретки 0,1 н. р-р HСl. Необхідно відзначити, що в бюретці буде кислота, а в колбі (для титрування) р-н NН4ОН, крива титрування піде від низу до верху, оскільки початкова точка лежатиме при pН =10,62 р-на NН4ОН.
Точка еквівалентності відповідатиме pН солі, утвореної слабою основою і сильною кислотою, і отже, лежатиме в кислому середовищі. (гідроліз)
Розрахунок початкової, кінцевої і проміжної точок буде ідентичний другому випадку. На основі цих даних аналогічним методом будують криву.
Аналізуючи характер кривої, можна зробити виводи:
1) точка еквівалентності розташована в слабокислому середовищі (pН=5)
2) початкова точка лежить в лужному середовищі
3) стрибок pН на кривій титрування від pН=4 до pН=6,2
В даному випадку для титрування можуть бути застосовані індикатори, інтервал pН яких лежить в зоні стрибка кривої титрування, а саме червоний метиловий (pТ=5,5), метиловий оранжевий (pТ=4,0)
Титрування слабих основ слабими кислотами не застосовують, оскільки воно неможливе, що і підтверджує відсутність стрибка на кривій.
Багатоосновні кислоти іонізують по ступенях. Для сильних кислот ступінчаста іонізація не відбивається на характері кривих титрування.
Криві титрування їх ідентичні кривим титрування одноосновних кислот. При титруванні слабих багатоосновних кислот Для каждой ступеня іонізації на кривій титрування визначається своя точка еквівалентності, яка характеризується головним перегином. Якщо перегини різко вимальовувалися, то можна визначити точку еквівалентності.
Вибір індикатора. Перш ніж приступити до титрування необхідно розрахувати величину pН, при якій треба закінчити титрування. Визначається pН в точці еквівалентності і знаючи pН зміну забарвлення індикатора, підбирають відповідний індикатор метода нейтралізації.
Індикаторні помилки титрування - погрішність, яка викликається при неспівпаданні показника титрування і використовуваного індикатора з величиною pН в точці еквівалентності.
Із-за цієї погрішності аналізований р-н або перетитровивають, або недотитровують, тому після закінчення титрування суміш містить вільні іони H+ або OH-. Розрізняють декілька типів індикаторнихпомилок.
Воднева помилка титрування обумовлюється наявністю в р-ні надлишку іонів водню. Це може бути або в результаті недотитуваннясильної кислоти сильним лугом, або внаслідок перетитруваннясильної основи сильною кислотою.
Гироксильна помилка може бути 2-х видів:
OН-нед- помилка і OH-пер- помилка.
Кислотна помилка титрування обумовлюється наявністю в р-ні нейтральних молекул слабої кислоти. Основна помилка титрування викликається присутністю в р-ренейтральних молекул слабої підстави:
Вирішення задач:
Завдання 1:Чому дорівнює молярна маса еквіваленту KMnO4 в наступній реакції:
Cr2(SO4)3+ 2 KMnO4+ 8KOH = 2K2CrO4+ 2MnO2+ 3K2SO4+ 4H2O
Рівняння полуреакції :
MnO4-+ 2H2O + 3e-= MnO2+ 4OH-
Mэ KMnO4= M KMnO4/ 3 = 158,04 / 3 = 52,68 г
Задача 2. На титрування 2,025 г Na2C2O4 24,10 мл р-на KMnO4. Розрахувати: а) титр р-на KMnO4б) титр KMnO4по Na2C2O4в) нормальність KMnO4.
TKMnO4/ Na2C2O4= mNa2C2O4/ V KMnO4= 2,025 / 24,10 = 0,08403 г/мл
CэKMnO4= (T KMnO4/ Na2C2O4* 1000) / H2Na2C2O4= 0,08403 * 1000 / 67 = 1,254 моль/л
поскольку С2O4-= 2CO2+ 2e-
MэNa2C2O4= M Na2CO4/ 2 = 134 / 2 = 67,00
т.к. MnO4-+ 8H++ 5e-= Mn2++ 4H2O
MэKMnO4= MKMnO4/ 5 = 158,038 / 5 = 31,61 г
T KMnO4= (CэKMnO4* MэKMnO4) / 1000 = (1,254 * 31,61 / 1000) = 0,03964 г/мл