рекалликреин и калликреин плазмы крови
Прекалликреин - предшедственник калликреина плазмы крови является гликопротеином, представленным одной пептидной цепью, состоящей из 619 аминокислотных остатков. Концентрация прекалликреина в плазме крови составляет 295 - 580 нM (35 - 50 мкг/мл) [25, 26]. Синтезируется прекалликреин в гепатоцитах. Ген, кодирующий прекалликреин, состоит из 15 экзонов и 14 интронов, локализованных в дистальной части хромосомы 4 [27].
Модель первичной и доменной структуры плазменного прекалликреина показана на рис. 3.
Прекалликреин активируется путем расщепления единственной связи Арг - 371: Иле - 372, катализируемого активными формами фактора XIIа свертывания крови (aXIIa и bXIIa) [27], с образованием легкой и тяжелой цепей, связанных одной дисульфидной связью [28]. Легкая цепь содержит каталитический домен, типичный для сериновых протеиназ. Тяжелая цепь состоит из 4-х повторяющихся доменов, в значительной мере гомологичных доменам фактора XI гемокоагуляции. Тяжелая цепь имеет участки связывания ВМК и фактора XII, а так же центр, взаимодействующий с нейтрофилами. Используя конкурентное связывание усеченных пептидов, Colman et. al. [29] показали, что на прекалликреине два отдельных участка на доменах А1 и А4 связываются с D6 ВМК. Изучена аминокислотная последовательность, а так же вторичная структура участков связывания на прекалликреине и ВМК и их взаимодействие. Исследования были выполнены с использованием кругового дихроизма и инфракрасной и флуоресцентной спектроскопии, калиброванных по множеству пептидов и белков известной вторичной структуры и специфических длин волн, определяющих известные вторичные структуры. Найдено, что ВМК и прекалликреин (в соотношении 1:1) образуют комплекс, при этом последовательность ВМК из 31 аминокислотного остатка домена D6 связывается с доменом А1 прекалликреина N-концевой частью, а С-концевая область этого участка ВМК взаимодействует с доменом А4 прекалликреина. Зоны связывания на ВМК и прекалликреине видны на рис.2 и 3 (затемненные участки).

Рисунок 3.
Первичная и доменная структура прекалликреина плазмы крови человека (по [17] с изменениями). Четыре "яблоковидных" домена обозначены как А1, А2, А3 и А4. Стрелка указывает на связь, расщепляемую активной формой фактора XII гемокоагуляции (XIIа) при активации прекалликреина. Звездочками отмечена каталитическая триада, характерная для сериновых протеиназ (Гис - 415, Асп - 464 и Сер - 559). Остатки аспарагинов (108, 289, 377, 434 и 475), отмеченные звездочками, связаны с углеводными цепями. Затемненные участки в доменах А1 и А4 - места связывания ВМК.
Образовавшийся после активации прекалликреина калликреин обладает широким спектром регулирующих функций. Он катализирует гидролиз двух пептидных связей в ВМК, указанных на рис.4, при этом освобождается брадикинин, который в свою очередь контролирует множество физиологических и патогенетических процессов.
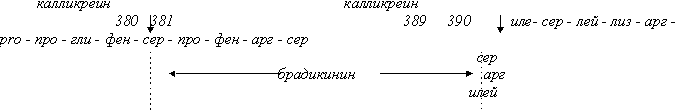
Рисунок 4.
Расщепление ВМК плазменным калликреином с освобождением брадикинина.