Робота 3. Розрахувати ДР запропонованої викладачем солі.
Заняття 7
Тема: Гідроліз солей. Умови утворення і розчинення осадів.
Актуальність теми: Гідролізом називають реакції взаємодії речовин з водою, які приводять до утворення слабодисоціованих речовин або важкорозчинних продуктів. Гідроліз має велике значення для багатьох процесів, що відбуваються у живих організмах. Так, біологічна роль деяких солей, що входять до складу крові (NaHCO3 і Na2HPO4) полягає, головним чином, в підтримці постійності реакції середовища. Завдяки цьому реакція середовища крові здорової людини лише незначно коливається відносно середнього значення рН = 7,36. Без гідролізу неможливе засвоєння в організмі харчових продуктів. Тому необхідно знати механізм процесу гідролізу і умови його протікання. Важливе значення мають процеси утворення і розчинення осадів. Відомо цілий ряд патологій, які викликані саме цими процесами в кровоносних судинах і в багатьох органах. Знання умов утворення і розчинення осадів сприяють розумінню і успішному лікуванню багатьох порушень в організмі.
Навчальні цілі:
Знати: склад солей, умови протікання реакцій гідролізу і його продукти, умови утворення і розчинення осадів, добуток розчинності (ДР).
Вміти: визначити середовище реакції гідролізу, розрахувати розчинність і визначити вплив йонів на розчинність.
Самостійна поза аудиторна робота студентів.
1. Типи солей, в залежності від їх складових: катіона і аніона.
2. Гідроліз солей, утворених катіонами слабких основ і аніонами слабких кислот.
3. Чинники, які сприяють посиленню і ослабленню гідролізу.
4. Роль процесу гідролізу в організмі людини.
5. Умови утворення осадів.
6. Умови розчинності осадів.
Контрольні питання:
1. Записати математичний вираз добутку розчинності (ДР) для хромата Аргентума (Ag2CrO4), гідроксиду магнію Mg(OH)2 , фосфату барію Ba3(PO4)2/
2. Яка із наведених солей піддається гідролізу:
а) NaCl; б) Pb(CH3COO)2 в) KNO3 г) Na2SO4
3. Яка з наведених солей не піддається гідролізу:
а) NaCl; б) Pb(CH3COO)2 в) Na2СO3 г) NН4Cl.
4. Обчислити ДР солі, якщо відомо, що в насиченому розчині AgСl при 250С міститься 1,86*10-3 г солі в 1 л.
Самостійна робота на занятті.
Виконати лабораторні роботи.
1. Визначити значення рН середовища при гідролізі солей.
2. Вивчити вплив температури на процес гідролізу.
3. Розрахувати ДР запропонованої викладачем солі.
Методика виконання роботи.
Робота1. Визначити значення рН середовища при гідролізі солей.
В окремі пробірки внести по декілька кристаликів солей: 1) хлориду амонію; 2) карбонату натрію; 3) ацетату натрію; 4) хлориду натрію; 5) нітрату плюмбуму.
В кожну пробірку влити по 0,5 мл води і 2 краплі універсального індикатора (або шматочок паперового універсального індикатора). Зафіксувати значення рН середовища у розчині кожної з пробірок, зрівнюючи забарвлення з еталоном. Результати записати у протокол. Для кожної солі скласти рівняння реакції гідролізу: молекулярні і йонні (повні і скорочені). Зробити висновок.
Робота 2. Вивчити вплив температури на процес гідролізу.
В пробірку налити 2 мл розчину ацетату натрію з концентрацією 0,1 моль/л і додати 2-3 краплі індикатора фенолфталеїну. Звернути увагу на забарвлення розчину. Розчин нагріти до кипіння. Що спостерігається? Обережно охолодити пробірку в холодній воді. Зробити висновок про вплив температури на процес гідролізу.
Робота 3. Розрахувати ДР запропонованої викладачем солі.
Кожна ланка (2-3 студентів) одержує від викладача завдання розрахувати ДР конкретної солі [AgCl, Ag2CrO4, BaSO4, Ca3(PO4)2, Mg(OH)2, CaCO3, Fe(OH)3, CaSO4] за наступною схемою:
а) записати рівняння реакції дисоціації:
AgCl Ag+ + Cl-
тверда фаза насичений розчин
б) рівняння константи рівноваги:
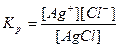
в) враховуючи, що тверда фаза не входить у рівняння константи рівноваги, тоді дістанемо:
Ks = [Ag+][Cl-]
У насиченому розчині малорозчинного електроліту при певній температурі добуток молярних концентрацій йонів є величиною сталою. Цю константу називають добутком розчинності.
ДР(AgCl) = Ks = [Ag+][Cl-]
Якщо відомо, що концентрація насиченого розчину AgCl при 250С 1,86*10-3 г в 1 л, то визначаємо молярну концентрацію розчину:
М(AgCl) = 143,3 г/моль 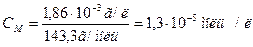
Із кожного моль AgCl маємо 1 моль/л [Ag+] і 1 моль/л [Cl-]
Тоді добуток розчинності:
ДР(AgCl) =(1,3*10-5)2 = 1,78*10-10 моль2/л2
Якщо записувати для електроліту у загальному вигляді.
AmBnmA++ nB-
ДР(AmBn) = [A+]m[B-]n
За даною схемою розрахувати ДР для запропонованої вам солі і зробити відповідний висновок.