Calcii chloridum. Кальция хлорид. CaCl2 6H2O
Подлинность.
1. Соли магния образуют с раствором натрия фосфата в присутствии аммония хлорида белый кристаллический осадок магний-аммоний фосфата, растворимый в кислоте уксусной:
MgSO4 + Na2HPO4 + NH3 MgNH4PO4 + Na2SO4
2. Реакция на SO42- . Сульфаты с растворимыми солями бария дают белый осадок нерастворимый в кислотах и щелочах:
MgSO4 + BaCl2 BaSO4 + MgCl2
Количественное определение.
Общим методом количественного определения лекарственных веществ группы магния и кальция является комплексонометрия. стандартный раствор – раствор этилендиаминтетраацетата в виде динатриевой соли (ЭДТА). Ионы металлов образуют с ЭДТА прочные бесцветные комплексы в соотношении 1:1. Индикаторы, применяемые в данном методе образуют с ионами металлов комплексы, окрашенные в иной цвет, чем сами свободные индикаторы.
Условия определения: стандартный раствор – раствор ЭДТА; индикатор – эриохром черный Т; аммиачный буферный раствор, рН 9,5 – 10,0. К навеске препарата, растворенной в воде, добавляют аммиачный буферный раствор и индикатор. Около 1% ионов Mg2+ связывается с индикатором, образуя окрашенный в красный цвет комплекс:

Затем полученный раствор титруют стандартным раствором ЭДТА:
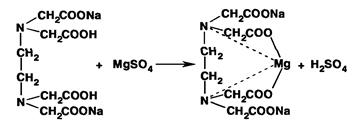
Когда все ионы Mg2+ оттитрованы, под действием ЭДТА начинает
разрушаться менее прочный комплекс металла с индикатором.
Появление окраски свободного индикатора (синей при данном значении рН 9,5 – 10,0) покажет конец титрования.
Применение.
1. Как слабительное по 15-30 г на приём.
2. При парентеральном введении оказывает успокаивающее действие на ЦНС.
3. П/к в виде 25% раствора как спазмолитическое средство при гипертонии.
4. Для обезболивания родов применяют 25% раствор.
5. В качестве противосудорожного средства.
6. Внутрь применяют 20-25%, 35% растворы как желчегонное средство.
В случае угнетения дыхания, связанного с передозировкой, применяют внутрь 10% раствор CaCl2.
Хранение.В плотно укупоренной таре.
Calcii chloridum. Кальция хлорид. CaCl2 6H2O
Бесцветные призматические кристаллы без запаха. Очень легко растворим в воде, легко растворим в спирте. Гигроскопичен, на воздухе расплывается.
Кальций встречается в природе только в связанном виде (очень реакционноспособный)—мел, известняк, мрамор—CaCO3, доломит CaMg(CO3)2, гипс CaSO4 2H2O и т.д. Кальций играет важную роль в жизнедеятельности организма, входит в состав зубной и нервной ткани, костей, мышц, крови. Ионы кальция усиливают жизнедеятельность клеток, способствует сокращению скелетных мышц и мышцы сердца, необходим для формирования костной ткани, для свёртывания крови. При недостатке ионов кальция возникают судороги.
Получение.
Обработка мела или мрамора соляной кислотой:
CaCO3 + 2HCl CaCl2 + CO2 + H2O
Подлинность.
1. Растворы солей кальция с оксалат-ионом образуют белый осадок, нерастворимый в кислоте уксусной, растворимый в разведенных минеральных кислотах:

2. Соль кальция, смоченная кислотой хлороводородной, окрашивает бесцветное пламя горелки в кирпично-красный цвет.
3. Растворы хлоридов с серебра нитратом образуют белый творожистый осадок, растворимый в аммиаке:
Cl- + Ag+ AgCl
AgCl + 2NH3 [Ag(NH3)2]Cl