III.3. Механизм диазотирования.
Исследование механизма диазотирования было начато в конце прошлого века Е.Бамбергером и А. Ганчем и завершилось исчерпывающими исследованиями К.Ингольда (Англия), Г. Цоллингера (Швейцария) и Б.А.Порай-Кошица (СССР).
Рассмотрим в первую очередь вопрос о природе электрофильного агента диазотирования. В водном растворе сильной неорганической кислоты азотистая кислота частично протонируется с образованием нитрозацидий-катиона :

Нитрозацидий-катион очень активный электрофильный агент. Согласно кинетическим данным, этот катион в водном растворе гораздо быстрее реагирует с неорганическими анионами, присутствующими в растворе, чем с ароматическим амином.

В результате образуются новые реагенты : азотистый ангидрид, хлористый или бромистый нитрозил, которые могут быть электрофильными агентами при диазотировании в разбавленном водном растворе.
В разбавленном водном растворе серной, фосфорной, хлорной и других кислот нитрозирующим агентом является азотистый ангидрид N2O3 . При диазотировании в растворе соляной или бромистоводородной кислоты электрофильным агентом оказывается хлористый и, соответственно, бромистый нитрозил. Сама азотистая кислота представляет собой слишком слабый электрофильный агент для диазотирования ароматических аминов. В сильно кислотной среде активной частицей является, вероятно, катион H2NO2+. Наиболее активный нитрозирующий агент - нитрозилсерная кислота получается только в концентрированной серной кислоте при взаимодействии с нитритом натрия.
2 H2SO4 + NaNO2 --- O=N- OSO3H + NaHSO4 + H2O
Активность электрофильных агентов при диазотировании уменьшается в ряду :

Эти выводы хорошо согласуются с экспериментальными данными. Диазотирование в водном растворе соляной кислоты идет быстрее, чем в водном растворе серной кислоты, поскольку нитрозилхлорид более сильный электрофильный агент по сравнению с азотистым ангидридом. В свою очередь дизотирование в растворе бромистоводородной кислоты или при добавках бромид-иона идет с большей скоростью, чем в соляной кислоте.
Диазотирование всегда проводят в кислой среде, где протолитическое равновесие сильно смещено вправо.

Тем не менее диазотированию подвергается амин в виде свобoдного основания. Лимитирующей стадией всего процесса диазотирования является образование N-арилнитрозоаммония, как это предполагал Е. Бамбергер еще в 1900 году, далее следует ряд быстрых протолитических равновесий, приводящих к диазосоединению, как к конечному продукту.

На стадии (4) происходит отщепление протона от азота или кислорода, поскольку исходный катион формально является аналогом аллильного катиона. Депротонирование кислорода приводит к исходному субстрату - нитрозамину, тогда как депротонирование азота ведет к образованию конечного продукта - соли арендиазония. Соли диазония, как уже было отмечено, редко выделяют из раствора в индивидуальном виде и в большинстве случаев сразу же вводят в дальнейшие превращения. Тем не менее многие соли арендиазония с некоторыми противоионами ( PF6-, SbF6-, BF4-) нерастворим в воде и достаточно стабильны при хранении их в сухом виде в течение длительного времени. Такие соли называют стабильными формами диазосоединений или диазосолями. К ним относятся соли 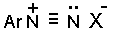 X- = PF6-, BF4-, ZnCl42- , SnCl62- и др. С сульфит- и цианид-ионами катионы жиазония образуют относительно стабильные ковалентные соединения сульфонаты Ar- N=N-SO3-Na+ и цианиды Ar-N=N-CN.
X- = PF6-, BF4-, ZnCl42- , SnCl62- и др. С сульфит- и цианид-ионами катионы жиазония образуют относительно стабильные ковалентные соединения сульфонаты Ar- N=N-SO3-Na+ и цианиды Ar-N=N-CN.