Уровни артериального давления исходно и по окончании наблюдения
К - контроль; Л - лечение; другие аббревиатуры - как в табл. 1
Таблица 3.
Сопутствующая терапия
| Препарат | Исследование (Номер в списке литературы) | Бета-блокаторы | Аспирин | Статины | Диуретики | Блокаторы кальциевых каналов |
| ARBs | IRMA-2 [20] | NA | NA | NA | NA | NA |
| RENAAL [21] | NA | NA | NA | NA | ||
| IDNT [22] | NA | |||||
| Kondo et al. [23] | ||||||
| SCOPE [24] | NA | NA | NA | NA | NA | |
| DIRECT-PREVENT-1 [17] | NA | NA | ||||
| DIRECT-PROTECT-1 [17] | ||||||
| DIRECT-PROTECT-2 [18] | ||||||
| PROFESS [26] | NA | NA | ||||
| TRANSCEND [27] | NA | NA | NA | NA | NA | |
| NAVIGATOR [28] | NA | NA | NA | |||
| ORIENT [25] | NA | |||||
| ROADMAP [29] | NA | NA | NA | NA | NA | |
| ACE-Is | Lewis et al. [33] | NA | NA | NA | NA | NA |
| AIPRI [34] | ||||||
| HOPE [1] | NA | NA | ||||
| PART-2 [5] | NA | NA | NA | |||
| SCAT [6] | ||||||
| PROGRESS [3] | NA | |||||
| QUIET [7] | NA | NA | ||||
| EUROPA [4] | NA | |||||
| PEACE [8] | NA | |||||
| CAMELOT [9] | ||||||
| DIABHYCAR [10] | ||||||
| DREAM [11] | NA | NA | NA | NA | NA | |
| IMAGINE [12] |
Сокращения как в табл. 1
Для оценки уровня риска исходов у пациентов, включенных в исследования, рассчитывался коэффициент заболеваемости (КЗ) - число новых событий на 1000 пациенто-лет для каждого проанализированного исхода в группе лечения плацебо среди пациентов, включенных в исследования ИАПФ, и в группе лечения плацебо среди пациентов, включенных в исследования БРА. Применяли следующую формулу [35]:
КЗ = (число пациентов из группы плацебо, у которых зарегистрировано событие х 1000)
число пациентов из группы плацебо х число лет наблюдения)
Синтез и анализ данных. Итоговый мета-анализ.
Отношение шансов (ОШ) влияния рандомизированного лечения на исходы было рассчитано с применением функции metan (STATA версии 11.0, StataCorp, College Station, Техас). ОШ и 95% доверительный интервал (ДИ) каждого исхода рассчитывался отдельно для каждого исследования с группировкой данных в соответствии с «намерением лечить» (intention-to-treat principle) [36, 37]. Выбор ОШ был обусловлен ретроспективным дизайном мета-анализа, проведенного на основе опубликованных исследований, которые различались по дизайну, популяции пациентов, схемам лечения, оценкам первичных исходов и качеству [38,39]. Сводные оценки влияния лечения были рассчитаны с помощью модели случайных эффектов [40]. Предположение об однородности эффектов лечения в различных исследованиях было проверено с применением Q и I2 статистик. Объединенные ОШ были логарифмически преобразованы и взвешены в обратной пропорции к дисперсии. Уровень значимости для обобщенной оценки эффекта лечения и для мета-регрессионного анализа был задан на уровне р<0,05. Только одно (первое) событие учитывалось при оценке каждого исхода.
Анализ чувствительности.
Был проведен метарегрессионный анализ с помощью команды metareg [41 ] (STATA версия 11.0) для изучения воздействия на исходы потенциального влияния модифицирующих факторов - демографических характеристик исследуемой популяции, индекса массы тела, процента пациентов с ишемической болезнью сердца, процента пациентов с СД, процента пациентов с артериальной гипертензией, значения артериального давления и изменения артериального давления от начала до конца каждого исследования, текущей терапии, продолжительности наблюдения и качества исследований [32]. Для того, чтобы учесть среднее распределение эффектов в различных исследованиях, для всех мета-регрессионных анализов была использована модель случайных эффектов. Известно, что модель случайных эффектов обеспечивает более широкие ДИ для коэффициентов регрессии, чем анализ фиксированных эффектов, если существует остаточная неоднородность [42]. Чтобы соответствовать анализу случайных эффектов, для каждого исследования определялся вес, как обратная величина суммы дисперсии внутри исследования и остаточной дисперсии между исследованиями. Для оценки tau-2 - добавочного компонента дисперсии (между исследованиями) был использован метод максимального правдоподобия с ограничениями (restricted maximum likelihood method), учитывающий возникновение остаточной неоднородности, не относящейся к влиянию потенциальных модифицирующих факторов [42]. Чтобы проверить однородность результатов, были выполнены индивидуальные мета-анализы влияния одного лекарства (кандесартана, олмесартана, телмисартана, ирбесартана, периндоприла, рамиприла и эналаприла) на каждый из исходов, если препарат был использован по крайней мере в двух исследованиях.
Систематическая ошибка, связанная с предпочтительной публикацией положительных результатов исследования.
Чтобы оценить потенциальные систематические ошибки, связанные с предпочтительной публикацией положительных результатов исследования, был использован метод взвешенной линейной регрессии с естественным логарифмом ОШ в качестве зависимой переменной и обратной величиной общего размера выборки в качестве независимой переменной. Это - модифицированный тест Macaskill, который дает более сбалансированный процент ошибок I типа в «хвостовых» областях вероятности по сравнению с другими тестами для выявления систематических ошибок, связанных с публикацией [43].
Результаты
Характеристика пациентов, включенных в исследования.
Исходные характеристики пациентов 26 исследований, включенных в мета-анализ, показаны в табл. 1 и 3. Из 108 212 пациентов в общей сложности, 53 791 были включены в исследования ИАПФ, и 54 421 - в исследования БРА. Продолжительность наблюдения была от 2 до 6,5 лет [3,68±1,11). Средний возраст пациентов в целом был 58±11 лет, и 35% пациентов были женщинами. В исследованиях ИАПФ средний возраст составил 58,3±8,3 лет, а в исследованиях БРА —57,7±13,1 лет (р=NS); 26% пациентов, включенных в испытания ИАПФ, составляли женщины по сравнению с 44% в испытаниях БРА (р<0,05) . Продолжительность наблюдения в исследованиях ИАПФ (3,66±0,90 лет) и исследованиях БРА (3,69±1,32 лет) не различалась (р=NS). У пациентов, распределенных в группу лечения плацебо в исследованиях ИАПФ и в исследованиях БРА, не выявлено достоверных различий КЗ для объединенного исхода (27 против 25 событий на 1 000 пациенто-лет, р=0,608), а также смерти от всех причин (21 против 19 событий на 1 000 пациенто-лет, р=0,898), впервые выявленной СН (7 против 6 событий на 1 000 пациенто-лет, р=0,784) и впервые выявленного СД (15 против 24 случаев на 1 000 пациентов лет, р=0,176).
Анализ исходов.
ВЛИЯНИЕ ИАПФ.
Лечение ИАПФ достоверно снижало риск объединенного исхода на 14,9% по сравнению с плацебо (ОШ: 0.830 [95% ДИ 0,744-0,927]; р сравнения=0,001, р гетерогенности=0,002) (рис. 2). Когда компоненты объединенного исхода были рассмотрены отдельно, оказалось, что снижение смертности от сердечно-сосудистых причин на 10% не достигало статистической значимости (ОШ: 0,896 [95% ДИ 0,783-1,026], р сравнения=0,112, р гетерогенности=0,087), тогда как значимо снижался риск развития ИМ на 17,7% (OШ: 0,811 [95% ДИ 0,748-0,879], р сравнения <0,001, р гетерогенности=0,438) и инсульта на 1 9,6% (OШ: 0,796 [95% ДИ 0,682-0,928], р сравнения=0,004, р гетерогенности=0,115). Кроме того, применение ИАПФ достоверно снижало риск смерти от всех причин на 8,3% (OШ: 0,908 [95% ДИ 0,845-0,975], р сравнения=0,008, р гетерогенности=0,368) (рис. 2В), впервые возникшей СН на 20,5% (OШ: 0,789 [95% ДИ 0,686-0,908], р сравнения=0,001, р гетерогенности=0,252), и впервые выявленного СД на 13,7% (ОШ: 0,851 [95% ДИ 0,749-0,965], р сравнения=0,01 2, р гетерогенности=0,069). Была выявлена значительная неоднородность исследований в отношении оценки объединенного исхода, но не для всех других исходов, изученных в процессе анализа.
Рисунок 2. Отношение шансов объединенного исхода и смерти от всех причин
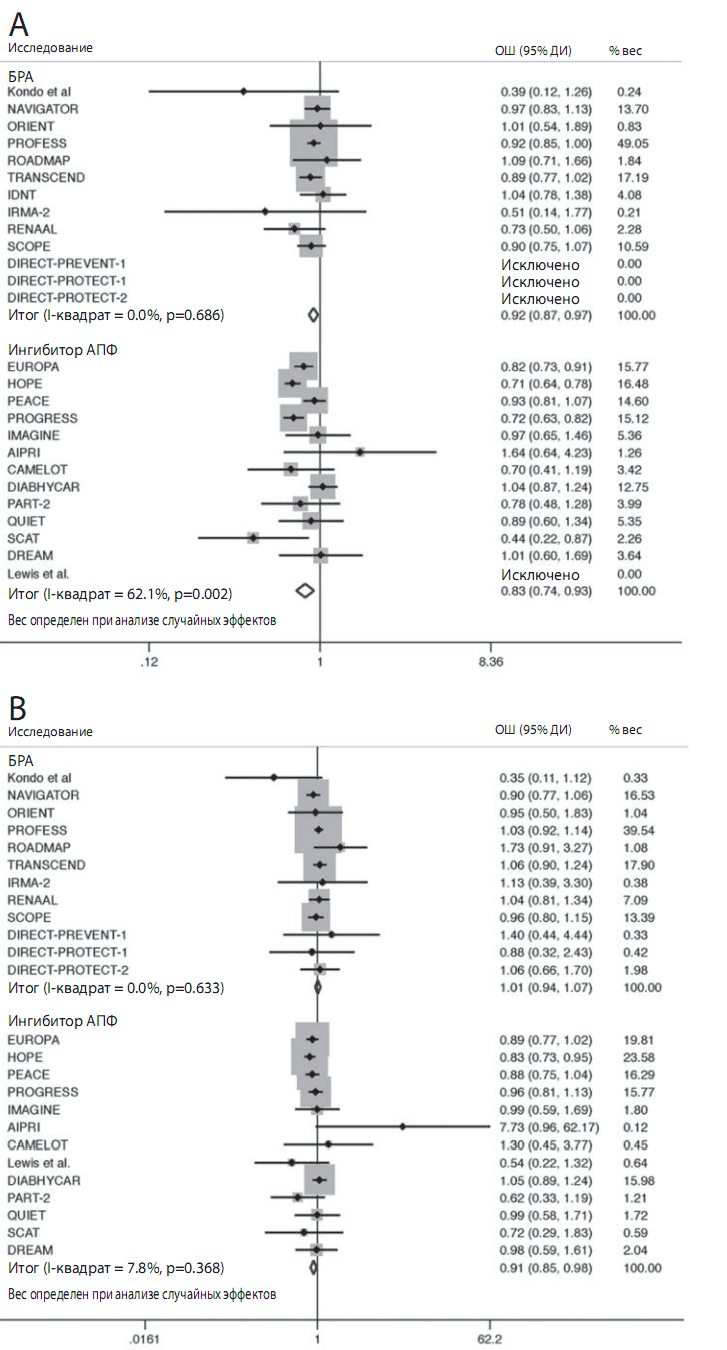
Квадраты представляют отношение шансов (ОШ) в испытаниях и имеют размер пропорциональный числу событий; 95% доверительные интервалы (ДИ) для индивидуальных испытаний обозначаются линиями; объединенные ОШ обозначены пустыми ромбами.
(A) Объединенный исход;
(B) смерть от всех причин.
ИАПФ — ингибитор ангиотензинпревращающего фермента;
БРА — блокатор рецепторов ангиотензина
Рисунок 3. ОШ и 95% ДИ влияния ИАПФ и БРА на каждый исход в сравнении с плацебо
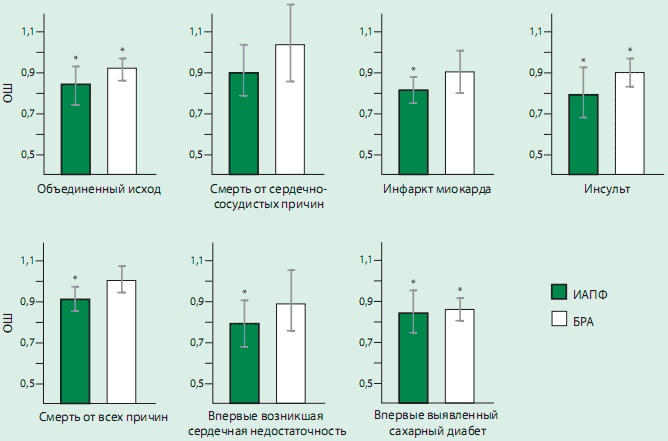
* ОШ достоверно ниже по сравнению с плацебо. Сокращения как на рис. 2
ВЛИЯНИЕ БРА.
Лечение БРА достоверно на 7,0% по сравнению с плацебо снижало риск объединенного исхода (ОШ: 0,920 [95% ДИ 0,869-0,975], р сравнения=0,005, р гетерогенности=0,686) (рис. 2). При раздельном анализе компонентов объединенного исхода оказалось, что лечение БРА не снижало риск сердечнососудистой смерти (ОШ: 1,033 [95% ДИ 0,847-1,260], р сравнения=0,748, р гетерогенности=0,01 2), тогда как выявленное снижение риска ИМ на 9,5% приближалось к статистической значимости (ОШ: 0,903 [95% ДИ 0,803-1,01 5], р сравнение=0,086, р гетерогенности=0,420. БРА достоверно снижали риск инсульта на 9,1 % (ОШ: 0.900 [95% ДИ 0,830-0,977], р сравнения=0,011, р гетерогенности=0,469) . Не было отмечено существенного влияния БРА на риск смерти от всех причин (ОШ: 1,006 [ 95% ДИ 0,941-1,075], р сравнение=0,866, р гетерогенности=0,368) (рис. 2В) и впервые возникшей СН (ОШ: 0,892 [95% ДИ 0,7611,046], р сравнения=0,159, р гетерогенности=0,188). Лечение БРА статистически достоверно снижало риск развития СД на 10,6% (ОШ: 0,855 [95% ДИ 0,798-0,91 5], р сравнения <0,001, р гетерогенности=0,819). Значительная неоднородность испытаний была выявлена только в отношении смерти от сердечно-сосудистых причин. ОШ влияния ИАПФ и БРА на изученные исходы представлены на рис 3.
Анализ чувствительности.
Результаты анализа были подтверждены при введении в мета-регрессионный анализ в качестве регрессоров потенциальных модификаторов эффекта. Кроме того, аналогично общим результатам, телмисартан (ОШ: 0,915 [95% ДИ 0,853-0,982], р=0,013), периндоприл (ОШ: 0,768 [95% ДИ 0,679-0,869], р<0,001) и эналаприл (ОШ: 0.580 [95% ДИ 0,370-0,908], р=0,017) достоверно снижали риск объединенного исхода, в то время как олмесартан (ОШ: 1,063 [95% ДИ 0,7481,509], р=0,733), кандесартан (ОШ: 0,728 [95% ДИ 0,357-1,482], р=0,381), ирбесартан (ОШ: 0,949 [95% ДИ 0,597-1,508], р=0,824) и рамиприл (ОШ: 0,861 [95% ДИ 0,661-1,122], р=0.268) не влияли достоверно на этот показатель. Результаты анализа других исходов представлены в табл. 4.
Таблица 4