Системная красная волчанка
Ревматоидный артрит
Ревматоидный артрит (РА) – это хроническое системное аутоиммунное воспалительное заболевание, характеризующееся длительным симметричным воспалением множества суставов. Это одно из наиболее распространенных ревматических заболеваний, при котором развивается пролиферация клеток синовиальной оболочки суставов, приводящее к выраженной деструкции хрящей и прогрессирующим эрозиям костной ткани.
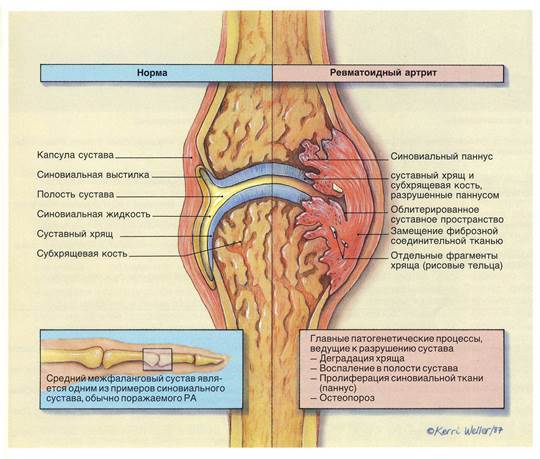
Рис. 1. Синовиальный сустав.
Слева: нормальное состояние. Справа: схематический вид воспалительных изменений, происходящих при ревматоидном артрите. (К. Веллер, Ж. Б. Хей)
РА является примером мультифакторного заболевания с генетической предрасположенностью. Оно чаще возникает при наличии определенных локусов HLA: DR1, DR4 и др., что обусловлено большей вероятностью высвобождения скрытых эпитопов в клетках. Мутации гена PTPN22, а также полиморфизм генов, ответственных за образование ФНО-, ИЛ-10 и компонентов системы комплемента могут приводить к развитию РА.
В качестве «пусковых» факторов РА могут выступать курение, инфекции, травмы, вакцинация и другие, нередко не идентифицированные факторы. Патогенетические механизмы, запускающие РА, многочисленны. Аутоиммунное повреждение суставов может быть обусловлено молекулярной мимикрией, отложением иммунных комплексов на суставных поверхностях и в стенке кровеносных сосудов, питающих сустав, изменением качественного и количественного состава T-лимфоцитов, а также изменением функциональной активности Т-лимфоцитов.
Вначале антиген-представляющие клетки (АПК) распознают экзогенные и/или эндогенные антигены. Затем АПК представляют переработанные антигены CD4+ T-лимфоцитам. Взаимодействие T-клеточного рецептора с антигеном, находящимся в комплексе с молекулами II класса главного комплекса гистосовместимости (MHC II) представляет собой 1-й сигнал, необходимый для активации CD4+. Взаимодействие ко-стимуляторных молекул (CD28-CD80/86), а так же других специфических лигандов с молекулами CD Т-лимфоцитов является 2-м сигналом. Таким образом, происходит активация CD4+ T-лимфоцитов. В дальнейшем АПК, находящиеся внутри сустава, могут продолжать активироваться. В полости сустава и периартикулярно скапливаются клетки, участвующие в развитии воспаления: T- и B-лимфоциты, плазматические клетки, дендритные клетки, тучные клетки и небольшое количество гранулоцитов. До 30-50% всех клеток воспалительного инфильтрата составляю T-лимфоциты.
Синовиальные CD 4+ T-лимфоциты дифференцируются в Th1 и Th17, образующие различный набор цитокинов. CD 4+ T-хелперы впоследствии активируют В-лимфоциты и способствуют их превращению в плазматические клетки, продуцирующие антитела. Локально образующиеся иммунные комплексы активируют систему комплимента и потенцируют воспаление. Серологическим маркером ревматоидного артрита является т.н. ревматоидный фактор, обнаружение которого в крови пациентов коррелирует с тяжестью заболевания. Ревматоидный фактор представляет собой комплекс антител класса IgM, связванных с Fc фрагметнами IgG (аутоантигеном). Образование ревматоидного фактора вызывает усиление активации системы комплемента и приводит к высвобождению лизосомальных ферментов, кининов и активных форм кислорода из лейкоцитов. T-эффекторные клетки стимулируют синовиальные макрофаги и фибробласты, заставляя их секретировать провоспалительные медиаторы, в частности, ФНО-. В дальнейшем на эндотелиоцитах кровеносных сосудов, кровоснабжающих суставы, повышается количество молекул клеточной адгезии, что стимулирует экстравазацию лейкоцитов и выход их в полость сустава. В этих условиях образуются и другие медиаторы воспаления, в частности, ИЛ-1, ИЛ-6 и гранулоцитатно-макрофагально колониестимулирующий фактор (ГМ-КСФ). ФНО- также играет важную роль в регуляции баланса между деструкцией и образованием костной ткани, так как он повышает разрушение костной ткани остеокластами и снижает активность остеобластов.
Патологоанатомическими признаками ревматоидного артрита являются синовиальное воспаление и пролиферация, фокальная эрозия костей и истончение суставных хрящей. Хроническое воспаление приводит к гиперплазии клеток синовиальной оболочки и формированию паннуса – утолщенной клеточной мембраны, состоящей из грануляционно-реактивной фиброваскулярной ткани, захватывающей нижележащей хрящ или кость.
Пациенты с ревматоидным артритом жалуются на боль, тугоподвижность или отечность суставов. Кроме того, у них выявляются различные внесуставные и системные проявления болезни.



Патогенетические основы терапии ревматоидного артрита.В лечении ревматоидного артрита используются три группы препаратов: нестероидные противовоспалительные средства (НПВС), глюкокортикоиды и противоревматические препараты, изменяющие характер течения заболевания. НПВС блокируют активность циклооксигеназы, что уменьшает синтез медиаторов воспаления – метаболитов арахидоновой кислоты. Противоревматические препараты, изменяющие характер течения заболевания, способны замедлить или предотвратить прогрессирование ревматоидного артрита. Такими препаратами являются метотрексат, сульфалазин, соли золота, противомалярийные средства, лефлуномид, азатиоприн, миноциклин. Изучение роли провоспалительных цитокинов в патогенезе ревматоидного артрита привело к созданию и клиническому использованию биологических агентов (так называемая биологическая терапия), направленных против ФНО-, ИЛ-1 и ИЛ-6. С этой целью используются моноклональные антитела, способные связывать провоспалительные цитокины, а также антагонисты рецепторов этих цитокинов. Кроме того, используются новые моноклональные антитела (анти-CD20) и различные вещества, модулирующие активность Т-лимфоцитов.
Системная красная волчанка
Системная красная волчанка (СКВ) – это системное аутоиммунное ревматическое заболевание, характеризующееся хроническим воспалительным поражением клеток множества органов и тканей, таких как кожа, суставы, почки, серозных оболочек и мозга, а также клеток крови. Чаще всего заболевание развивается у женщин репродуктивного возраста. СКВ – мультифакторное заболевание с наследственной предрасположенностью (известно более 20 различных генетических локусов) и не до конца выясненным влиянием факторов внешней среды. Генетические дефекты, затрагивающие преимущественно компоненты классического пути активации комплемента (в частности С1q, C1r, C1s, C4), являются важнейшими факторами риска развития СКВ. Классический путь активации системы комплемента обязателен для эффективного удаления клеток, подвергшихся апоптозу, макрофагами, без развития воспалительной реакции в последующем. Развитие СКВ у пациентов с данными дефектами способно привести к накоплению апоптотических телец, что впоследствии способно привести к развитию воспаления. В настоящий момент доказана связь между развитием СКВ и полиморфизмом генов, кодирующих Toll-like рецепторы. В итоге нарушается регуляция образования интерферона. Доказана связь СКВ с наличием специфических аллелей главного комплекса гистосовместимости II класса (HLA-DR2 и HLA-DR3). Факторы внешней среды (лекарственные препараты, вирусные инфекции, ультрафиолетовое излучение, курение) зачастую выступают в роли «триггеров», однако механизмы развития заболевания остаются не до конца выясненным.
Пусковым событием при СКВ является нарушение процессов апоптотической гибели клетки вследствие структурной модификации различных белков клетки (нуклеосомальных протеинов, рибонуклеопротеинов, другие нуклеопротеинов, цитоплазматических белков, таких как рибосомальный протеин P, Ro), а также белков, связанных с фосфолипидами клеточных мембран и анионных фосфолипидов на поверхности выпячивающейся клеточной мембраны. Впоследствии эти вещества могут выступать в роли аутоантигенов. Уменьшенное поглощение клеток, подвергшихся апоптозу, макрофагами (например, при дефиците С1q системы комплемента) приводит к распознаванию молекул, находящихся на поверхности апоптотических телец, АПК. При наличии сопутствующего локального повреждения и воспаления образуются дополнительные антигены, способствующие амплификации аутоиммунных процессов при СКВ.
Кооперация АПК, Т- и В-лимфоцитов сопровождается усилением синтеза аутоантител. Формирование иммунных комплексов и их отложение в тканях приводит к последующей активации системы комплемента и дальнейшему развитию в них воспаления.
В зависимости от физико-химических особенностей иммунных комплексов, они способны откладываться в субэндотелиальном слое почек, суставов, кожи или связываться с молекулами на поверхности различных клеток (эритроцитов, тромбоцитов). Активация системы комплемента по классическому или по альтернативному пути) вызывает образование компонентов, поддерживающих воспаление. В этих условиях усиливается хемотаксис нейтрофилов; из активированных лейкоцитов высвобождаются протеолитические фрагменты, АФК, медиаторы воспаления, факторы свертывания крови и др.. Кроме того, происходит активация эндотелиоцитов с приобретением ими провоспалительного и протромботического фенотипа.
Клиническими симптомами СКВ являются: кожная сыпь с развитием волчаночного дерматита, имеющего вид дискоидных высыпаний в виде «бабочки» на коже лица; неэрозивный симетричный полиартрит; гломерулонефрит, нередко приводящий к развитию почечной недостаточности; гемолитическая анемия, тромбоцитопения, лейкопения, а также полисерозиты и различные неврологические проявления.
Патогенетические основы терапии СКВ.В лечении СКВ используются НПВС, глюкокортикоиды, противомалярийные препараты, и другие иммуносупрессивные препараты. Плазмаферез способен снизить количество патогенных антител и иммунных комплексов. В настоящее время также используется биологическая терапия (см. лечение ревматоидного артрита).
Составители:
к.м.н., доц. Беляева Л.Е., асс. Шилин К.А.
Литература.
1. К. Веллер, Ж. Б. Хей. Динамика патогенеза ревматоидного артрита.
2. Robbins S., Kumar V., Cotran R. Pathologic basis of disease, 8th edition.
3. Textbook of pathology. Ed. By Harsh Mohan. – 5th ed. – 2005. – P. 977.
4. Basic pathology. Cotran R.S., Kumar V., Robbins S.L., – 8th ed.
5. Интернет-ресурс: www.ncbi.nlm.nih.gov/pubmed
6. Интернет-ресурс: www.nejm.org