ПРИНЦИПЫ ПОСТРОЕНИЯ ЭЛЕКТРОННОЙ КОНФИГУРАЦИИ ЭЛЕМЕНТА
Строение атома
АТОМ (греч: atomos – неделимый) – химически неделимая нейтральная частица вещества, состоящая из положительно заряженного ядра и отрицательно заряженной электронной оболочки.
Атомное ядро – состоит из нуклонов (лат. nucleus ядро): протонов (греч. protos – первый) и нейтронов (греч. neitrum – ни то, ни другое).
Электронная оболочка – совокупность движущихся вокруг ядра отрицательно заряженных электронов.
Протон p - частица в составе ядра, имеет положительный заряд. Относительная масса 1, 0073.
Число протонов равно порядковому номеру и обозначается Z – заряд ядра.
Нейтрон n– частица в составе ядра. Не имеет заряда. Относительная масса 1,0087.
Число нейтронов (N) может меняться у атомов одного элемента.
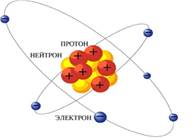
Электрон – частица в составе электронной оболочки. Имеет отрицательный заряд, равный по величине, но противоположный по знаку заряду протона. Масса электрона примерно в 2000 раз меньше массы протона и практически не влияет на массу атома.

Так как атом - электронейтральная частица, то число протонов равно числу электронов (число р = числу ):
N() = N(p) = Z
Массовое число А (относительная атомная масса) складывается из числа протонов и нейтронов в ядре данного атома.
Число нейтронов равно разности массового числа и заряда ядра.
А = N(p) + N(nº)
N(nº) = A – Z
Химический элемент – вид атомов с определённым зарядом ядра (количеством протонов).
Количество протонов неизменно, количество нейтронов может меняться.
Атомы с одинаковым зарядом ядра (количеством протонов), но разным числом нейтронов в ядре, т.е. разной массой, называются изотопами (нуклидами).


Один и тот же элемент может существовать в виде двух или нескольких изотопов. Все изотопы одного и того же элемента химически неотличимы.
Электрон — уникальная элементарная частица: обладая свойствами, отличающими его от всех других частиц, он одновременно является и частицей, и волной, т.е. имеет двойственную природу. С одной стороны, обладая малой массой, электрон проявляет свойства частицы. С другой стороны, электрон движется с такой высокой скоростью, что фактически «размазан» по атому, он находится не в одной конкретной точке, а образует «электронное облако».
Пространство вокруг ядра, в котором наиболее вероятно нахождение электрона называется электронной орбиталью.
Электроны в электронной оболочке занимают определенные уровни, подуровни, орбитали. Количество электронных уровней равно номеру периода: 1,2,3… Уровни состоят из близких по энергии подуровней (электронных оболочек).
Их обозначают символами s, p, d, f.

Подуровни состоят из одной или нескольких одинаковых по энергии орбиталей. На каждой орбитали может быть не больше двух электронов. На s-подуровне (одна орбиталь) могут находиться 2 электрона, p-подуровне (три орбитали) - 6 электронов, d-подуровне (пять орбиталей) - 10 электронов.
Элементы, у которых последним заполняется s-подуровень, называются s-элементами, p-подуровень - p –элементами,
d-подуровень - d –элементами.
В зависимости от характера заполнения электронами орбитали делятся на вакантные (без электронов), полузаселенные (1) и полностью заселенные (2).
Два электрона на одной орбитали имеют противоположные спины и называются спаренными.
При заполнении орбиталей электронами используют следующие правила:
ПРИНЦИП МИНИМУМА ЭНЕРГИИ
Орбитали заполняются в порядке увеличения энергии, снизу вверх. Каждый электрон располагается так, чтобы его энергия была минимальной, т. е. среди свободных орбиталей он выбирает орбиталь с самой низкой энергией.
Порядок заполнения энергетических подуровней (см. рис.) можно запомнить в виде ряда:
1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 5d » 4f < 6p < 7s….

ПРИНЦИП ПАУЛИ
На каждой орбитали может находиться не более двух электронов. Если два электрона находятся на одной орбитали, то они обладают противоположными спинами (стрелки направлены в разные стороны). Такие электроны называют спаренными. Если на орбитали находится только один электрон, то его называют неспаренным.

3. ПРАВИЛО ХУНДА (ГУНДА)
Атом в основном состоянии должен иметь максимально возможное число неспаренных электронов в пределах определенного подуровня.

Электронная формула атома - запись распределения электронов по орбиталям в основном (невозбужденном) состоянии атома или его ионов.
ПРИНЦИПЫ ПОСТРОЕНИЯ ЭЛЕКТРОННОЙ КОНФИГУРАЦИИ ЭЛЕМЕНТА
1) Количество электронов в атоме элемента равно его порядковому номеру.
2) Количество энергетических уровней атома равно номеру периода, в котором расположен элемент.
3) Количество электронов на внешнем (валентном) уровне равно номеру группы, в которой расположен элемент.
4) При более подробном описании электронной конфигурации рассматривают не только количество электронов на данном энергетическом уровне, но и их распределение по подуровням. Каждая незаполненная орбиталь обозначается пустым квадратиком.