Принцип действия детектора
Для определения ионов брома в речной воде, используют лабораторный твердоконтактный электрод, чувствительный только к свободный ионом брома. Как и другие часто исследуемые электролиты, активность иона брома в образцах речной воды может быть измерена с помощью системы электродов, которые являются высокоспецифичными и чувствительными к данному иону. [5]
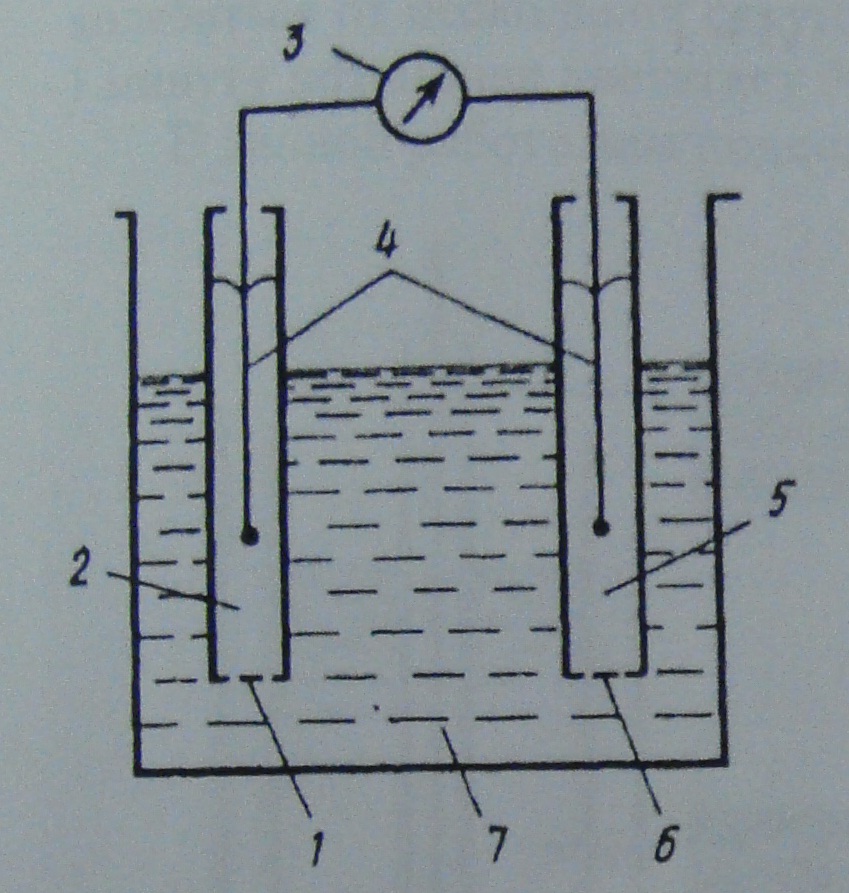
Рис. 2. Схема электрохимической ячейки
Схем ячейки с ионселективными электродами:
Селективная мембрана
2 – фторселективный электрод
3 – вольтметр
4 – вспомогательный
5 – электрод сравнения
6 – жидкостный контакт
7 – исследуемый раствор
Любая ион-селективная мембрана генерирует мембранный потенциал. Потенциал диффузии формируется неравными скоростями диффузии заряженных частиц электролита, при этом используется концепция полупроницаемой мембраны, то есть такой мембраны, которая проницаема для определенного вида ионов и ни для какого другого.
Механизм действия электрода такой же, как и у электрода для измерения рН - это механизм ионного обмена, который включает в себя прохождение через мембрану свободной фракции ионов в омывающий раствор.
Ионселективная мембрана разделяет два неорганических раствора, содержащих бром: один из них, раствор бромид калия, известного и постоянного состава называется внутренним заполняющим раствором, в который погружен хлорсеребряный электрод с серебряным покрытием (внутренний калибровочный элемент) и другой раствор - это образец, в котором необходимо измерить активность иона брома в присутствии других ионов.
Рис. 3. Устройство хлорсеребряного электрода.
Лабораторный твёрдоконтактный электрод с кристаллической мембраной для определения ионов брома. Подходит для работы с различными современными лабораторными иономерами.
Материалом мембраны является прессованный порошок Ag2S с добавлением галогенида AgBr. Мешающим действием обладают все ионы, которые могут взаимодействовать с материалом мембраны с образованием менее растворимых солей.
Электроды сравнения — электрохимические системы, предназначенные для измерения электродных потенциалов. Необходимость их использования обусловлена невозможностью измерения абсолютной величины потенциала отдельного электрода. В принципе в качестве электрода сравнения может служить любой электрод в термодинамически равновесном состоянии, удовлетворяющий требованиям воспроизводимости, постоянства во времени всех характеристик и относительной простоты изготовления.
Хлорсеребряный электрод является одним из электродов сравнения. Представляет собой серебряную пластинку, покрытую слоем малорастворимой соли серебра и опущенной в раствор хлорида калия. Потенциалоопределяющим для такого электрода является анион: хлорсеребряный электрод обратим относительно анионов хлора (Аg / АgСl, КBr).
Величина потенциала хлорсеребряного электрода зависит от активности ионов хлора; данная зависимость имеет следующий вид:

Чаще всего в качестве электрода сравнения используется насыщенный хлорсеребряный электрод, потенциал которого зависит только от температуры. Он устойчив при повышенных температурах и применим как в водных, так и во многих неводных средах.
Электрод для определения брома прекрасно подходит для исследования различных жидкостей, то есть бром-селективная мембрана пригодна для исследования жидкостей таких, как речная вода.
Внутри каждой фазы, водного раствора и мембраны, существует электронейтральность, то есть одинаковое количество положительно и отрицательно заряженных частиц. В противоположность этому, при наличии органической мембраны и неорганического раствора электролитов, уравнение заряда смещается, поскольку ионы кальция на мембране и ионы кальция в водной фазе среды могут свободно обмениваться, органофильные фосфат-ионы имеют сродство к мембране, поскольку в воде они нерастворимы и неподвижны. Толщина мембраны имеет особое значение, поскольку именно от нее будет зависеть граница разделения двух сред, и транспорт ионов кальция из водной фазы в мембрану, где ионы брома теряют свою гидрофильную оболочку и создают комплексы с органическими фосфатами. Однако, общее количество транспортированных ионов брома зависит от количества их даже в самом разведенном растворе. Ионы брома образуют комплекс с фосфороорганическими соединениями мембраны и образуют концентрационный градиент между внешними и внутренними растворами, вследствие чего на мембране образуется разность потенциалов и возникает электрический ток. Движение комплексов ионов брома через мембрану происходит до тех пор, пока на мембране не останется ни одного свободного фосфороорганическрого соединения, доступного для ионов брома. В результате этого процесса в электроде происходят необратимые изменения и его нужно заменять.

Рис. 4. Конструкция бром-селективного электрода.
Бром-селективный электрод представляет собой электрод с жидкой мембраной, предназначенный для определения ионов брома в водных растворах и биологических образцах. Используется в сочетании с соответствующим электродом сравнения. В электроде имеется сменный модуль с пластифицированной мембраной, в состав которой входит кальций-селективный ионообменник (рис. 4). При контактировании мембраны с раствором, содержащим ноны брома, на разделе фаз мембрана — раствор возникает разность потенциалов, величина которой определяется концентрацией попов кальция и исследуемом растворе. Для измерения Э.Д.С. в качестве второго полуэлемента используется электрод сравнения.
Бром-селективный электрод можно применять для прямого определения концентрации брома, если значение рНанализируемого раствора близко к нейтральному и если раствор практически не содержит реагентов. Растворение брома в воде, солевых растворах и многих органических растворителях сопровождается химическими превращениями, которые необходимо учитывать при выполнении физико-химических, аналитических или препаративных работ. Растворимость брома в растворах солей зависит от их природы и концентрации. Она особенно велика в растворах бромидов и других галогенидов, взаимодействующих с бромом с образованием комплексных полигалогенидов. Высокую растворимость брома в органических растворителях, например в галогенпроизводных и углеводородах, с которыми он смешивается в любых соотношениях, используют для его экстракции из водных растворов.
В основе аналитических применений ионоселективных электродов лежит уравнение Нернста. Однако надо отметить, что линейная зависимость между электродным потенциалом и логарифмом активности определяемых ионов выполняется не всегда. Впрочем, нарушение линейности электродной функции, учитываемое калибровкой, не препятствует использованию ионоселективных электродов, если их потенциалы хорошо воспроизводятся.
Надежность результатов определения ионов, например Вг-в смесях, зависит от величины коэффициента селективности, который является функцией соотношения подвижностей определяемого и сопутствующего ионов, а также константы равновесия ионного обмена. Он зависит не только от природы ионоселектив-ного электрода и сопутствующих ионов, но также от ионной силы анализируемого раствора.
Основными характеристиками ионоселективного электрода являются
электродная функция, селективность и время отклика. Электрод имеет
нернстовскую электродную функцию в интервале активности (концентра-
ции), где зависимость потенциала от рaA линейна и имеет угловой коэффи-
циент 59,16/zA мВ/рА (25 °С). Протяженность этого интервала зависит от
природы мембраны. При очень низких концентрациях (для электролитов с
концентрацией порядка 10–6 М) электрод теряет электродную функцию
(рис. 3); точка перегиба на графике характеризуют практическую величину
предела обнаружения.

Рис. 3. Интервал выполнения электродной функции и предел обнаружения
ионоселективного электрода
Основные узлы прибора
1. Устройство перемещения коллектора проб центрифужного типа (центрифуга) выполняет функцию по обеспечению постановки нужной кюветы на место забора пробы
2. Система забора пробы и реагентов – выполняет функцию по забору пробы и реагентов.
3. Держатель пробоотборника – фиксирует пробоотборник во время забора реагентов и анализируемых образцов и перемещает его к реакционной пробе.
4. Потенциометрическая система (бром-селективный электрод) – осуществляет непосредственный анализ.
5. Термостат – поддержание постоянной температуры (необходимой в данном методе)
6. МикроЭВМ – управление процессом анализа, а также обработка данных, полученных от детектора. На вход микроЭВМ с вольтметра поступает значение потенциала.
7. Блок мойки – промывка всей система или замена кювет.
8. Отсек для отходов