антигены тканевой совместимости
Иммуноглобулины
В работе иммунной системы огромную роль играют белки, относящиеся к суперсемейству иммуноглобулинов. Это суперсемейство включает по крайней мере три больших семейства белков, участвующих в иммунной защите организма: семейство иммуноглобулинов, семейство Т-клеточных антигенраспознающих рецепторов и белки главного комплекса гистосовместимости. это суперсемейство включено также семейство адгезивных белков, участвующих в узнавании определённых типов клеток и их межклеточных взаимодействиях. белки этого суперсемейства имеют схожие функции: иммуноглобулины взаимодействуют с чужеродными структурами, находящимися в крови, лимфе, межклеточной жидкости или секретах желёз, а рецепторы Т-лимфоцитов и белки главного комплекса гистосовместимости - с антигенами, находящимися на поверхности клеток данного организма
Успехи, достигнутые в изучении структуры иммуноглобулинов, оказались возможными благодаря установлению того факта, что каждый вид антител продуцируется отдельной популяцией клеток (клоном). Присутствующие в крови нормальных индивидов антитела являются продуктами секреции множества клонов и представляют собой сложнейшую смесь близких по структуре, но не идентичных белков. В организме человека вырабатывается около 107 клонов В-лимфоцитов, каждый из которых специализирован на выработке одного из 107 видов иммуноглобулинов.
Классы иммуноглобулинов
Иммуноглобулины М- первый класс антител, синтезирующийся в развивающихся В-лимфоцитах. Они встраиваются в плазматическую мембрану клеток и играют роль первых антиген-распознающих рецепторов. Взаимодействие антигена с рецептором на поверхности В-лимфоцита вызывает его размножение и образование целого клона лимфоцитов, происходящих из одной, стимулированной антигеном клетки. Этот клон В-лимфоцитов будет вырабатывать иммуноглобулины с одинаковыми антигенсвязывающими участками.
Когда В-лимфоциты впервые встречаются в жидкостях организма с неизвестным ранее антигеном, они синтезируют и секретируют в кровь IgM. Взаимодействие антигена с IgM изменяет его конформацию. Если антиген расположен на поверхности микроорганизма, активирование системы комплемента вызывает нарушение целостности клеточной мембраны и гибель бактериальной клетки.
Иммуноглобулины G.Иммуноглобулины IgG являются основным классом иммуноглобулинов крови. В количественном отношении IgG доминируют в крови и составляют около 75% от общего количества этих белков. Строение IgG подробно описано выше. В крови IgG обнаруживают только в мономерной форме; он секретируется активированными В-лимфоцитами в больших количествах при вторичном иммунном ответе, когда антиген повторно попадает в организм. IgG не только эффективно связывают и инактивируют чужеродные молекулы и клетки, попавшие в организм, но также облегчают их дальнейшее уничтожение.
IgG - единственный класс антител, способный проникать через плацентарный барьер и обеспечивать внутриутробную защиту плода от инфекций.
ИммуноглобулиныА. Основной класс антител, присутствующий в секретах желёз организма (слюны, молока, пищеварительного сока, секретов дыхательных путей). В сыворотке крови его содержание не превышает 10-15% от общего количества иммуноглобулинов. Образующийся при взаимодействии IgA с антигеном комплекс не взаимодействует с белками системы комплемента и фагоцитирующими клетками, но препятствует прикреплению антигенов к поверхности эпителиальных клеток и проникновению их в организм.
ИммуноглобулиныЕ. Содержание этого класса иммуноглобулинов в крови крайне мало. Белки типа IgD выполняют функцию рецепторов и имеют высокий процент связанных сахаров; их роль окончательно не выяснена. Иммуноглобулины IgE, осуществляющие в норме защиту от паразитарных инфекций, обусловливают многие аллергические реакции.
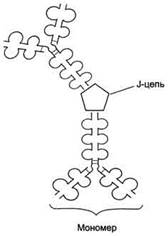
Строение димерной молекулы иммуноглобулина А
Интерфероны
В середине 30-х годов было установлено, что заражение животного каким-либо вирусом защищает его от последующего заражения другим вирусом; это явление получило название вирусной интерференции. 1957 г. английские ученые А. Айзеке и Д. Линденман впервые обнаружили белок, продуцируемый зараженными вирусом клетками, и назвали этот белок интерфероном.
Интерфероны - противовирусные агенты универсального действия. Они активны против любых вирусов, но, как правило, обладают видовой специфичностью - каждому виду животных свойствен свой интерферон. Как сейчас установлено, Интерфероны - это семейство белков, каждый со специфическим спектром деиствия. Существуют лейкоцитарные, или а-интерфероны, фибробластные, или бета-интерфероны, и, наконец, иммунные, или -гамма-интерфероны.
У каждого вида животных имеется несколько альфа-интерферонов (в частности, у человека найдено 14 различных генов альфа-интерферонов), один или несколько бета-интерферонов и всегда один гамма-интерферон.
Механизм биологического действия интерферона в общих чертах выяснен. Интерфероны синтезируются и секретируются одними клетками и проявляют свой эффект, воздействуя на другие клетки, в этом отношении они подобны гормонам.
Интерфероны - мощные противовирусные агенты. Они во все возрастающем масштабе используются в медицинской практике для лечения вирусных заболеваний, таких, как гепатит, энцефалит, бешенство, герпес и т. п. Имеются достаточно обоснованные данные об эффективности ряда интерферонов против некоторых форм рака. Интерфероны действуют в весьма небольших дозах при местном или внутримышечном применении; при этом в ряде случаев у пациентов отмечается некоторое повышение температуры. В мировой практике в настоящее время накапливается все больший опыт использования интерферонов при самых различных заболеваниях, в том числе при эпидемиях гриппа, аденовирусных инфекциях и т. п. Примечательно, что описаны случаи эффективного использования интерферонов для борьбы с вирусами не только сельскохозяйственных животных, но и многих культурных растений.
антигены тканевой совместимости
На поверхности практически всех клеток организма представлены белки, которые носят название антигенов главного комплекса гистосовместимости. Эти молекулы наиболее полно представлены именно на поверхности лейкоцитов. Каждый человек обладает индивидуальным набором антигенов тканевой совместимости.
Молекулы антигенов тканевой совместимости выполняют роль своеобразных "антенн" на поверхности клеток, позволяющих организму распознавать собственные и чужие клетки (бактерии, вирусы, раковые клетки и т.д.) и при необходимости запускать иммунный ответ, обеспечивающий выработку специфических антител и удаление чужеродного агента из организма. Синтез белков тканевой системы определяется генами главного комплекса гистосовместимости, которые расположены на коротком плече 6-й хромосомы. Антигены тканевой совместимости участвуют в распознавании чужеродной ткани и формировании иммунного ответа.
7. Защитными свойствами обладают белки свёртывающей системы крови, например фибриноген, тромбин. Они участвуют в формировании тромба, который закупоривает повреждённый сосуд и препятствует потере крови.
Белки шапероны
Аминокислотная последовательность не является единственным фактором, определяющим форму белковой молекулы. В клетке существуют специальные молекулы, которые активно участвуют в фолдинге белков.
В совокупности молекулы, участвующие в фолдинге белков, называют регуляторами фолдинга, среди которых выделяют несколько типов.
Молекулы, ускоряющие фолдинг, называются катализаторами фолдинга.
Молекулы, служащие для изменения формы белка, — шаперонами фолдинга.
Существует четыре типа молекул, которые играют роль таких шаперонов.
1. Молекулы, обеспечивающие правильный фолдинг белков (фолдинг-шапероны — folding chaperones).
2. Молекулы, созданные для удержания частично свернутой молекулы белка в определенном положении. Это необходимо, чтобы система имела возможность закончить фолдинг (удерживающие шапероны — holding chaperones).
3. Шапероны, разворачивающие белки с неправильной формой (дезагрегирующие шапероны — disaggregating chaperones).
4. Шапероны, сопровождающие белки, транспортируемые через клеточную мембрану (секреторные шапероны — secretory chaperons).
Фолдинг шапероны помогают белку принять правильную конформацию. Многие из них являются небольшими сахарами или пептидами. Представьте себе сборочную линию на производстве. Пока изделие перемещается по сборочной линии, вы можете вставлять в него некоторые временные приспособления, например скобы и заклепки, чтобы поддерживать определенную форму на протяжении нескольких этапов сборки. По окончании этих этапов удерживающие устройства можно удалить. На следующих этапах сборки вам могут понадобиться дополнительные удерживающие приспособления, которые будут удалены на выходе готового изделия. Небольшие по размеру молекулы фолдинг-шаперонов выступают в роли скоб и заклепок в сборочной линии, поддерживая изделие в правильной конфигурации, необходимой для завершения следующего этапа. Если белки приняли неправильную форму, они не будут выполнять свойственную им функцию или же будут накапливаться в виде нерастворимых агрегатов, известных под названием включений.
Внутри клетки содержится большое количество воды. Молекулы, находящиеся в ней, обычно заряжены, то есть являются гидрофильными. Незаряженные молекулы, как мы помним, гидрофобны. В длинной, линейной последовательности белка имеются гидрофильные участки, а также гидрофобные области. В водной среде клетки гидрофобные поверхности белка стремятся оказаться внутри белковой молекулы, выставляя гидрофильные участки наружу, где они могут взаимодействовать с молекулами воды. Функция небольших молекул фолдинг-шаперонов заключается во взаимодействии с гидрофобными поверхностями белка, заряжая их или, напротив, прикрывая заряженные области, что позволяет белку принять правильную форму. Путем добавления и удаления этих молекул клетка определяет, когда и каким образом гидрофобный участок белка окажется внутри белковой молекулы. Тем самым определяется форма белка (рис. 8.6).

Влияние шаперонов
Удерживающие шапероны связываются с белками, играя роль своеобразного резервуара этих белков до тех пор, пока фолдинг-шапероны не освобождаются и не начинают работу с этими белками. Удерживающие шапероны поддерживают белки в условиях химического и теплового напряжения до тех пор, пока условия внутри клетки не станут более благоприятными для правильного фолдинга белка. Это один из механизмов, который использует клетка для предотвращения неправильного фолдинга. Другой механизм связан с функционированием дезагрегирующих шаперонов. Дезагрегирующие шапероны осуществляют рефолдинг белков, фолдинг которых был выполнен неправильно. Они осуществляют в клетке важную контролирующую функцию по сбору и утилизации вторичного сырья. Несмотря на существование этих механизмов, определенный процент клеточных белков все же попадает в мусорную кучу, то есть образует нерастворимые включения. Включения видны в клетке в виде небольших плотных скоплений.
Одна из характерных черт шаперонов, которую вы нашли бы особенно важной, заключается в том, что они являются относительно неспецифичными. Иными словами, молекула шаперона будет осуществлять фолдинг более чем одного белка. Исследователи, изучающие причины неправильного фолдинга белков, случайно обнаружили в поврежденных клетках молекулы, сходные по структуре с шаперонами. Они нашли молекулы, которые исправляют последствия неправильного фолдинга белков. Исходя из универсальной природы шаперонов, вы можете вводить различные шапероны в биоинженерную систему и влиять на правильный фолдинг белка в среде, где он бы иначе не происходил. Создание специализированных шаперонов, ответственных за фолдинг рекомбинантных (биоинженерных) белков, — очень активно развивающаяся область биоинженерных исследований.
Белок можно подвергнуть фолдингу более одного раза. Представим себе белок, который предназначен для поступления в клеточную мембрану, то есть представляет собой интегральный мембранный белок. Белок образуется в цитоплазме клетки, а затем транспортируется по направлению к плазматической мембране. Такие белки проходят сквозь мембрану, закрепляются в ней и формируют на ее поверхности рецепторную структуру. Для транспорта белка может быть необходима одна его конформация, в то время как непосредственно перед встраиванием в мембрану белок подвергается рефолдингу.
В периплазматическом пространстве, то есть в пространстве между мембраной и оболочкой бактериальной клетки, находятся шапероны, обеспечивающие фолдинг и встраивание в мембрану интегральных мембранных белков. В эукариотических клетках большинство из посттрансляционных изменений белков направлено на их экспорт и встраивание внутрь плазматической мембраны. Такие модификации белков происходят в люмене эндоплазматического ретикулума и аппарате Гольджи. Эти органеллы предназначены для хранения и видоизменения белков.
В секреции белков из клетки участвует другая контролирующая система, которая включает секреторные шапероны. Секреторные шапероны узнают сигнальную последовательность аминокислот, которую соответственно называют секреторной последовательностью. Эта последовательность связывается с секреторным шапероном, шаперон поступает внутрь мембраны, обеспечивая экспорт белка вместе с собой.