Описание процесса кристаллизации и построение кривой охлаждения для сплава заданного состава.
Введение.
Исследование диаграмм состояния позволят нам подбирать оптимальные составы сплавов, получать определенные свойства для применения в тех или иных областях. При помощи диаграмм состояния можно подобрать режимы термообработки сплавов для получения определенных механических свойств. Диаграмма состояния позволяет однозначно и наглядно определять условия фазового равновесия, появления в системе новых фаз и химических соединений, образования и распада жидких и твердых растворов.
Описание процесса кристаллизации и построение кривой охлаждения для сплава заданного состава.
Графическое изображение диаграммы состояния Cu-Ce представлено на рисунке 1.
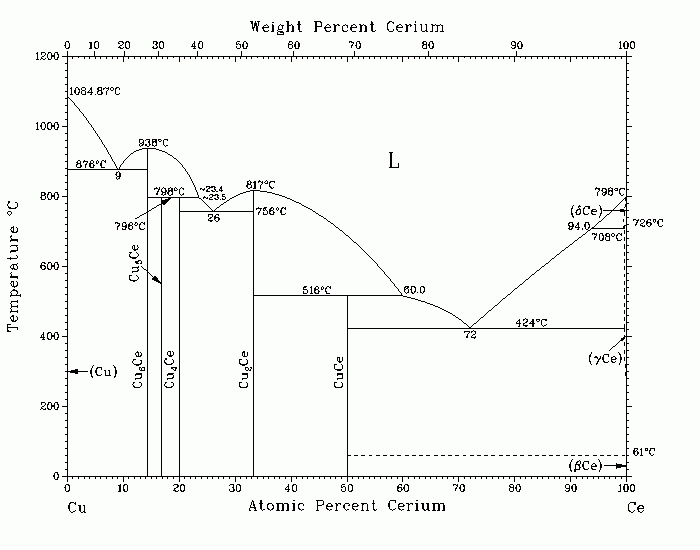
Рисунок 1. Диаграмма состояния системы Cu-Ce
2.1. Характеристика компонентов.
Cu (медь) - элемент одиннадцатой группы четвёртого периода периодической системы химических элементов. Атомная масса Cu - 63,546 а. е. м. Его температура плавления - 1 083,4 °C.
Широкое применение меди в промышленности обусловлено рядом ее ценных свойств и прежде всего высокой электрической проводимостью, пластичностью, теплопроводностью. Более 50% меди используется для изготовления проводов, кабелей, шин, токопроводящих частей электрических установок.
Соли меди (II) имеют широкое применение. Особенно важное значение имеет медный купорос-кристаллогидрат сульфата меди (II) CuS04 • 5 Н20. Медный купорос используют в производстве минеральных и органических красителей, в медицинской промышленности, для пропитки древесины в качестве антисептика (предохраняет дерево от гниения). Большое значение имеет медный купорос в сельском хозяйстве: им протравливают семена перед посевом, опрыскивают деревья и кустарники для борьбы с вредителями. Ацетат меди (II) Cu (CH3COO)2.H2O. Получается обработкой металлической меди или оксида меди (II) уксусной кислотой. Обычно представляет собой смесь основных солей различного состава и цвета (зеленого и сине-зеленого). Под названием ярь-медянка применяется для приготовления масляной краски.
Ce (церий) - химический элемент III группы 6-го периода периодической таблицы. Атомная масса - 140,115 а.е.м. Температура плавления - 799 °C. Имеет четыре модификации. Ниже 95 К существует кубическая - форма; в интервале 95-264 К - гексагональная - форма; в интервале 263-1035 К - - форма с кубической решеткой; выше 1035 К существует - форма с кубической решеткой.
В современной технике широко используют способность церия (как и других лантаноидов) модифицировать сплавы на основе железа, магния, добавления 1 % церия к магнию резко увеличивает прочность последнего на разрыв и сопротивление ползучести. Церий повышает электропроводность алюминия, меди, ниобия, титана.
Легирование конструкционных сталей церием значительно повышает их прочность. Здесь действие церия в целом аналогично действию лантана. Но поскольку церий и его соединения дешевле и доступнее лантана, значение церия, как легирующей добавки, больше.
Легирование церием алюминия резко увеличивает его прочность и электропроводность (на несколько процентов).
2.2. Типы сплавов.
На основе -Ce -модификации образуется ограниченный твердый раствор , обозначаемый как (-Ce), внедрения с максимальной растворимостью Ce в Cu, равной 0,1%.
На основе -Ce -модификации образуется ограниченный твердый раствор (-Ce) с максимальной растворимостью Ce в Cu , равной 0,37 %.
На основе -Ce -модификации образуется ограниченный твердый раствор (-Ce) с максимальной растворимостью Ce в Cu , равной 0,55 %.
На основе -Ce -модификации образуется ограниченный твердый раствор (-Ce) с максимальной растворимостью Ce в Cu , равной 0,1 %.
Растворимость Сu в твердом Се составляет 0,44; 0,31; 0,31; 0,20; 0,16 % при температурах870, 800, 500 и 300 °С, соответственно.
В системе существуют пять соединений, из которых СеСu6 и СеСu2 плавятся конгруэнтно при температурах 940 и 820 ° соответственно. Соединения СеСu, СеСu4 и СеСu5 образуются по перитектическим реакциям.
2.3. Фазовые превращения диаграммы Pb-U и линии ликвидуса и солидуса.
Фазовый состав в двухфазных областях (определяется по правилу отрезков ) записывается непосредственно на диаграмме . Линия ликвидуса обозначена пунктиром , солидуса – точками . Выше линии ликвидуса сплавы находятся в жидком состоянии , образуя жидкий раствор . При достижении линии солидуса с нагревом начинается процесс плавления и заканчивается на ликвидусе . При охлаждении от температуры ликвидуса начинается кристаллизация сплавов , которая заканчивается на линии солидуса . Между линиями ликвидуса и солидуса сплавы находятся в полужидком состоянии .
2.3.1 Нонвариантные превращения.
На диаграмме состояния имеется 6 нонвариантных трехфазных превращения.
Перитектические:
1) L + CeCu2 = CeCu (515 Cº)
2) L + CeCu5 = CeCu4 (780 Cº)
3) L + CeCu6 = CeCu5 (798 Cº)
Эвтектические:
4) L = (Ce) + CeCu (415 Cº)
5) L = CeCu2 + CeCu4 (755 Cº)
6) L = (Cu) + CeCu6 (875 Cº)
2.3.2 Моновариантные превращения
При охлаждении на линии ликвидуса из жидкой фазы начинает кристаллизоваться новая ( твердая ) фаза (определяется путем проведения изотермы в двухфазной области от точки пересечения до ближайшей линии на диаграмме ):
По линии:
| cd | de | ef | ij |
| L1(0%U)Pb3U(25%U) | L1(25%U)Pb3U(28%U) | L1(28%U)PbU(47%U) | L1(97%U)PbU(50%U) |
Температурный интервал кристаллизации находится между ликвидусом и солидусом системы и зависит от состава сплава . Исключение составляют составы эвтектических точек и состав фаз Pb3U+PbU и PbU+(U), в которых сплавы кристаллизуются при постоянной температуре 1210 и 1125 0С соответственно.
На линиях kl и lm при охлаждении начинается полиморфное превращение (U) (U) и (U) (U). На линиях jk, kl , lm происходит частичный распад твердых растворов (U), (U), (U) с выделением фазы PbU. Реакции этих фазовых превращений запишутся в виде
| jk | kl | lm |
| Т = 1125-765 (U)(100%U) (PbU)(100%U) | Т = 765-645 (U)(100%U) (PbU)(100%U) | Т = 645-0 (U)(100%U) (PbU)(100%U) |
2.4. Описание процесса кристаллизации и построение кривой охлаждения для сплава 21% Ce.
Кривая охлаждения строится в координатах « температура - время ». Количество критических точек определяется числом пересечений вертикальной линии , соответствующей составу сплава ( в нашем случае - 21 % Сe), с линиями диаграммы . В рассматриваемом сплаве таких точек 3 ( рис . 2).
При достижении ликвидуса ( точки 2) кристаллизуется новая фаза по реакции L(24%) Cu4Ce(20%) , состав которой определяется изотермой , проведенной в двухфазной области до пересечения с ближайшей линией диаграммы (рис . 2), и изменяется в соответствии с линией солидуса при охлаждении до температуры , соответствующей точке 3.
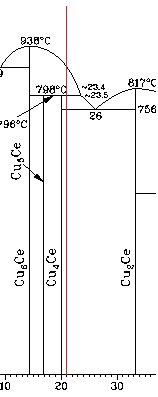
Рисунок 2. Определение состава равновесных фаз
При этом состав жидкой фазы изменяется в соответствии с линией ликвидуса в интервале температур , соответствующих точкам 1 и 3.
Используя правило фаз Гиббса рассчитаем число степеней свободы по уравнению С = К – Ф + 1.
Количество компонентов в данной системе Cu-Ce равно 2. Количество фаз определяется количеством членов фазового превращения - L и CuCe. Отсюда С = 1. Таким образом , процесс данного фазового превращения ( первичная кристаллизация ) для заданного сплава идет в интервале температур соответствующих точкам 2 и 3.
Для построения кривой охлаждения отмечаем критические точки на оси температур.
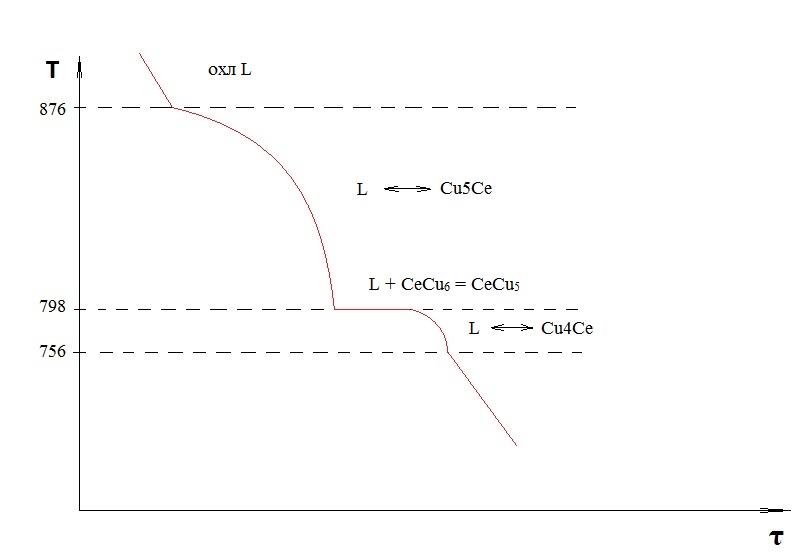
2.5. Определение соотношения фаз и структурных составляющих в сплаве при заданной температуре .
Для определения соотношения фаз и структурных составляющих необходимо воспользоваться правилом рычага . Построение рычага для сплава Сu-C производится при температуре 577 С. (рис . 3). Состояние сплава в этом случае характеризуется фигуративной точкой «к».
Условие равновесия рычага запишется в виде :
Q(Cu4Ce) · ак = Q(Cu2Ce) · кв .
Выражая величины отрезков ак и кв через концентрации соответствующих фаз в %, получим : Q(Pb3U) · (С0 – Са) = QPbU · ( Св – С0),
откуда соотношение фаз
Q(Pb3U)/ Q(PbU) = Св – С0/ С0 – Са.
Соотношение структурных составляющих определяется из условия равновесия рычага для структурных составляющих ( рис . 4, б).
Q(Pb3U) · ак = Qэвт . · кв.
Q(Pb3U) · (С0 – Са) = Qэвт . · ( Сэвт. – С0) или Q(Pb3U)/ Qэвт. = (С0 – Са)/( Сэвт . – С0).
При T=1230 0С.
Соотношение фаз:
Q(L)/Q(PbU)=(50-45)/(45-30)
Q(L)/Q(PbU)=1/3
25% L и 75% PbU.
Структурных составляющих нет.
При Т=0 0C.
Соотношение фаз:
Q(Pb3U)/Q(PbU)=(50-45)/45-25)
Q(Pb3U)/Q(PbU)=15/20
42% Pb3U и 58% PbU.
Соотношение структурных составляющих:
Q(PbU)/Qэвт.= (50-45)/(45-28)
Q(PbU)/Qэвт.=15/17
46% PbU и 54% эвтектики.
Заключение
Анализ диаграмм состояния очень важен, т.к. позволяет с точностью определять фазовый и химический состав сплавов, определять температуры фазовых переходов. При помощи диаграмм состояния можно получать сплавы с определенными физическими и механическими свойства, подбирать режимы термообработки.
Библиографический список
1. Анализ новых металлов / Элвелл В.Т., Вуд Д.Ф. - М.: Химия, 1970. - 222 с.
2. Аналитический контроль в металлургии цветных и редких металлов / Малютина Т.М., Конькова О.В. - М.: Металлургия, 1988. - 244с
3.Металлургия цветных металлов / Уткин Н.И. - М.: Металлургия, 1985. - 432с.
4. Металлургия и материаловедение: Справочник / Циммерман Р., Гюнтер К.; пер. с нем. - М.: Металлургия, 1982. - 480 с.
5. Справочник по редким металлам / под ред. К.А. Гемпела, - М.: Мир, 1965. - 931с.