Образец выполнения самостоятельной работы.
(Вопросы задания и указания даны курсивом)
Задача №1. Даны молекулы ZnCl2, SCl2 . Для каждой из молекул:
а)Полные электронные формулы атомов, образующих данные молекулы:
для атома 30Zn 1s22s22p63s23p6 3d104s2;
для атома 17Cl 1s22s22p63s23p5;
для атома 16S 1s22s22p63s23p4;
сокращенные электронные формулы атомов, образующих данные молекулы:
для атома 30Zn … 3d104s2;
для атома 17Cl … 3s23p5;
для атома 16S … 3s23p4;
Валентные, или сокращенные электронные формулы содержат тольковалентныеэлектроны (наиболее активные, которые могут участвовать в образовании химических связей).Это–все внешние электроны и электроны формирующихся подуровней.
б) значения квантовых чисел для формирующих электронов данных атомов:
Формирующим называется электрон, который завершает электронную конфигурацию данного элемента, отличает его от предшествующего в Периодической системе.
В атоме Znформирующим является 3d10электрон, для него:
- главное квантовое число n=3 (е находится на 3-м энергетическом уровне),
- орбитальное квантовое число l=2 (так как d-электрон),
- магнитное квантовое число ml может принимать значения от-l до +l, включая ноль, то есть может быть одним из значений: 2, 1, 0, -1, -2,
- спиновое квантовое число ms может принимать одно из значений: -1/2 или +1/2;
в атоме Clформирующим является3p5 электрон, для него:
- главное квантовое число n=3 (е находится на 3-м энергетическом уровне),
- орбитальное квантовое число l=1 (так как р-электрон),
- магнитное квантовое число ml принимает значения от-l до +l, включая ноль, то есть может быть одним из значений: 1, 0, -1,
- спиновое квантовое число ms может принимать одно из значений: -1/2 или +1/2;
в атоме Sформирующим является3p4 электрон, для него:
- главное квантовое число n=3 (е находится на 3-м энергетическом уровне),
- орбитальное квантовое число l=1 (так как р-электрон),
- магнитное квантовое число ml принимает значения от-l до +l, включая ноль, то есть может быть одним из значений: 1, 0, -1,
- спиновое квантовое число ms может принимать одно из значений: -1/2 или +1/2;
в) расположение валентных электронов по энергетическим ячейкам (орбиталям) атома, валентность в невозбужденном и возбужденном состояниях:
Для атома Cl :
валентность в невозбужденном состоянии В = 1 -вследствие наличия одного неспаренного электрона на внешнем р-подуровне,
валентность в возбужденном состоянииВ*= 3, 5, 7 - вследствие наличия свободных d-орбиталей на третьем энергетическом уровне и распаривания р- и s-электронов на d-подуровень:

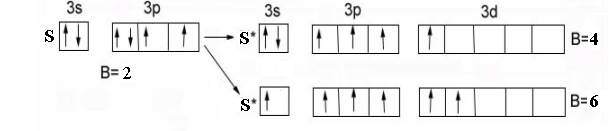
Аналогично для атома S :
валентность в невозбужденном состоянии В = 2 -вследствие наличия двух неспаренных электронов на внешнем р-подуровне,
валентность в возбужденном состоянииВ*= 4, 6 - вследствие наличия свободных d-орбиталей на третьем энергетическом уровне и распаривания р- и s-электронов на d-подуровень:
Для атома Zn:
валентность в невозбужденном состоянии В = 0 – нет внешних неспаренных электронов:
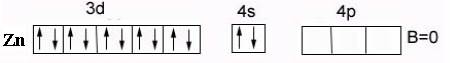
валентность в возбужденном состоянииВ*= 2 - вследствие наличия свободного 4p-подуровня и распаривания s-электронов на р-подуровень:

г) используя представления об изменении энергии ионизации и энергии сродства к электрону по периоду и подгруппе Периодической системы, охарактеризовать окислительно-восстановительные свойства элементов по отношению друг к другу:
(Для ответа следует сравнить величины электроотрицательности атомов).
Электроотрицательность ЭО - относительная величина, характеризующая способность элементов смещать к себе электроны при взаимодействии атомов друг с другом, возрастает с ростом энергии ионизации и энергии сродства к электрону. ЭО(Cl) =3,0; ЭО(S) = 2,5; ЭО(Zn) =1,6.
Слева направо по периоду энергия ионизации и энергия сродства увеличиваются, поэтому электроотрицательность хлора больше, чем ЭО серы, и его окислительные свойства выражены сильнее, чем у серы. Цинк является металлом, стоит в 4-ом периоде и во второй группе. Его энергия ионизации и сродства к электрону значительно меньше, чем у серы и хлора. Поэтому его ЭО меньше, чем у хлора и серы, окислительные свойства выражены слабее, а восстановительные сильнее, чем у названных неметаллов.
д) связь электронного строения атомов элементов с их положением в периодической системе (период, группа, подгруппа):
Положение элемента в Периодической системе однозначно определено электронным строением его атома.
Порядковый номер элемента N – совпадает с зарядом ядра и числом электронов в атоме данного элемента. Соответственно, в атоме цинка (порядковый номер – 30) 30 электронов и 30 протонов, в атоме хлора (порядковый номер – 17) 17 электронов и 17 протонов, в атоме серы (порядковый номер – 16) 16 электронов и 16 протонов.
Номер периода – совпадает со значением n (главного квантового числа) внешнего энергетического уровня атома элемента. Таким образом, элементы хлор и сера находятся в третьем периоде, внешние электроны их атомов находятся на 3-м энергетическом уровне, цинк расположен в четвертом периоде, так как внешние, валентные электроны его атома находятся на четвертом энергетическом уровне.
Номер группы – совпадает с максимальным числом валентных электронов.
Соответственно, в атоме цинка(2-я группа) –два валентных электрона , в атоме хлора (7-я группа) - 7 валентных электронов, в атоме серы (6-я группа) - 6 валентных электронов.
В главных подгруппах находятся элементы, у которых заполняется s- или
p- подуровень. Cl и S – р –элементы стоят в главных подгруппах.
В побочных подгруппах находятся элементы, у которых формируется
d-подуровень. Zn – d-элемент стоит в побочной подгруппе.
е) сокращенные электронные формулы ионов рассмотренных элементов с наиболее устойчивой степенью окисления:
для иона Zn2+ … 3d104s0;
для иона Cl- … 3s23p6;
для иона S2- … 3s23p6,для иона S6+ … 3s23p0.