Определение активной (актуальной) кислотности
Активная кислотность (актуальная) определяется дистиллированной водой при соотношении почвы к Н2О 1: 2,5 и выражается символом рН водный, рН н2о. Методика определения актуальной кислотности аналогична определению обменной кислотности(pHkCl). При этом вместо 1 н KCl применяется дистиллированная вода. Определяется обычно комбинированным раствором (колорометрически) или потенциометрически.
Данные определений актуальной кислотности применяются на практике при определении нуждаемости почв в гипсовании (регулирование щелочной реакции среды). Гипсованию, кислованию подлежат почвы, у которых значение pH водный более 7,5 (солонцовые, солонцеватые почвы).
Оборудование
Стаканчики на 100 мл, рН метр, индикаторы бумага или шкала сравнения, весы.
Реактивы
1 н раствор KCI (74,5 г KCI растворяют в 1 л Н2О, дистиллированная H2O).
Вопросы для самоконтроля
1. Символ pH- что он означает?
2. Кислотность, щелочность почв - что собою они представляют?
3. Причина и природа кислой реакции среды почв.
4. Для каких типов почв характерна кислая реакция среды?
5. Градации почв по реакции среды.
6. Какие почвы требуют известкования?
7. Чем обусловлена потенциальная (скрытая) кислотность?
8. Причина и природа щелочной реакции среды почв.
9. Какая вытяжка (солевая или водная) применяется на щелочных почвах?
10. Какие типы почв имеют щелочную реакцию среды?
11. Мероприятия по регулированию щелочной реакции среды почв.
Тест-задания
1. Значение pHKCl 5.3, реакция среды почв:
а) сильнокислая
б) среднекислая
в) слабокислая
г) близкая к нейтральной
2. Какая реакция среды характерна для выщелоченных чернозёмов
а) слабощелочная
б) нейтральная
в) близкая к нейтральной
г) слабокислая
3. pH водн. 7.8. По реакции среды этот подтип чернозёма
а) оподзоленный
б) выщелоченный
в) типичный карбонатный
г) типичный солонцеватый
4 Для светло-серых лесных почв реакция среды pHKCl в пределах:
а) 3-3.5 б) 3.6-4.1 в) 4.8-5 г) 6-7
5 Какая почва требует первоочередного известкования при значениях pHKCl
а) 5.3-5.4 б) 5.4-5.5 в) 5.6-6 г) 5.4
Тема: Определение гидролитической кислотности
Гидролитической называют вид потенциальной кислотности, которая проявляется при обработке почвы раствором уксуснокислого натрия так как при взаимодействий почвы растворами нейтральных солей не происходит полного вытеснения из состава ППК поглощенных Н+ и AI3+ .
В результате взаимодействия почвы с раствором уксуснокислого натрия образуется уксусная кислота, которая оттитровывается щелочью.
Реакция вытеснения ионов Н* и алюминия из поглощающего комплекса ионами Na протекает по следующим уравнениям:
СН3СООNa + H2O= CH3COOH+NaOH
(ППК) Н* + NaOH + СН3СООН = (ППК) Na* + Н2О + СН3СООН
Na+
(ППК) AI3+ + 3СН3СООNa = (ППК) Na+ + (СН3СОО)3AI
Na+
(СН3СОО)3AI + 3Н2О = AI(ОН)3 + 3 СН3СООН
По величине гидролитической кислотности устанавливают дозу внесения извести по формуле Д СаСО3,т/га = 0,05*dv*Hг * h, где ДСаСО3- доза извести, т/га ; dv-плотность почвы, г/см3; Hг- значение гидролитической кислотности, мг-экв на 100 гр почвы; h- мощность пахотного слоя, см.
Задание: 1. Определить значение Нг 2. Дать характеристику (оценку) 3. Сравнить значения Нг с значениями pH вод., pHсол. и скорректировать необходимость известкования или гипсования почв и рассчитать норму извести. 4. По значениям гидролитической кислотности и суммы обменных оснований рассчитать ёмкость поглощения т.е , емкость катионного обмена (ЕКО).
Ход анализа: 20 г воздушно-сухой почвы помещают в колбу и приливают 50 мл 1 н СН3СООН, встряхивают в течение 1 часа, фильтруют и 25 мл фильтрата титруют 0,1 н раствором NaOH в присутствии 2-3 капель фенолфталеин до слабо розовой окраски
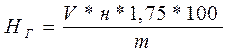 мг-экв/100 г. почвы, где
мг-экв/100 г. почвы, где
Нг – гидролитическая кислотность, мг-экв/100 г почвы
V – количество NaOH, мл (см3), израсходованного на титрование
н – нормальность NaOH
m – навеска почвы, соответствующая взятому объему фильтрата, г
1,75 – коэффициент на неполноту вытеснения Н+ и AI3+ из состава ППК
Оборудование
Колбы конические на 200-250 мл, фильтраты, воронки, взбалтыватель.
Реактивы
- 1 н СН3СООН* 3Н2О (136 г реактивы растворяют в 1 л)
- 0,1 н NaOH (4,0 г реактивы растворяют в 1 л воды)
- Фенолфталеин 1% (1 г реактивы растворяют в 100 мл раствора)