Молекулярная физика и основы термодинамики
1. Экстенсивные параметры в термодинамике, параметры (объём, внутр. энергия, энтропия и др.), значения к-рых пропорц. массетермодинамич. системы или её объёму (т. е. значение Э. п. системы равно сумме его значений для отд.частей системы).
Интенсивные параметрыв термодинамике, параметры (давление, темп-pa, концентрация и др.), не зависящие от массы системы, т.е. имеющие одинаковые значения для любой макроскопич. части однородной термодинамич. системы, находящейся в равновесии.
Удельный объём – объём, занимаемый единицей массы вещества; физическая величина, обратная плотности: если плотность равна , то удельный объём - 1/.
Давление — физическая величина, численно равная силе , действующей на единицу площади поверхности перпендикулярно этой поверхности.
Закон паскаля:давление, производимое на жидкость или газ, передается в любую точку без изменений во всех направлениях.
Температура — скалярная физическая величина, характеризующая состояние термодинамического равновесия макроскопической системы.
Термодинамическое равновесие-любая замкнутая термодинамическая система, для которой внешние условия остаются неизменными, с течением времени переходит в равновесное состояние, в котором прекращаются все макроскопические процессы.
2. Идеальный газ — математическая модель газа, в которой в рамках молекулярно-кинетической теории предполагается, что:
1)потенциальной энергией взаимодействия частиц, составляющих газ, можно пренебречь по сравнению с их кинетической энергией;
2) суммарный объём частиц газа пренебрежимо мал;
3) между частицами не действуют силы притяжения или отталкивания, соударения частиц между собой и со стенками сосуда абсолютно упруги;
4) время взаимодействия между частицами пренебрежимо мало по сравнению со средним временем между столкновениями.
Уравнение состояния идеального газа — формула, устанавливающая зависимость между давлением, молярным объёмом и абсолютной температурой идеального газа. Уравнение имеет вид:
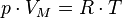
Число Авогадро - физическая величина, численно равная количеству специфицированных структурных единиц (атомов, молекул, ионов, электронов или любых других частиц) в 1 моль вещества.
Закон Бойля-Мариотта-при постоянных температуре и массе газа произведение давления газа на его объём постоянно.
Закон Шарля-давление газа фиксированной массы и фиксированного объёма прямо пропорционально абсолютной температуре газа.
Закон Гей-Люссака-при постоянном давлении, объём постоянной массы газа пропорционален абсолютной температуре.
3. Законы Дальтона:
1)Давление смеси химически не взаимодействующих идеальных газов равно сумме парциальных давлений.
2)При постоянной температуре растворимость в данной жидкости каждого из компонентов газовой смеси, находящейся над жидкостью, пропорциональна их парциальному давлению.
Парциальное давление — давление отдельно взятого компонента газовой смеси. Общее давление газовой смеси является суммой парциальных давлений её компонентов.
4. Основное уравнение МКТ:
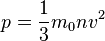 .
.
Основное уравнение МКТ связывает макроскопические параметры (давление, объём, температура) термодинамической системы с микроскопическими (масса молекул, средняя скорость их движения).
5. Закон Максвелла описывается некоторой функцией, которая называется функцией распределения молекул по скоростям. Если разбить диапазон скоростей молекул на малые интервалы, которые равны d, то на каждый интервал скорости приходится число молекул dN(), имеющих скорость, которая заключена в этом интервале. Функция f() задает относительное число молекул dN()/N, скорости которых находятся в интервале от до +d, т. е.
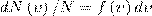
откуда

Применяя методы теории вероятностей, Максвелл получил функцию f() — закон о распределении молекул идеального газа по скоростям:
 (1)
(1)
Из (1) видно, что конкретный вид функции зависит от вида газа (от массы молекулы) и от параметра состояния (от температуры Т).
6. Средняя тепловая скорость молекул, например, которая представляет собой фактически средне-арифметическую скорость, определяется при этом формулой

Наиболее вероятная скорость молекул, соответствующая максимуму кривых, определена как

Средняя квадратичная скорость молекул — среднее квадратическое значение модулей скоростей всех молекул рассматриваемого количества газа 
7. Барометрическая формула — зависимость давления или плотности газа от высоты в поле силы тяжести. Для идеального газа, имеющего постоянную температуру и находящегося в однородном поле тяжести (во всех точках его объёма ускорение свободного падения одинаково), барометрическая формула имеет следующий вид:

Выражение (2.2.14), записанное в виде:
 (2.2.14)
(2.2.14)
называется распределением Больцмана(распределением частиц по значениям потенциальной энергии) во внешнем потенциальном поле.Из него следует, что при постоянной температуре плотность газа больше там, где меньше потенциальная энергия его молекул.
8. Расстояние, проходимое молекулой в среднем без столкновений, называется средней длиной свободного пробега. Средняя длина свободного пробега равна:

Число столкновений определяется средней скоростью движения молекул относительно друг друга.
Эффективный диаметр молекулы — минимальное расстояние, на которое сближаются центры двух молекул при столкновении.
Эффективный диаметр молекул зависит от их средних энергий, а следовательно, и от температуры: с повышением температуры эффективный диаметр молекул уменьшается.
9. Распространение молекул примеси в газе от источника называется диффузией.
В состоянии равновесия температура и концентрация во всех точках системы одинакова. При отклонении плотности от равновесного значения в некоторой части системы возникает движение компонент вещества в направлениях, приводящих к выравниванию концентрации по всему объему системы. Связанный с этим движением перенос вещества обусловлен диффузией. Диффузионный поток будет пропорционален градиенту концентрации:
 . .
|
Если какое-либо тело движется в газе, то оно сталкивается с молекулами газа и сообщает им импульс. С другой стороны, тело тоже будет испытывать соударения со стороны молекул, и получать собственный импульс, но направленный в противоположную сторону. Газ ускоряется, тело тормозится, то есть на тело действуют силы трения. Такая же сила трения будет действовать и между двумя соседними слоями газа, движущимися с разными скоростями. Это явление носит название внутреннее трение или вязкость газа, причём сила трения пропорциональна градиенту скорости:
 . .
| (3.1.1) |
Если в соседних слоях газа создана и поддерживается разность температур, то между ними будет происходить обмен тепла. Благодаря хаотическому движению, молекулы в соседних слоях будут перемешиваться и их средние энергии будут выравниваться. Происходит перенос энергии от более нагретых слоев к более холодным телам. Этот процесс называется теплопроводностью. Поток тепла пропорционален градиенту температуры:
 . .
| (3.1.2) |
10. В механике вводилось понятие числа степеней свободы: это число независимых переменных (координат), которые полностью определяют положение системы в пространстве. В некоторых задачах молекулу одноатомного газа рассматривают как материальную точку, которой задают три степени свободы поступательного движения. При этом не учитывается энергия вращательного движения.
В механике молекула двухатомного газа в первом приближении считается совокупностью двух материальных точек, которые жестко связанны недеформируемой связью. Данная система кроме трех степеней свободы поступательного движения имеет еще две степени свободы вращательного движения. Вращение вокруг третьей оси, проходящей через оба атома, лишено смысла. Значит, у двухатомного газа пять степеней свободы (i = 5). У трехатомной и многоатомной нелинейной молекулы шесть степеней свободы: три поступательных и три вращательных. Естественно считать, что жесткой связи между атомами не существует. Поэтому необходимо учитывать для реальных молекул также степени свободы колебательного движения.
Внутренняя энергия — определенная функция термодинамического состояния системы, т. е. в любом состоянии система обладает вполне определенной внутренней энергией (она не зависит от того, каким образом система пришла в данное состояние). Это значит, что при переходе системы из одного состояния в другое изменение внутренней энергии задается только разностью значений внутренней энергии данных состояний и не зависит от пути и способа перехода.
Закон Больцмана о равномерном распределении энергии по степеням свободы молекул: для статистической системы, которая находится в состоянии термодинамического равновесия, на каждую поступательную и вращательную степени свободы приходится в среднем кинетическая энергия, равная kT/2, а на каждую колебательную степень свободы — в среднем энергия, равная kT. Колебательная степень обладает вдвое большей энергией, т.к. на нее приходится как кинетическая энергия (как в случае поступательного и вращательного движений), так и потенциальная, причем средние значения потенциальной и кинетической и энергии одинаковы.
11. Первое начало термодинамики: Количество теплоты, полученное системой, идёт на изменение её внутренней энергии и совершение работы против внешних сил.
Первое начало термодинамики для изобарического процесса имеет вид: для элементарного процесса  , для конечного процесса
, для конечного процесса  , так как в ходе данного процесса изменяется температура газа и объём, следовательно, изменяется его внутренняя энергия и совершается работа.
, так как в ходе данного процесса изменяется температура газа и объём, следовательно, изменяется его внутренняя энергия и совершается работа.
Применим первое начало термодинамики к изохорическому процессу. При изохорическом процессе объём остаётся постоянным и  , следовательно, работа газа равна нулю и первое начало термодинамики имеет вид для элементарного процесса
, следовательно, работа газа равна нулю и первое начало термодинамики имеет вид для элементарного процесса  и для конечного процесса
и для конечного процесса  . Всё количество теплоты, переданное системе (или отданное системой), идёт на изменение внутренней энергии системы.
. Всё количество теплоты, переданное системе (или отданное системой), идёт на изменение внутренней энергии системы.
Применим первое начало термодинамики к изотермическому процессу, при котором температура неизменна, а, следовательно, внутренняя энергия системы не изменяется, всё полученное системой количество теплоты идёт на совершение системой макроскопической механической работы. В этом случае первое начало термодинамики имеет вид для элементарного процесса  и для конечного процесса
и для конечного процесса  . С точки зрения преобразования теплоты в механическую работу, это самый выгодный процесс.
. С точки зрения преобразования теплоты в механическую работу, это самый выгодный процесс.
12. Количество теплоты, переданное телу для изменения температуры на 1 К, называют теплоёмкостью тела. Теплоёмкость тела можно записать формулой:

Теплоёмкость единицы массы вещества называют удельной теплоёмкостью Cm . Удельная теплоёмкость измеряется в Дж/(кг.К) и выражается формулой:  (4.18)
(4.18)
Теплоёмкость одного моля вещества называют молярной теплоёмкостью  . Молярная теплоёмкость измеряется в Дж/(моль.К) и выражается формулой:
. Молярная теплоёмкость измеряется в Дж/(моль.К) и выражается формулой:  (4.19)
(4.19)
Теплоёмкость зависит от процесса передачи количества теплоты. При изотермическом процессе dT=0 , а теплоёмкость  . При изобарическом процессе
. При изобарическом процессе  . При изохорическом процессе
. При изохорическом процессе  .
.
Единица измерения теплоёмкости в Международной системе единиц (СИ) — Дж/К.
Уравнение Майера-уравнение, устанавливающее связь между теплоёмкостями при пост, давлении Cp и пост, объёме С V 1 кмоляидеального газа:  где R- газоваяпостоянная.
где R- газоваяпостоянная.
13. Реальный газ — газ, который не описывается уравнением состояния идеального газа Клапейрона — Менделеева.
Зависимости между его параметрами показывают, что молекулы в реальном газе взаимодействуют между собой и занимают определенный объём.
Потенциальная энергиямежмолекулярных взаимодействий обычно представляется как сумма энергий взаимодействия пар ближайших соседей.
14. Уравнение состояния газа Ван-дер-Ваальса — уравнение, связывающее основные термодинамические величины в модели газа Ван-дер-Ваальса.
Термическим уравнением состояния (или, часто, просто уравнением состояния) называется связь между давлением, объёмом и температурой.
Для одного моля газа Ван-дер-Ваальса оно имеет вид:

Поправка  учитывает силы притяжения между молекулами (давление на стенку уменьшается, так как есть силы, втягивающие молекулы приграничного слоя внутрь), поправка
учитывает силы притяжения между молекулами (давление на стенку уменьшается, так как есть силы, втягивающие молекулы приграничного слоя внутрь), поправка  — объем молекул газа.
— объем молекул газа.
15. Изотермы Ван-дер-Ваальса —кривые зависимости р от Vm при заданных Т, определяемые уравнением Ван-дер-Ваальса для моля газа. Эти кривые имеют довольно своеобразный характер. При высоких температурах (T > Tк) изотерма реального газа отличается от изотермы идеального газа только некоторым искажением ее формы, оставаясь монотонно спадающей кривой. При некоторой температуре Tк на изотерме имеется лишь одна точка перегиба К.
Эта изотерма называется критической, соответствующая ей температура Tк — критической температурой; точка перегиба К называется критической точкой; в этой точке касательная к ней параллельна оси абсцисс. Соответствующие этой точке объем Vк, и давление рк называются также критическими. Состояние с критическими параметрами (pк, Vк, Tк) называется критическим состоянием. При низких температурах (Т < Tк ) изотермы имеют волнообразный участок, сначала монотонно опускаясь вниз, затем монотонно поднимаясь вверх и снова монотонно опускаясь.
16. Внутренняя энергия реального газа складывается из кинетической энергии теплового движения его молекул и потенциальной энергии межмолекулярного взаимодействия.
Эффектом Джоуля — Томсона называется изменение температуры газа при адиабатическом дросселировании — медленном протекании газа под действием постоянного перепада давлений сквозь дроссель (пористую перегородку). Данный эффект является одним из методов получения низких температур.
Связь между эффектом Джоуля-Томсона и поправками уравнения Ван-дер-Ваальса:
1) a=0-не учитываем силы притяжения между молекулами, а учитываем лишь размеры самих молекул
2) b=0-не учитываем размеров молекул, а учитываем лишь силы притяжения между молекулами
Учитываем обе поправки
17. Жидкость — вещество, находящееся в жидком агрегатном состоянии, занимающем промежуточное положение между твёрдым и газообразным состояниями. Основным свойством жидкости, отличающим её от веществ, находящихся в других агрегатных состояниях, является способность неограниченно менять форму под действием касательных механических напряжений, даже сколь угодно малых, практически сохраняя при этом объём.
Физические свойства жидкости:
1) Текучесть
2) Сохранение объема
3) Вязкость
4) Образование свободной поверхности и поверхностное натяжение
5) Испарение и конденсация
6) Кипение
7) Смачивание
8) Смешиваемость
9) Диффузия
10) Перегрев и переохлаждение
11) Волны плотности
12) Волны на поверхности
13) Сосуществование с другими фазами
Поверхностное натяжение — термодинамическая характеристика поверхности раздела двух находящихся в равновесии фаз, определяемая работой обратимого изотермо-кинетического образования единицы площади этой поверхности раздела при условии, что температура, объём системы и химические потенциалы всех компонентов в обеих фазах остаются постоянными.
Смачивание — поверхностное явление, возникающее при контакте жидкости с твёрдой поверхностью в присутствии пара, то есть на границах раздела трёх фаз.
Смачивание характеризует «прилипание» жидкости к поверхности и растекание по ней (или, наоборот, отталкивание и не растекание). Различают три случая: не смачивание, ограниченное смачивание и полное смачивание.
Угол смачивания (или краевой угол смачивания) — это угол, образованный касательными плоскостями к межфазным поверхностям, ограничивающим смачивающую жидкость, а вершина угла лежит на линии раздела трёх фаз.
18. Если поверхность жидкости не плоская, а искривленная, то она оказывает на жидкость избыточное (добавочное) давление. Это давление обусловлено силами поверхностного натяжения, для выпуклой поверхности положительно, для а для вогнутой – отрицательно, давление внутри жидкости под вогнутой поверхностью меньше, чем в газе, на величину p.
Капиллярный эффект — физическое явление, заключающееся в способности жидкостей изменять уровень в трубках, узких каналах произвольной формы, пористых телах. В поле тяжести (или сил инерции, например при центрифугировании пористых образцов) поднятие жидкости происходит в случаях смачивания каналов жидкостями, например воды в стеклянных трубках, песке, грунте и т. п. Понижение жидкости происходит в трубках и каналах, не смачиваемых жидкостью, например ртуть в стеклянной трубке.