Классификация методов анестезии
Введение
Анестезиология (Анестезия + греч. Logos - учение) - область клинической медицины, изучающая вопросы подготовки больного к операции, обезболивания и управления жизненно важными функциями организма во время хирургических операций. Как самостоятельная дисциплина она сформировалась в 1940—50-х годах. Изучение боли и методов борьбы с ней — лишь одна из задач анестезиологии. На практике анестезиология решает две основные задачи: обеспечение необходимого уровня обезболивания и миорелаксации (расслабление скелетных мыщц) во время хирургических операций и травматичных, болезненных манипуляций, а также обеспечение безопасности пациента на операционном столе.
Выделяют общую анестезиологию (изучает теоретические основы общего и местного обезболивания , лекарственные средства, применяемые в анестезиологии, нарушения жизненно важных функций во время операции и методы их устранения, разрабатывает методы обезболивания и др.) и частную анестезиологию (изучает вопросы выбора метода обезболивания в зависимости от состояния больного и характера операции) . В анестезиологии используют методы исследования функций и воздействия на организм, принятые в нормальной и патологической физиологии, фармакологии, биохимии, хирургии и других отраслях медицины и смежных дисциплинах.
Специальность анестезиология - уникальна, так как требует глубокого знания многих других медицинских дисциплин, включая хирургию, внутренние болезни, педиатрию и акушерство, а также клиническую фармакологию и др. Применение новых принципов биомедицинской технологии позволяет анестезиологии оставаться быстро развивающейся специальностью.
История анестезиологии:
В папирусе Эберса (Египет, 5 век до н.э.), сообщается об использовании для обезболивания мандрагоры, белладонны, опия и алкоголя. Эти же растительные препараты применялись как самостоятельно, так в различных сочетаниях в Древней Греции, Риме, Китае, Индии.
В Египте и Сирии добивались оглушения и обезболивания путем сдавливания сосудов шеи, а так же применяли кровопускание до наступления глубокого обморока.
Местную, холодовую анестезию снегом при ампутации конечностей использовали Аурелио Саверино из Неаполя (1580-1639) и Доменик Жан Ларрей, главный хирург наполеоновской армии, (1766-1842).
В начале 19-го века японский врач Ханаока применял для обезболивания препарат, состоящий из смеси трав, содержащих белладонну, гиосциамин, аконитин.
В 19 веке, веке великих научных открытий, проблемой обезболивания занимались многие ученые. Дэви, изучая закись азота, обнаружил, что она оказывает своеобразное веселящее действие, поэтому он назвал ее "веселящим газом" и высказал предположение, что она может быть использована для обезболивания при хирургических операциях.
Англичанин Генри Хикмен (1800-1830) первым понял, что задача анестезии состоит не только в обезболивании , но и в предупреждении других вредных воздействий операции. В своих экспериментах Хикмен изучал не только обезболивающее действия различных веществ, но и их влияние на дыхание, кровообращение, заживление ран. Он применял для восстановления дыхания искусственную вентиляцию легких (ИВЛ) специальными мехами, а для восстановления работы сердца- электрический ток. Однако его предложения были отвергнуты современниками. В состоянии глубокой депрессии Хикмен скончался в 30-летнем возрасте.
Столь же трагична судьба Хораса Уэлса, который в 1844 г испытал действие закиси азота на себе. Он провел 15 успешных наркозов при удалении зубов. Однако, отсутствие знаний о клинике и механизмах действия наркоза привело к тому, что официальная демонстрация этого метода оказалась неудачной. Наркоз закисью азота на долгие годы был дискредитирован. Это типичный пример того, как неграмотное и неумелое использование ценного метода приносит не пользу, а вред. Уэлс в 1848 г. покончил жизнь самоубийством.
На два года раньше Уэлса наркоз при удалении опухоли головы применил Лонг; однако, он не оценил важности своего открытия и сообщил о нем лишь спустя 10 лет. Поэтому справедливо считать днем открытия наркоза 16 октября 1846 г., когда другой зубной врач из Филадельфии –Томас Мортон публично продемонстрировал наркоз эфиром при удалении опухоли челюсти и убедил присутствующих в том, что возможно безболезненное производство хирургических операций.
Несколько месяцев спустя эфирный наркоз стали применять в Англии и Франции, 7 февраля 1847 г.он был использован в г. Москве Ф.И.Иноземцевым
Большой вклад в анестезиологию внес Н.И.Пирогов (1810-1881). В 1847 г. он обобщил свои эксперименты в монографии по наркозу, которая была издана во всем мире. Н.И.Пирогов первым указал на отрицательные свойства наркоза, возможность тяжелых осложнений, необходимость знания клиники анестезии. В его трудах заключены идеи многих современных методов: эндотрахеального, внутривенного, ректального наркоза, спинальной анестезии.
В 1847 г. в Англии появился первый профессиональный специалист-анестезиолог Джон Сноу., в 1893 г. было создано анестезиологическое общество. Наука развивалась. Врачи стали использовать при наркозе кислород , применять различные способы для поглощения углекислого газа.
В 1904 г. С.П.Федоров и Н.П.Кравков применили внутривенный наркоз гедоналом. Они же предложили использовать комбинированный наркоз: сначала выключали сознание больного гедоналом, а далее поддерживали наркоз хлороформом. Таким образом, была устранена опасная для больного стадия возбуждения, имеющая место при мононаркозе хлороформом.
Гарольд Гриффит и Энид Джонсон в 1942 году впервые начали использовать яд кураре (в Южной Америке соком этого растения индейцы смачивали наконечники стрел для обездвиживания жертвы). Метод получил название - наркоз с мышечными релаксантами. Он революционизировал анестезиологию. Полное расслабление мышц, в т.ч. и дыхательной мускулатуры, потребовало искусственного замещения дыхания. Для этого была применена искусственная вентиляция легких (ИВЛ). Появилась возможность управлять жизненно важными функциями. Таким образом, Гриффитом и Джонсоном были положены основы современного многокомпонентного наркоза с ИВЛ, который является основным на современном этапе развития анестезиологии.
Идея местной анестезии была высказана В.К. Анрепом в 1880 г. После применения Карлом Коллером в 1881 г. кокаина для обезболивания при операции на глазу, местное обезболивание получило самое широкое распространение. Были созданы малотоксичные препараты, в первую очередь - новокаин, синтезированный Альфредом Айнхорном в 1905 г., а также разработаны различные способы местного обезболивания: инфильтрационная анестезия, предложенная в 1889 г. Реклю, проводниковая анестезия, основоположником которой были А.И. Лукашевич (1886) и M.Оберстом (1888), спинальная анестезия (А. Бир , 1897). Наиболее важную роль сыграло местное обезболивание методом тугого инфильтрата, разработанное А.В. Вишневским и его многочисленными последователями. Относительная простота и безопасность метода, возможность проведения обезболивания самим хирургом, открытие новых, более эффективных и безопасных местных анестетиков, делают его весьма распространенным и в наше время.
Благодаря развитию новых технологий наука постоянно совершенствуется. В современной анестезиологи появляются новые препараты: анестетики (ксенон, севоран, десфлюран, диприван), миорелаксанты (эсмирон, мивакрон); совершенствуются методы проведения анестезии (использование ларингеальной маски, тотальная внутривенная анестезия, предупреждающая аналгезия и.т.д.). Тем не менее, до сих пор, точно не известны нейрофизиологические механизмы наркоза. Существует ряд теорий, но ни одна из них полностью не доказана.
2. Теории наркоза:
Липоидная теория.
Согласно этой теории, предложенной Менером (1899) и Авертоном (1901), наркотические средства, хорошо растовряющиеся в липидах, избирательно накапливаются в клеточных мембранах нейронов, нарушают их проницаемость для натрия и калия и, таким образом, препятствуют возникновению потенциала действия. Отношение растворимости вещества в липоидах к его растворимости в воде является показателем наркотической силы вещества: чем больше это отношение, тем сильнее наркотическое действие. Однако ряд экспериментальных данных (наличие наркотических свойств у веществ, нерастворимых в жирах, и у инертных газов, а также отсутствие наркотических свойств у ряда веществ, плохо растворимых в липоидах и хорошо растворимых в воде) заставил подвергнуть сильному сомнению основные положения этой теории.
Протеиновая теория.
Наряду с липоидами важную роль в развитии наркотического торможения играет взаимодействие молекул общего анестетика с протеинами мембраны и протоплазмой клеток. Было показано, что растворимость хлороформа в липоидах находилась в линейной зависимости от парциального давления паров над раствором, а растворимость его в растворах белков свидетельствовала об активном поглощении паров. Это наблюдение привело исследователей к выводу, что липоиды связывают молекулы наркотического вещества, препятствуя его биологическому действию. Убедительные данные об угнетающем влиянии нерастворимых в липоидах местных анестетиков на протеины нервной клетки продемонстрировал на нервных стволах Нахмансон (1961). Эти данные хотя и свидетельствуют о важной роли протеинов мембраны в развитии наркотического торможения, но не объясняют природу процессов, приводящих к угнетению нервной клетки при действии общих анестетиков.
Термодинамическая теория:
Фергюсон (1939) предложил термодинамический принцип оценки действия наркотических веществ. Он определял термодинамическую активность как отношение парциального давления вещества в данном участке ткани к давлению паров чистого вещества при этой же температуре. Было обнаружено, что наркотические концентрации различных веществ в объемном или весовом выражении различаются гораздо значительнее, чем концентрации, выраженные в физико-химических терминах, отражающих растворимость и степень молекулярного воздействия этих веществ. Иными словами, термодинамическая активность более точно отражает количественные показатели взаимодействия наркотического вещества и нервной ткани. Однако такой подход в большей степени отражает энергетические закономерности взаимодействия молекул наркотического вещества и химических структур нервной ткани, но вряд ли позволяет вскрыть механизм изменений, происходящих в нервных клетках под влиянием наркотического вещества.
Теория водных микрокристаллов:
Химические свойства ряда ингаляционных наркотических веществ (хлороформа, циклопропана, закиси азота, флюотана, этилена, ксенона, а также азота и аргона под повышенным давлением) не позволяют им вступать в химическое взаимодействие с образованием обычных ковалентных связей. Все эти вещества, за исключением хлороформа и закиси азота, не образуют также и водородных связей. Таким образом, их действие не может быть объяснено вступлением в химические реакции с активными веществами нервных клеток. При исследовании физических свойств ряда общих анестетиков было обнаружено, что эти вещества в растворах образуют водные микрокристаллы. Однако концентрации наркотическихвеществ, вызывающие наркотический эффект, недостаточны для образования водных микрокристаллов при температуре тела. Поэтому, вероятно, должны существовать дополнительные химические вещества, стабилизирующие водные микрокристаллы. Этими веществами могут быть электрически заряженные боковые цепи белковых молекул и некоторые ионы, а возможно, и другие химические соединения, растворенные в водной фазе, способные образовывать водные микрокристаллы даже самостоятельно при температуре около 25 градусов. Молекулы общих анестетиков и боковые цепи белковых молекул, которые по отдельности образуют водные кристаллы при более низких температурах, совместно оказываются в состоянии, по мнению Полинга, образовать устойчивые водные микрокристаллы при температуре 37 градусов. Эти микрокристаллы блокируют некоторые заряженные цепи белков и некоторые ионы в растворе, препятствуя их свободному движению и взаимодействию с колебаниями электрических потенциалов клеточной мембраны. Снижение же подвижности ионов уменьшает их способность проходить через мембрану при вызываемом медиаторами изменении ее проницаемости.
Мембранная теория:
Еще в начале нашего столетия было установлено, что наркотики действуют на мембрану клетки, снижая ее проницаемость для некоторых метаболитов, образующихся в клетке. Хотя накопление метаболитов в клетке при наркозе не было подтверждено, предположение об изменении проницаемости оказалось пророческим. Эта точка зрения получила признание значительно позднее, после выдвижения основных положений мембранной теории, за разработку и экспериментальное подтверждение которой в 1963 г. была присуждена Нобелевская премия выдающимся английским физиологам Ходжкину и Хаксли.Теоретически угнетение активности нервных клеток при наркозе может быть обусловлено как деполяризацией или гиперполяризацией мембраны, так и не сопровождаться изменениями мембранного потенциала. Последние достижения мембранной теории позволяют утверждать, что функциональное состояние нервных клеток определяется проницаемостью клеточных мембран для ионов (прежде всего калия и натрия). Нарушение проницаемости, которое может сопровождаться изменениями мембранного потенциала или же без него, ведет к ухудшению функционального состояния клетки.
3. Компоненты анестезиологического обеспечения:
Современное анестезиологическое обеспечение предусматривает не только достижение наркоза у пациента, но и проведение мониторинга состояния жизненно важных функций организма, своевременное предупреждение и коррекцию возможных нарушений со стороны систем кровообращения, дыхания, ЦНС, кислотно-основного состояния, температуры тела, водно-электролитного баланса и .т.д.
Компоненты анестезиологического обеспечения:
1. Наркоз – выключение сознания у больного. Достигается с помощью препаратов - ингаляционных и неингаляционных анестетиков, транквилизаторов, нейролептиков. Уровень выключения сознания не всегда соответствует степени обезболивания. Существуют препараты, обладающие мощным гипнотическим (наркотическим) действием и слабым аналгетическим (диприван) и наоборот, с выраженным аналгетическим и слабым гипнотическим действием (кетамин).
2. Аналгезия - блокада проведения ноцицептивного (болевого) импульса на различных уровнях ЦНС (рецепторы, эфферентные нервные волокна, корешки спинного мозга, подкорковые отделы, кора головного мозга). Достигается с помощью местных и общих анестетиков, наркотических и ненаркотических аналгетиков. Является обязательным компонентом как местной, так и общей анестезии.
3. Миорелаксация – расслабление скелетной (поперечно-полосатой) мускулатуры. Достигается с помощью специальных препаратов – миорелаксантов. Миорелаксация необходима для проведения искусственной вентиляции легких (ИВЛ) и обездвиживания больного во время операции, что в значительной мере облегчает работу хирурга .
4. Нейро-вегетативная блокада – блокада вегетативных импульсов, возникающих в ответ на ноцицептивное воздействие. Повышение тонуса симпатического отдела ВНС приводит к спазму прекапиллярных сфинктеров, нарушению микроциркуляции, что может привести к развитию почечной, печеночной недостаточности в послеопрационном периоде. Повышение артериального давление во время операции может привести к нарушению мозгового кровообращения во время операции, а повышение постнагрузки на фоне тахикардии к развитию острого инфаркта миокарда. В тоже время, при некоторых операциях (холецистэктомия, ЛОР-операции, офтальмологические вмешательства), повышается активность парасимпатической ВНС, что может привести к брадикардии, вплоть до остановки сердца, гиперсаливации, бронхоспазму и т.д. Для достижения нейро-вегетативной блокады используются ганглиоблокаторы, нейролептики, альфа- и бета-адреноблокаторы, м-холинолитики, антагонисты кальциевых каналов и др. препараты.
5. Поддержание адекватного дыхания и кровообращения –
Эти мероприятия включают поддержание проходимости дыхательных путей, адекватного газообмена с помощью ИВЛ, вспомогательной вентиляции легких (ВВЛ), ингаляции кислорода, своевременное восполнение операционной кровопотери (инфузионная терапия, гемотрансфузия), поддержание сердечной деятельности при необходимости - инотропная поддержка и т.д.
6. Поддержание адекватного метаболизма и гомеостаза –
Мероприятия по коррекции водно-электролитного баланса, кислотно-основного состояния, температуры тела, контроль системы гемостаза и т.д.
Классификация методов анестезии
Формирование боли происходит в следующей последовательности:
1. Генерация (болевого) ноцицептивного импульса на уровне рецепторов;
2. Передача его по чувствительным нервам в центральную нервную систему (ЦНС) (аксоны чувствительных нервов, спино-таламический тракт);
3. Формирование нейро-эндокринного и нейро-вегетативного ответа, при достижении восходящей ноцицептивной импульсации таламуса, гипоталамуса и других подкорковых центров;
4. Формирование эмоциональной реакции на боль корой головного мозга.
Анестезия бывает местная и общая. Местная анестезия – блокада проведения ноцицептивного на уровнях от ноцицепторов до спинного мозга включительно. Общая анестезия (наркоз) – фармакологичсекое угнетение проведение болевой восходящей импульсации на уровне головного мозга (рис. 1).

Рис.1. Классификация современных методов анестезии.
Комбинированная анестезия - анестезия, достигаемая одновременным или последовательным применением разных ее методов, относящихся к одному виду анестезии (например, ингаляционная и неингаляционная).
Сочетанная анестезия - Одновременно используются методы разных видов анестезии (местной и общей).
Премедикация - медикаментозная подготовка к предстоящей операции и анестезии, преследующая несколько важнейших задач:
1) предотвращение предоперационного стресса;
2) достижение нейровегетативной стабилизации;
3) снижение реакции на внешние раздражители;
4) уменьшение секреции желез;
5) создание оптимальных условий для проявления действия общих анестетиков;
Основу премедикации составляет надёжная защита больного от
предоперационного эмоционального стресса, неизбежным следствием которого является активация симпатико-адреналовой и гипоталамо-гипофизарно-надпочечниковой систем, гипердинамические реакции кровообращения, активация дыхания и других видов метаболизма, особенно углеводного.
Мероприятия по устранению предоперационного эмоционального
напряжения следует начинать не в день операции, а по крайней мере
накануне.
Для обеспечения указанных выше основных компонентов премедикации в анестезиологии применяют несколько групп фармакологических средств: снотворные (барбитураты, бензодиазепины), психотропные средства (бензодиазепины, нейролептики фенотиазинового и бутирофенонового ряда), наркотические анальгетики, холиноблокирующие и антигистаминные средства.
Местная анестезия
Для местной анестезии используются местные анестетики. Эти препараты блокируют натриевые каналы нейронов и препятствуют формированию и проведению потенциала действия в афферентных волокнах. Двигательные волокна, покрытые более выраженным слоем миелина, менее чувствительны к местным анестетикам. Родоначальником местных анестетиков считается кокаин. В настоящее время он признан наркотическим психотропным веществом за счет своего центрального действия на ЦНС и поэтому в медицине не используется.
5.1. Классификация и фармакология местных анестетиков:
Местные анестетики можно разделить на сложные эфиры - новокаин (прокаин), ультракаин, тетракаин; и амиды: лидокаин (ксилокаин), бупивакаин (маркаин), ропивакаин (наропин), мепивакаин.
Абсорбция. Системная постинъекционная абсорбция местных анестетиков из места введения зависит от нескольких факторов, в том числе от дозы, места введения, связывания препарата с тканями, присутствия вазоконстрикторов и от физико-химических свойств препарата. Аппликации местных анестетиков на области с богатым кровоснабжением, например на слизистую трахеи, приводят к очень быстрой абсорбции и более высокому уровню препарата в крови, чем после инъекции местного анестетика в зоны с менее активным кровоснабжением, например в сухожилие. Вещества, обладающие вазоконстрикторными свойствами, например адреналин, уменьшают системную абсорбцию местных анестетиков из депо (места инъекции), снижая в нем кровоток. Кроме того, на фоне вазоконстрикторов общие токсические эффекты уменьшаются вследствие понижения концентрации анестетика в периферической крови практически в 3 раза.
Метаболизм и выведение: Амидные связи местных анестетиков гидролизуются микросомальными ферментами печени. В результате этого амидные местные анестетики чаще дают токсические эффекты у больных с нарушениями функции печени. Например, средний период полувыведения лидокаина может быть увеличен с 1 -2 часов у обычных пациентов до 6 часов и более у пациентов с тяжелыми повреждениями печени.
Побочное действие местных анестетиков:
Центральная нервная система (ЦНС) - сонливость, головокружение, зрительные и слуховые нарушения и двигательное беспокойство. В более высоких концентрациях любые местные анестетики могут вызывать нистагм, дрожь и, наконец, тоникоклонические судороги с последующей депрессией ЦНС и смертью.
Периферическая нервная система - при аппликации слишком больших доз все местные анестетики могут оказывать токсическое действие на ткань нерва (нейротоксичность).
Сердечно-сосудистая система - Действие местных анестетиков на сердечно-сосудистую систему частично связано с прямым эффектом на мембраны гладких мышц и миокарда и непрямым эффектом на вегетативные нервные волокна. Как указано местные анестетики блокируют натриевые каналы в миокарде и этим подавляют аномальную пейсмекерную активность, возбудимость и проводимость. Все эти препараты уменьшают силу сердечных сокращений и вызывают расширение артерий, что приводит к гипотензии.
Аллергические реакции - продукты метаболизма эфирных анестетиков могут вызывать аллергические реакции.
Методы местной анестезии
Терминальная (аппликационная) анестезия достигается путем нанесения местного анестетика на кожу или слизистые оболочки. Используется в офтальмологии (2% раствор лидокаин – акос), ЛОР клинике, при проведении эндоскопических процедур (10% лидокаин – аэрозоль). Точка приложения местного анестетика – терминали афферентных волокон.
Инфильтрационная анестезия – послойное введение раствора местного анестетика в ткани. Сначала препарат вводится внутрикожно, затем подкожно. После разреза кожи, под фасции и т.д. Анестезия развивается в том месте, где произведена инфильтрация. При этом сохраняется тактильная и проприоцептивная (сухожильная чувствительность), но полностью отсутствует болевая. Такая анестезия применяется при операциях небольшого объема (удаление доброкачественных новообразований, герниопластика и .т.п.), а так же широко используется при проведении болезненных манипуляций (катетеризация сосудов, пункция плевральной полости и т.д.). Для инфильтрационной анестезии в настоящее время используется 0,25 – 0,5% раствор лидокаина или 0,25-0,5% раствор новокаина. Требуется достаточно большое количество анестетика.
Проводниковая анестезия - местный анестетик вводится в область точки прохождения крупного ствола афферентного нерва. При этом доза анестетика относительно небольшая, и анестезия развивается во всей зоне иннервации данного нерва. Такая анестезия часто применяется в травматологии, стоматологии, при хирургических вмешательствах на пальцах кисти и стопы. В качестве анестетиков чаще всего используют 2% раствор лидокаина, в стоматологии - ультракаин.
Плексусная анестезия - введение анестетика в область крупного сплетения (например, плечевого). Современная концепция плексусной анестезии, описанная Winnie и соавт. в 80 - х г. г., основана на том факте, что все основные сплетения в определенной точке своего образования и распространения проходят между двумя мышцами и поэтому расположены между двумя фасциями этих мышц и лежат в собственной “интерфасциальной лакуне”, в связи с чем, при условии точной идентификации данного пространства, все сплетение может быть блокировано путем однократной иньекции, без необходимости выполнения повторных иньекций, как при других методах выполнения блокад. Для проведения такой анестезии необходимо знать специальные анатомические ориентиры, а для более точного определения места введения анестетика применяют специальные приборы – нейростимуляторы. Применяют как одноразовое введение местных анестетиков, так и продленную анестезию, с помощью многократного введения через установленный в область нервного сплетения, специальный катетер. Используется 2% раствор лидокаина, 0,25% раствор бупивакаина.
Эпидуральная анестезия.
Эпидуральная анестезия (ЭА), она же «перидуральная» — один из методов регионарной анестезии, при котором лекарственные препараты вводятся в эпидуральное пространство. Это пространство ограничено передним и задним листком твердой мозговой оболочки. Последний плотно спаян с желтой связкой. Передне-задний размер эпидурального пространства составляет около 2-3 мм в грудном и 4-5 мм в поясничном отделе. В эпидуральном пространстве находятся венозные сплетения и небольшое количество рыхлой соединительной ткани. В настоящее время используют как одномоментную ЭА (однократное введение местного анестетика перед началом операции), так и продленную ЭА, которая предусматривает постановку катетера для многократного введения анестетика во время операции и в послеоперационном периоде (рис.2).
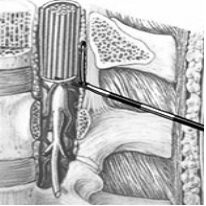
Рис.2. Введение катетера в эпидуральное пространство.
Механизм действия эпидуральной анестезии связан, преимущественно, с проникновением препаратов через дуральные муфты в субарахноидальное пространство, и вследствие этого, блокадой прохождения нервных импульсов (в том числе болевых) по корешковым нервам и далее в спинной мозг. При этом местный анестетик действует на задние корешки спинного мозга, устраняя болевую, но сохраняя при этом тактильную и проприоцептивную (сухожильную) чувствительность. За счет воздействия на передние (двигательные) корешки спинного мозга наступает не полная релаксация скелетных мышц, а блокада преганглионарных симпатических волокон, что приводит к выраженной вазодилатации артериол в зоне развития эпидурального блока.
При ЭА, аналгезия имеет сегментарный характер, а выбор места пункции зависит от области оперативного вмешательства. (табл. 1).
Табл.1.