Способ окраски по Романовскому - Гимзе.
Данный способ окраски применяют для изучения простейших, а также спирохет и риккетсий. Используемая краска состоит из смеси азура, эозина, мителенового синего. Непосредственно перед употреблением её растворяют дистиллированной или проточной водой (рН 7,0 - 7,2) из расчета 1:10. Препарат фиксируют этиловым или метиловым спиртом в течение 5-15 минут, окрашивают 30-40 минут, высушивают и микроскопируют. Ядро простейших, жгутики и блефаропласт окрашиваются в ярко-синий цвет, цитоплазма - в голубой, спирохеты и риккетсий - в сиреневато-синий.
Окраска по Бурри - Гинсу (выявление капсул).
Этот метод назван негативным, так как окрашивается фон препарата и бактериальная клетка, а капсула остается неокрашенной.
1. На предметное стекло наносят каплю чёрной туши, разведённой в 10 раз. В неё вносят каплю культуры. Ребром шлифованного стекла делают мазок, также как мазок крови и высушивают.
2. Фиксирую спиртом или сулемой. Осторожно промывают водой.
3. Окрашивают фуксином Пфейфера 3-5 минут. Осторожно промывают и высушивают на воздухе. Микроскопия препаратов проводится с помощью иммерсионной системы. Фон препарата - черный, клетки - красные, капсулы - не окрашены.
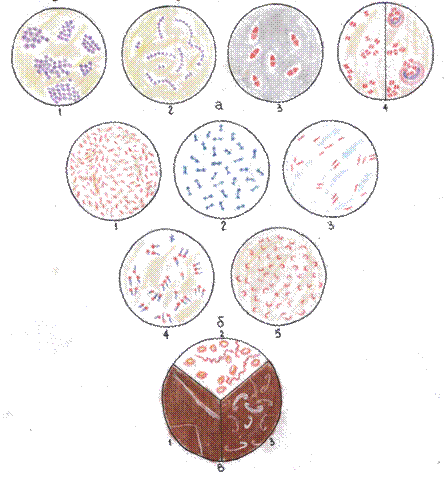
а) Шаровидные бактерии:
1-стафилококки (окраска по
Грамму)
2-стрептококки (окраска по
Грамму)
3-пневмококки (окраска по Бури-
Гинсу)
4-менингококки и гонококки
(окраска по Грамму)
б) Палочковидные бактерии:
1-кишечные палочки (окраска по
Грамму)
2-возбудитель дифтерии (окраска
мителеновым синим)
3-Возбудитель туберкулёза (окраска
по Цилю-Нильсену)
4-возбудитель столбняка (окрска по
Ожешко)
5-холерный вибрион (окраска по
Грамму)
в) Спирохеты:
1- бледная трепонема
2-спирохета возвратного тифа
3-лептоспиры
Методы приготовления мазков – препаратов из
Материала (культур)
И способы их окрашивания.
Мазки-препараты готовят из патологического материала (например, из гноя, мокроты, фекалий), колоний или из налёта чистых культур бактерий, и грибков, выросших на питательных средах в чашках Петри или пробирках. Делают мазки на предметных стёклах, как правило, бактериальной петлей (диаметр 3x2 мм) из нихромовой проволоки, конец которой закрепляют зажимом в специальном петледержателе или впаивают в стеклянную палочку. Для изготовления мазков необходима газовая горелка или спиртовка, ванночка с подставкой (мостик) для стёкол, промывалка с водой, флакон с физиологическим раствором, красители, фильтровальная бумага, банки с дезинфицирующим раствором для обезвреживания отработанных препаратов, пипеток, материалов и рабочего стола.
Этапы приготовления мазка:
1. Исследуемые материалы и культуры микробов берут бактериальной петлёй, которую стерилизуют в пламени горелки. При введении петли в пробирки и колбы стерилизуют также верхнюю часть петледержателя. Края горлышка пробирки стерилизуют в пламени горелки и почти одновременно обжигают петлю, которую быстро вводят внутрь пробирки, охлаждают и прикасаются к налёту на скошенном питательном агаре или же погружают её в культуру. Затем петлю извлекают, быстро обжигают край пробирки и, закрывают пробкой и ставят пробирку в штатив.
2. Налёт чистой культуры микробов или колонию эмульгируют в капле воды на предметном стекле и круговыми движениями петли равномерно распределяют на площади 1,0 - 1,5 см. Точно такого же размера готовят мазок из бульонной культуры, гноя, мокроты и др. материалов, которые не взвешиваются в воде. Хорошо приготовленные мазки имеют округлую форму, быстро высыхают при комнатной температуре, более толстые -высушивают в термостате или подогревают над пламенем горелки, не допуская свёртывания белка бактерий и нарушения их структуры.
3. Высушенные мазки фиксируют 5 - 6 секунд в пламени спиртовки для того, чтобы убить микробов, закрепить их на предметном стекле и предотвратить смыв при ополаскивании во время окраски мазка.
Для приготовления мазков из гноя и мокроты, вязких консистенций пользуются двумя предметными стеклами. На середину одного из них наносят небольшое количество материала, который покрывают вторым стеклом так, чтобы осталась свободной треть первого и второго стекол. Раздвигают стекла в стороны, получают два больших мазка одинаковой толщины.
Мазки из крови готовят следующим образом. Стерильной иглой для инъекций делают укол на предварительно продезинфицированном безымянном пальце левой руки. Первую каплю крови удаляют ватой, вторую наносят на край хорошо обезжиренного предметного стекла. Мазки делают узким шлифовальным стеклом, установленным под углом 45 градусов, продвигая его вдоль предметного стекла влево, не доходя до края.
Препараты-отпечатки из внутренних органов трупов, мяса, колбасных изделий, получают, прикасаясь предметным стеклом к поверхности разрезов, выполненных стерильным скальпелем.
4. Фиксированные мазки окрашивают кислыми, щелочными и нейтральными анилиновыми красителями. Наиболее широкое применение нашли - основной и кислый фуксин, метиленовый синий, генцианвиолет и везувин.
Простой способ окраски мазков производится водным фуксином Пфейффера и метиленовым синим Леффлера. Готовят водный фуксин из фенолового фуксина Циля, разводят его дистиллированной водой.
После окрашивания красители сливают, препарат промывают водой и высушивают между листами фильтровальной бумаги. На сухой мазок наносят каплю масла и микроскопируют с использованием иммерсионного
объектива оптического микроскопа. Способность микробов воспринимать красители называется тинкториальными свойствами.
При сложных методах окраски мазков применяют два-три различных по цвету красителя, что позволяет дифференцировать микробы и выявить некоторые нюансы в деталях их строения. К таким методам относят окраску по Грамму, Цилю - Нельсену, Нейссеру, Бурри - Гинсу, Романовскому - Гимзе и некоторые другие.
Мазок для люминесцентной микроскопии готовят обычным образом, фиксируют в ацетоне 5-10 минут и наносят на него флюорохром на 20- 30 минут. Сделанный препарат 15-20 минут промывают проточной водой, покрывают покровным стеклом и микроскопируют.
Для электронной микроскопии вместо предметных стёкол применяются тонкие плёнки-подложки, незначительно поглощающие электроны.
Они крепятся на опорные сетки. Исследуемый материал, тщатеьно
очищенный от различных примесей, наносят на плёнку.
Высушенный препарат микроскопируют.
Контрольные вопросы.
1. Как приготовить мазок препарата?
2. Назовите цели и способы фиксации мазков?
3. Назовите основные красители?
4. Какими методами изучают подвижность микроорганизмов?
5. Назовите и охарактеризуйте сложные методы окрашивания?
ПРАКТИЧЕСКАЯ РАБОТА №4
Способы сбора материала
| Кровь (ранняя диагностика) | В количестве 10-20 мл берут стерильным шприцем из локтевой вены изасевают у постели больного во флаконы с элективной средой (среда Раппопорт или 10-20% желчный бульон). Во флаконы со средой Раппопорт помещают поплавок, в который попадает образовавшийся газ, что позволяет предположить накопление в среде возбудителей паратифов. Флаконы с посевом ставят в термостат. Наследующий день посевы вынимают из термостата, просматривают и, независимо от внешне выраженных признаков роста, производят высев на плотные среды Эндо и Плоскирева. При отсутствии роста флаконы оставляют в термостате еще на 7 дней. Отсутствие роста после 7-го дня позволяет дать отрицательный ответ. Культура, выделенная из крови, называется гемокультурой. |
| Испражнения (исследование с первых дней заболевания и до выписки из стационара) | 3-5 г испражнений помещают в баночку или пробирку с 30% глицериновой смесью. Производят посев на дифференциальные среды Эндо, Плоскирева, висмут-сульфитный агар или на одну из сред обогащения (селенитовую, Мюллера или Кауфмана) с последующим (через 24 ч) высевом на дифференциальные среды. Таким образом, посев на эти среды производят дважды с интервалом в I день. Сохранять собранный материал в глицериновой смеси можно 6-8 ч (лучше на холоде). |
| Моча (исследование с первых дней заболевания) | Мочу лучше брать стерильно катетером. При отсутствии такой возможности делают так: до взятия мочи наружное отверстие мочеиспускательного канала обмывают изотоническим раствором натрия хлорида. 1-ю порцию мочи сливают. После этого 20-50 мл мочи собирают в стерильную посуду и центрифугируют или отстаивают. Производят посев осадка на дифференциальные среды Эндо, Плоскирева, висмут-сульфитный агар и на одну из сред обогащения - селенитовую, Мюллера или Кауфмана с последующим (через 24 ч) пересевом на дифференциальные среды. Посевы ставят в термостат. На следующий день при наличии подозрительных колоний выделяют чистую культуру. Далее по общей схеме. |
| Содержимое розеол | Участок кожи с выраженными розеолами протирают спиртом, промывают изотоническим раствором натрия хлорида и стерильным скальпелем скарифицируют поверхность розеол. На скарифицированный участок кожи наносят каплю 10-20% желчного бульона, который смешивается с содержимым розеол. Несколько капель этой смеси насасывают пастеровской пипеткой. Тонкий конец пипетки запаивают и отсылают в лабораторию. |
| Дуоденальное содержимое | Исследование желчи можно производить на любом этапе заболевания. Желчь собирают натощак путем дуоденального зондирования в стерильные пробирки, раздельно порции А, В и С. Посев можно производить из отдельных порций и из их смеси. Полученную желчь инкубируют в термостате. На следующий день производят посев на дифференциальные среды. При отсутствии роста после первого высева желчь оставляют в термостате на 10 дней, периодически производят высевы через дня. |
| Рвотные массы | Если рвотные массы густой консистенции, их разводя изотоническим раствором натрия хлорида в соотношении 1:10.2-3 капли из верхнего слоя засевают на дифференциальные среды обогащения. Далее по общей схеме. Промывные воды желудка и рвотные массы исследуют обычно при токсикоинфекциях. Они, как правило, имеют кислую реакцию поэтому перед, посевом их нейтрализуют 5-10% раствором бикарбоната натрия (питьевая сода). |
| Пищевые продукты | Жидкие или полужидкие продукты тщательно размешивают, 2-3 капли засевают на дифференциальные среды и среды обогащения. При исследовании плотных продуктов стерильным шпателем ил ножом берут 5-10г из глубины, эмульгируют в изотоническом растворе натрия хлорида в соотношении 1:5 или 1:10 и засеваю на дифференциальные среды и среды обогащения При вырастании подозрительных колоний дальнейшее исследование ведут по общей схеме. |
ПИТАТЕЛЬНЫЕ СРЕДЫ
Питательные среды широко применяются в микробиологической практике для выращивания разных микроорганизмов с исследовательской целью, для диагностики инфекционных заболеваний, для получения из микробов различных продуктов жизнедеятельности (токсинов, антибиотиков) и т. д. Любая питательная среда должна отвечать следующим требованиям: содержать все необходимые для роста и размножения микроба вещества в легко усвояемой форме, быть изотоничной, иметь оптимальную влажность, вязкость, рН, оптимальный окислительно-восстановительный потенциал, быть стерильной и прозрачной.
Питательные среды готовят из естественных продуктов животного и растительного происхождения (мяса, молока, сыворотки крови, дрожжей и др.) или искусственно полученные из этих продуктов веществ (пептона, дрожжевого экстракта и др.), или химически чистых соединений с точно известным составом (аминокислоты, углеводы, витамины, минеральные соли).
Большое значение имеет наличие в составе питательных сред факторов роста. К ним относятся витамины, пуриновые и пиримидиновые основания, аминокислоты.
В бактериологической практике чаще всего используют питательные среды комбинированного состава. Многие питательные среды выпускаются в виде порошка. Для приготовления питательной среды его растворяют в кипящей воде. По целевому назначению питательные среды можно разделить на основные, дифференциально-диагностические и элективные.
К основным относятся мясо-пептонный бульон и агар, которые применяются для выращивания многих патогенных и непатогенных гетеротрофных бактерий. При приготовлении элективных сред ставится задача создать максимально благоприятные условия для роста микроба одного вида,
Целевое назначение дифференциально-диагностических сред состоит в возможности распознания отдельных видов бактерий по их ферментативным свойствам.
Все большее значение приобретают синтетические питательные среды, приготовленные из растворов химически чистых органических и неорганических соединений. По консистенции питательные среды могут быть жидкими, плотными и полужидкими. Для получения плотных и полужидких сред к ним добавляют агар-агар. Последний представляет собой продукт переработки особого вида морских водорослей и в застывшем состоянии придает среде плотность. Для приготовления плотных сред добавляют- 2,5%-агар-агара, а для получения полужидких 0,15 - 0,7%. В некоторых случаях для получения плотных питательных сред используют желатин. Такие среды, как свернутая сыворотка крови, свернутый яичный белок, сами по себе являются плотными.