gt; фенилаланин > цистин > тирозин
Денатурация
Разрушение нативной структуры белка, сопровождающееся потерей биологической активности (ферментативной, гормональной), называют денатурацией. С физической точки зрения денатурацию рассматривают как разупорядочение конформации полипептидной цепи без изменения первичной структуры. Денатурация олигомерного белка заключается в диссоциации на протомеры, сопровождающейся или не сопровождающейся изменением их конформации.
Денатурация белков происходит при нагревании и замораживании пищевых продуктов под действием различных излучений, кислот, щелочей, резких механических воздействий и других факторов.
При денатурации белков происходят следующие основные изменения:
- резко снижается растворимость белков;
- теряется биологическая активность, способность к гидратации и видовая специфичность;
- улучшается атакуемость протеолитическими ферментами;
- повышается реакционная способность белков;
- происходит агрегирование белковых молекул;
- заряд белковой молекулы равен нулю.
В результате потери белками видовой специфичности пищевая ценность продукта не снижается.
Каждый белок имеет определенную температуру денатурации t. Для белков рыбы t = 30 °С, яичного белка t = 55...50 °С, мяса t = 55...60 °С и т.п. Большая часть белков денатурируется при 60-80 °С, однако встречаются белки и термостабильные, например, -лактоглобулин молока и -амилазы некоторых бактерий. Повышенная устойчивость белков к нагреванию часто обуславливается наличием в их составе большого количества дисульфидных связей. Однако степень денатурирующего воздействия температуры на белки зависит и от их влажности, реакции и солевого состава среды и присутствия небелковых соединений.
При значениях рН среды, близких к изоэлектрической точке белка, денатурация происходит при более низкой температуре и сопровождается максимальной дегидратацией белка. Смещение рН среды способствует повышению термостабильности белков.
Направленное изменение рН среды широко используется в технологии для улучшения качества блюд. Так, при тушении мяса, рыбы, мариновании, перед жаркой добавляют кислоту, вино или другие кислые приправы для создания кислой среды со значениями рН ниже изоэлектрической точки белков продукта. В этих условиях дегидратация белков в продуктах уменьшается и готовое блюдо получается более сочным.
Температура денатурации белков повышается в присутствии других, более термостабильных белков и некоторых веществ небелковой природы, например, сахарозы. Температура денатурации белков сои и подсолнечника существенно понижается в присутствии кислот жирного ряда, в кислой и влажной среде, но повышается в присутствии сахарозы и крахмала.
Денатурация некоторых белков может происходить без видимых изменений белкового раствора (например, у казеина молока). Пищевые продукты, доведенные тепловой обработкой до готовности, могут содержать некоторое количество нативных, неденатурированных белков, в том числе некоторых ферментов.
Денатурированные белки способны к взаимодействию между собой. При агрегировании за счет межмолекулярных связей между денатурированными молекулами белка образуются как прочные, например, дисульфидные связи, так и слабые, например, водородные.
При агрегировании образуются более крупные частицы. Например, при кипячении молока выпадают в осадок хлопья денатурированного лактоальбумина, образуются хлопья и пена белков на поверхности мясных и рыбных бульонов.
При денатурации белков в более концентрированных белковых растворах в результате их агрегирования образуется студень, удерживающий всю содержащуюся в системе воду.
Основные денатурационные изменения мышечных белков завершаются при достижении 65 °С, когда денатурирует более 90 % общего количества белков. При t = 70 °С начинается денатурация миоглобина и гемоглобина, сопровождающаяся ослаблением связи между глобином и гемоглобином, который затем отщепляется и, окисляясь, меняет окраску, вследствие чего цвет мяса становится буровато-серым.
При нагревании мяса существенные денатурационные изменения происходят с белками соединительной ткани. Нагревание коллагена во влажной среде до t = 58...62 °С вызывает его "сваривание", при котором ослабевает и разрывается часть водородных связей, удерживающих полипептидные цепи в трехмерной структуре. Полипептидные цепи при этом изгибаются и скручиваются, между ними возникают новые водородные связи, имеющие случайный характер. В итоге коллагеновые волокна укорачиваются и утолщаются.
Коллаген, подвергнутый тепловой денатурации, становится более эластичным и влагоемким, его прочность значительно уменьшается. Реакционная способность коллагена также возрастает, и он становится более доступным действию пепсина и трипсина, что повышает его перевариваемость. Все эти изменения тем больше, чем выше температура и длительнее нагрев.
Факторы, вызывающие денатурацию белков, имеют особо важное значение для регулирования активности ферментов. Любые воздействия, направленные на стабилизацию вторичной и третичной структуры, приводят к повышению активности ферментов, а те, которые разрушают нативную структуру, - к их инактивации. Во многих растительных продуктах (например, в зернобобовых) содержатся ингибиторы протеаз, которые подавляют активность этих пищеварительных ферментов. Вещества, способные ингибировать протеолитическую активность некоторых ферментов, называют ингибиторами протеаз. К ним относятся вещества белковой природы, понижающие активность пищеварительных ферментов (пепсин, трипсин, химотрипсин, -амилаза). Ингибиторы протеаз содержатся в семенах бобовых (соя, фасоль и др.) и злаковых (пшеница, ячмень и др.) культур, в картофеле, яичном белке и других продуктах растительного и животного происхождения.
Ингибиторы протеаз, выделенные в сои, можно разделить на две основные группы: ингибиторы Кунитца и ингибиторы Баумана-Бирка. Одна молекула ингибитора Кунитца инактивирует одну молекулу трипсина, а одна молекула ингибитора Баумана-Бирка инактивирует одну молекулу трипсина и химотрипсина, причем с одной молекулой ингибитора могут связываться молекулы обоих ферментов.
В клубнях картофеля содержится целый набор ингибиторов химотрипсина и трипсина, которые отличаются между собой по своим физико-химическим свойствам (молекулярной массе, особенностям аминокислотного состава, химическим и термодинамическим показателям и т.д.). Кроме картофеля белковые ингибиторы содержатся также в томатах, баклажанах, табаке. Наряду с ингибиторами сериновых протеиназ в них обнаружены и белковые ингибиторы цистеиновых, аспартильных протеиназ, а также металлоэкзопептидаз.
В семенах растений и в клубнях картофеля находятся также ингибиторы, способные одновременно связываться и ингибировать протеазу и -амилазу. Такие белковые ингибиторы были выделены из риса, ячменя, пшеницы, ржи. При тепловой обработке все они почти полностью разрушаются, в результате усвояемость белков заметно повышается.
Тепловая денатурация белков является одним из основных физико-химических процессов, лежащих в основе выпечки хлеба, печенья, бисквитов, пирожных, сухарей, сушки макаронных изделий, получения экструдатов и сухих завтраков, варки, жарения овощей, рыбы, мяса, консервирования, пастеризации и стерилизации молока. Данный вид превращений относится к полезным, так как он ускоряет переваривание белков в желудочно-кишечном тракте человека (облегчая доступ к ним протеолитических ферментов) и обуславливает потребительские свойства пищевых продуктов (текстуру, внешний вид, органолептические свойства). В связи с тем, что степень денатурации белков может быть различной (от незначительной до полного изменения расположения пептидных цепей с образованием новых ковалентных -S-S-связей), то и усвояемость полимеров может не только улучшаться, но и ухудшаться.
Меланоидинообразование
При температуре от 40-60 °С до 100 °С со значительной скоростью протекает взаимодействие белков с восстанавливающими сахарами, сопровождающееся образованием карбонильных соединений и темноокрашенных продуктов - меланоидинов (реакция Майяра). При этом образуются темноокрашенные продукты – меланоидины (от греческого "меланос" - темный). Это реакция Майяра, по имени ученого, который в 1912 г. впервые описал данный процесс. МО - окислительно-восстановительный процесс, который представляет собой совокупность последовательно и параллельно идущих реакций. Скорость и глубина этого процесса зависят от состава взаимодействующих продуктов, соотношения отдельных компонентов, рН среды, температуры и влажности.
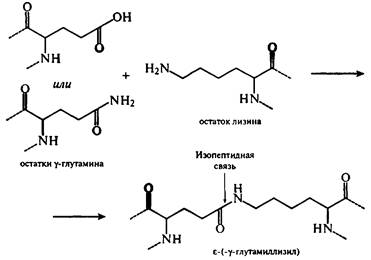
Сущность реакций меланоидинообразования заключается во взаимодействии группы -NH2 аминокислот с гликозидными гидроксилами сахаров. Сахароаминные реакции являются причиной не только потемнения пищевых продуктов, но и уменьшения в них сухого вещества и потерь незаменимых аминокислот (лизина, треонина). Меланоидины понижают биологическую ценность изделий, так как снижается усвояемость аминокислот из-за того, что сахароаминные комплексы не подвергаются гидролизу ферментами пищеварительного тракта. К тому же количество незаменимых аминокислот уменьшается. Это уменьшение происходит не только за счет взаимодействия их с восстанавливающими сахарами, но и за счет взаимодействия между собой функциональных групп -NH2 и -СООН самого белка. Реакции протекают с образованием внутренних ангидридов, циклических амидов и изопептидных связей. Механизм образования связей с участием глутаминовой кислоты и ее амида представлен на рисунке. Изопептиды обнаружены в кератине, молочных белках и белках мяса.
Не все аминокислоты белков одинаково реакционноспособны при тепловой обработке. Активность аминокислот и сахаров в реакции Майяра снижается в следующей последовательности:
а м и н о к и с л о т ы:
лизин > глицин > метионин > аланин > валин > глутамин >
gt; фенилаланин > цистин > тирозин
Наиболее легко вступает в реакцию меланоидинообразования лизин - важная незаменимая аминокислота, которая в результате тепловой обработки не усваивается организмом. Относительно неустойчивы к тепловым воздействиям метионин и цистин. Эти аминокислоты весьма чувствительны ко многим видам технологической обработки. Так, если белок натурального молока практически содержит все незаменимые аминокислоты, то в белке сухого молока содержание метионина и цистина составляет 93 % оптимального содержания, а доступного лизина на 25 % меньше. Кроме того, следует учесть, что в результате некоторых видов тепловой обработки не только лизин, но и серусодержащие аминокислоты становятся частично недоступными для переваривания пищеварительными ферментами.
Наиболее интенсивно МО протекает в нейтральной и щелочной среде, а также в концентрированных растворах. Чтобы задержать нежелательные изменения, используют соединения, легко связывающиеся с карбонильными соединениями, например, перекись водорода, сернистую кислоту. Образующиеся при МО карбонильные соединения (фурфурол, оксиметилфурфурол, ацетальдегид, изовалериановый альдегид, диацетил и др.) принимают участие в формировании аромата, цвета и вкуса готового продукта. При невысоких температурах реакции протекают медленно, при 100 °С и выше - ускоряются. Чем выше интенсивность образования коричневой окраски, тем ниже пищевая ценность белковых продуктов. При этом теряется 20-50 % свободных аминокислот; с увеличением температуры и продолжительности нагревания эти потери возрастают. Потери аминокислот и сахаров наиболее значительны при обжаривании мяса.
Соединения, содержащие эту группу, обнаружены в обжаренных пищевых продуктах (хлеб, кофе, какао, солод), в которых под воздействием высоких температур происходит неферментативное потемнение.
Продукты реакции меланоидинообразования оказывают различное влияние на органолептические свойства готовых изделий: заметно улучшают внешний вид жареного или тушеного мяса, котлет, но ухудшают вкус, цвет и запах мясных экстрактов, бульонных кубиков и других концентратов.
Реакция МО часто протекает при выпечке хлеба, сушке фруктов и овощей, получении сухого молока, упаривании сахарного сиропа, при производстве солода. Образование вкусной, хрустящей, золотистокоричневой корочки хлеба, его вкус и аромат во многом связаны с МО.
При получении вина, изготовлении коньяка и шампанского образуются продукты МО, которые влияют на цвет, вкус и аромат. При очень длительной выдержке вина идут глубокие изменения продуктов, участвующих в реакции МО, что приводит к изменению первоначальных свойств вина. Потемнение фруктовых соков при хранении, изменение внешнего вида, вкуса и запаха готовых мясных продуктов также связано с реакцией МО.
При МО снижается пищевая ценность получаемых продуктов в результате связывания белков, витаминов, аминокислот в комплексные соединения.
Таким образом, МО, с одной стороны, снижает пищевую ценность готового продукта вследствие потери ценных питательных веществ, с другой - улучшает органолептические показатели готовых изделий.
Деструкция
При нагревании пищевых продуктов до 100 °С происходит разрушение макромолекул денатурированных белков. На первом этапе изменений от белковых молекул могут отщепляться такие летучие продукты, как аммиак, сероводород, диоксид углерода и другие соединения. Накапливаясь в продукте и окружающей среде эти вещества участвуют в образовании вкуса и аромата готовой пищи.
При дальнейшем воздействии температуры происходит деполимеризация белковой молекулы с образованием водорастворимых азотистых веществ. Например, при продолжении нагрева сваренного коллагена происходит его дезагрегация, связанная с разрывом водородных связей и приводящая к образованию полидисперсного продукта глютина.
Этот процесс называется пептизацией. Глютин при 40 °С и выше неограниченно растворяется в воде, а при охлаждении его растворы образуют студни. Глютин легко расщепляется протеазами и, следовательно, легко переваривается.
При нагревании одновременно с пептизацией происходит гидролиз глютина с образованием конечных продуктов, называемых желатозами.
Продукт гидротермической дезагрегации коллагена, способный образовывать прочные, не плавящиеся при t = 23...27 °С студни, называется желатином.
При температуре выше 100 °С наблюдается дальнейший гидролиз мышечных белков до полипептидов, которые, в свою очередь, гидролизуются до аминокислот и других низкомолекулярных азотистых соединений. Степень гидролиза белков тем выше, чем выше температура и длительнее нагрев. Однако с повышением температуры и увеличением длительности нагрева скорость распада полипептидов возрастает более интенсивно, чем скорость распада белков до полипептидов. Чрезмерный распад коллагена при длительном нагревании свыше 100 °С приводит к "разволакиванию" тканей, а глубокий гидролиз глютина - к образованию низкомолекулярных соединений, что уменьшает способность бульона к студнеобразованию. Длительный нагрев при температуре более 100 °С вызывает также некоторое ухудшение перевариваемости белков мяса.
Очень продолжительное нагревание при высоких температурах (180-300 °С) обусловливает деструкцию аминокислот и образование полиаминокислотных комплексов. При варке мяса глютамин превращается в глютаминовую кислоту, а инозиновая кислота распадается с образованием гипоксантина. Эти процессы играют решающую роль в формировании вкуса и аромата вареного мяса.
Среди продуктов термического распада белков встречаются соединения, придающие им мутагенные свойства. Термически индуцированные мутагены образуются в белоксодержащей пище в процессе ее обжаривания в масле, выпечки, копчения в дыму и сушки. Мутагены содержатся в бульонах, жареной говядине, свинине, домашней птице, жареных яйцах, копченой и вяленой рыбе. Некоторые из них вызывают наследственные изменения в ДНК, и их воздействие на здоровье человека может быть от незначительного до летального.
В экстрактах, выделенных из жареной рыбы и мяса, еще в 70-х гг. найдены продукты пирролиза аминокислот, образующиеся обычно при 500-600 °С. Продукты идентифицированы как Трп-П-1 и Трп-П-2 из триптофана, Фен-П-1 из фенилаланина, Глу-П-1и Глу-П-2 из глутаминовой кислоты, Лиз-П-1 из лизина, Орн-П-1 из орнитина:
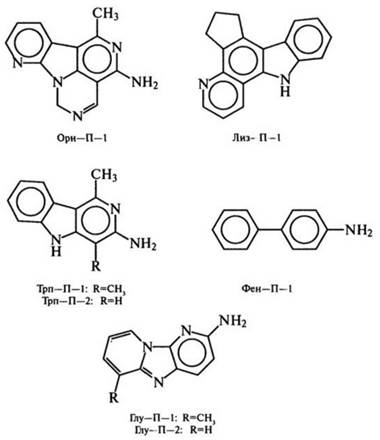
Другая группа мутагенных соединений в белковой пище открыта в 80-х гг. в умеренно нагретом мясе (ниже 200 °С) и пищевых бульонах:

Токсические свойства белков при термической обработке выше 200 °С или при более низких температурах, но в щелочной среде, могут обуславливаться не только процессами деструкции, но и реакциями изомеризации остатков аминокислот из L- в D-форму. Присутствие D-изомеров понижает усвояемость белков. Например, термообработка казеина молока при температуре около 200 °С снижает биологическую ценность продукта на 50 %.
В сильнощелочных средах, особенно при высоких температурах, некоторые остатки аминокислот претерпевают ряд специфических превращений. В реакцию конденсации могут вступать остатки аргинина, гистидина, треонина, серина, тирозина и триптофана. Питательная ценность белков с новыми поперечными связями ниже, чем у белков с нативной структурой, поэтому образование их в технологических процессах производства пищевых продуктов нежелательно. К тому же в опытах на крысах показано, что образование, например, лизиноаланина стимулирует нефрокальциноз, диарею и облысение.
Обработка сырья растворами щелочей широко используется при получении изолятов и концентратов белков. Чем ниже значение рН, температура и время обработки, тем выше содержание незаменимых аминокислот в белке.
Использование новых и традиционных технологических процессов без глубокого изучения влияния их на молекулярные основы структуры белков, с одной стороны, опасно для здоровья людей, а с другой - неэффективно с точки зрения обеспечения качества пищевых продуктов. Примером может служить научно обоснованное применение аскорбиновой кислоты для улучшения качества хлеба.
Биохимическая деструкция
Автолиз мяса и рыбы - процесс самопроизвольного изменения химического состава, структуры и свойств мясного сырья после убоя животного под воздействием собственных ферментов мяса. В процессе длительного созревания мяса происходит существенное улучшение органолептических и технологических характеристик. На ранних стадиях автолиза мясо не имеет выраженного вкуса и запаха, которые в зависимости от температуры хранения появляются лишь на 3-4 сутки в связи с образованием продуктов ферментативного распада белков и пептидов (глютаминовая кислота, треонин, серосодержащие аминокислоты), нуклеотидов (инозин, гипоксантин и др.), углеводов (глюкоза, фруктоза, пировиноградная и молочная кислота), липидов (низкомолекулярные жирные кислоты), а также креатин, креатинин и другие азотистые экстрактивные вещества.
Помимо собственных ферментов могут использоваться протеолитические препараты, ускоряющие процессы созревания мяса и рыбы.