Методичні рекомендації щодо формування понять про класи неорганічних сполук
У темі «Кисень. Оксиди. Горіння» формується поняття про оксиди через накопичення чуттєвих і образних уявлень, що зумовлює індуктивний шлях до набуття знань.
Перш ніж почати вивчати оксиди, необхідно визначити, які знання про них повинні набути учні.
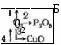
Опорним є поняття про хімічні властивості кисню. Для відтворення знань учні виконують завдання: 1. Здійсніть перетворення:
Напишіть відповідні хімічні рівняння. Назвіть продукти реакцій. Визначте їх тип.
- Напишіть рівняння реакцій окислення складних речовий: сірководню Н2S, фосфіну РН3, метану СН4, ацетилену С2Н2. Продуктами кожної реакції є оксид відповідного неметалу і вода.
- Зробіть висновок про добування оксидів. Пригадайте досліди, виконані на минулих уроках, і назвіть ознаки утворення оксиду сірки (IV) SO2, оксиду вуглецю (IV) СO2, оксиду заліза (III) Fе2Оз. Яке визначення можна дати оксидам?
Учні роблять висновок про те, що оксиди утворюються внаслідок реакцій окиснення як простих, так і складних речовин. Вони самостійно дають визначення оксидам.
Таким чином, на першому етапі учні одержують знання про добування оксидів.
На другому етапі висловлюється думка про необхідність класифікації оксидів. Основне питання, яке розв'язують учні, таке: За якою ознакою виділяють оксиди серед інших сполук і як можна класифікувати оксиди? Яку класифікаційну ознаку можна взяти за основу?
Відповіді передує виконання вправ:
- Проаналізуйте формули речовин і випишіть з них формули оксидів: Н2О, НС1, SO2, SO3, NаСl, NaOH, Сu2O, СuО.
- Як можна класифікувати оксиди, формули яких ви виписали?.
3. Випишіть оксиди неметалів в один стовпчик, оксиди металів –у другий. Що спільного в їх формулах і в чому різниця? Зробіть припущення про класифікацію оксидів за їх складом, відобразіть це у схемі.
Учні роблять висновок про те, що основною класифікаційною ознакою оксидів є наявність в молекулі двох елементів, один з яких кисень, а ознакою поділу оксидів за складом молекул є наявність елемента металу чи неметалу. Як наслідок обговорення даного питання вони складають узагальнюючу схему:

Потім учні виконують вправи на складання формул оксидів за валентністю елементів, у тому числі елементів із змінною валентністю, навчаються номенклатурі оксидів. Закріплюють знання про склад оксидів, виконуючи лабораторний дослід «Ознайомлення із зразками оксидів».
В узагальнюючому висновку вчитель підкреслює, що всі різноманітні оксиди об'єднуються в один клас – клас оксидів, бо всі вони мають подібний склад молекул. Це дає змогу відрізнити їх від інших класів неорганічних сполук. Таке співвідношення порівнюють з класифікацією у біології, коли окремі особини об'єднуються у вид, вид – у рід, рід – у родину і т. д.
У темі «Водень. Кислоти. Солі» учні відразу знайомляться з двома новими класами неорганічних сполук – кислотами і солями.
Розглядаючи способи добування водню в лабораторії, учні ознайомилися з реакціями цинку з соляною і сірчаною кислотами. їм відомо, що до складу молекул кислот обов'язково входять атоми водню. За цією ознакою вони відрізняють формули кислот від формул інших речовин. Ось чому вивчення кислот можна розпочати з виконання завдання на розпізнавання їх формул. Виходячи зі складу молекул, учням пропонують дати визначення кислотам. Визначення на цьому етапі може бути таким: кислоти – складні речовини, до складу молекул яких входять атоми водню, здатні заміщуватись на метал, і кислотний залишок. Далі, як і під час вивчення оксидів, розглядають класифікацію кислот. Учитель пропонує учням самостійно знайти основні ознаки класифікації кислот. Насамперед учні звертають увагу на наявність елемента кисню в молекулах деяких кислот і разом з учителем класифікують кислоти за складом на кисневмісні і безкисневі. Записують відповідні приклади.
На класифікацію кислот за основністю учні здебільшого виходять після навідного запитання: Чи може кількість атомів водню у молекулі кислоти бути класифікаційною ознакою? Після обговорення роблять узагальнюючий висновок про класифікацію кислот на одно-, двох- і трьохосновні за кількістю атомів водню, здатних заміщуватися на метал, і наводять приклади.
Для вивчення фізичних властивостей кислот використовують знання учнів про кислоти з побуту: оцтову, лимонну, молочну, яблучну, соляну та ін. Бесіду спрямовують таким чином, щоб виявити таку загальну властивість, як кислий смак їхніх розчинів. Учитель попереджає, що пробувати на смак кислоти не можна, і пояснює чому. Демонструючи кислоти, зауважують, що багато які кислоти (НС1, Н2SO4, НNО3) – безбарвні рідини. Відомі тверді кислоти – Н3РО4,НРO3. Майже всі кислоти, крім Н2SіО3, розчиняються у воді.
Із загальних хімічних властивостей кислот розглядають їх дію на індикатори. З Цією метою проводять лабораторний дослід «Дія розчинів кислот на індикатори». Встановлюють, що розчини кислот змінюють забарвлення індикаторів. Записують у зошити, якого кольору набувають лакмус і метиловий оранжевий у розчинах кислот. Далі розглядають таку характерну властивість кислот, як їх здатність взаємодіяти з деякими металами. Учні виконують лабораторні досліди «Відношення кислот (соляної, сірчаної) до металів (заліза, цинку, міді)». (Для дослідів беруть розчини кислот.) Перед виконанням лабораторних дослідів увагу учнів спрямовують на такі запитання: 1. Чи всі метали взаємодіють з кислотами? 2. Чи однаково активно відбуваються реакції між кислотами і металами?
Спостереження за дослідами учні заносять у таку таблицю:
| Метал | Кислота | Рівняння реакції | Тип реакції | |
| соляна | сірчана | |||
| Zn Fe Сu |
Знаком « + » позначається перебіг реакції, знаком «—»– її відсутність. Поряд записується ознака реакції. Учні разом з учителем розміщують метали у ряд за їх активністю по відношенню до кислот: Zn,Fе, Сu, формулюють висновки у відповідності з поставленими запитаннями. Не всі метали з однаковою активністю взаємодіють з кислотами. Для пояснення цього положення формується поняття про витискувальний ряд металів. Можна коротко розповісти про те, хто його склав і як ним користуватися для визначення тих металів, які можуть заміщати водень у кислотах. Зауважують, що від активності металу і властивостей кислоти залежить активність перебігу реакції між ними. На прикладі взаємодії кислот з металами закріплюються знання учнів про реакції заміщення.
Вивчення взаємодії кислоти з оксидами металів також починається з виконання відповідного лабораторного досліду. Особливість цієї реакції в тому, що вона належить до реакції обміну. Цей тип реакцій іде не вивчали. Тому вчитель шляхом бесіди обговорює з учнями, які речовини за складом реагують між собою і які при цьому утворюються. Формулюється визначення реакцій обміну. Учні самостійно складають відповідне рівняння, після чого вчитель пропонує виразити його у загальному вигляді.
Зіставляють реакції кислот з металами і з оксидами металів спочатку на конкретних прикладах, а потім на загальних схемах. Для конкретних прикладів доцільно брати метал і відповідний йому оксид, напри» кладметал магній і оксид магнію. Обговорюють при цьому такі питания:
1. Що спільне у цих реакціях? 2.Чим різняться між собою реакції? 3.Яке визначення кислот можна було б дати на основі їх взаємодії з металами або оксидами металів? 4. З якою властивістю оксиду металу ви ознайомилися?
Завершують вивчення кислот на цьому етапі узагальненням знань про загальні і особливі властивості кислот складанням узагальнюючої схеми:

2. Покажіть за допомогою рівнянь реакцій, як можна реалізувати наведену схему:
Метал Оксид металу Сіль
На прикладі реакцій кислот з металами і оксидами формується поняття про солі. Хімічні властивості солей поки ще не розглядають. Зупиняються на визначенні солей, виходячи з їх складу (якісна характеристика), та відпрацьовують уміння складати формули кислот за валентністю металів та кислотних залишків, ознайомлюються з номенклатурою солей. Інформацію про формули і назви кислот і солей записують у таблицю, самостійне складання якої полегшує усвідомлення учнями матеріал:
| Кислоти | Солі | ||||
| Формула | Кислотний залишок | Назва | Формула | Кислотний залишок | Назва |
Контроль знань і вмінь учнів і самоперевірка за складанням формул кислот і солей за їх назвами або навпаки можуть бути здійснені за допомогою відповідних дидактичних карток або знакових моделей на магнітній основі. Відомо, що уміння складати формули виробляється системою вправ.
Поняття про основи учні дістають під час вивчення теми «Вода. Розчини. Основи». Опорними для введення поняття «основи» є знання про взаємодію води з активними металами і основними оксидами активних металів, внаслідок якої утворюються розчинні основи (луги). Від визначення поняття «луги» переходять до написання формул основ і їх назв, а потім до вивчення властивостей основ. Спочатку розглядають фізичні властивості окремих основ, виконуючи лабораторний дослід «Ознайомлення з властивостями гідроксидів натрію, кальцію, міді (II) або заліза (III)» Поряд з агрегатним станом, кольором, запахом досліджують розчинність їх у воді. Проводять класифікацію основ за розчинністю у воді.
Складання таблиці допомагає учням установити, фенолфталеїн е специфічним реактивом на луг. Для закріплення знань учитель проводить лабораторну спробу на розпізнавання кислот і лугів за допомогою індикаторів. Результати дослідів обговорюються з учнями. Учитель запитує: 1. Чи можна дію індикаторів на луги вважати їх загальною властивістю? 2, Чому всі луги змінюють однаково забарвлення індикаторів? Відповідь на перше запитання показує, як учні засвоюють різницю між загальними і особливими (специфічними) властивостями, на друге - як вміють виділяти головне, саме те, що наявність гідроксогрупи в усіх лугах зумовлює подібність у їхніх властивостях.
Учитель продовжує: у складі лугів і нерозчинних основ є гідроксогрупа. Тому луги і нерозчинні основи повинні мати і спільні властивості. Запитує, чи згодом з цим учні. Як доказ пропонує учням провести два лабораторних досліди: «Взаємодія лугів з кислотами» 1 «Взаємодія нерозчинних основ з кислотами» і зробити відповідні конкретні висновки, записавши рівняння реакцій, в тому числі і в загальному вигляді:

Хімічні властивості основ вивчають, порівнюючи між собою луги і нерозчинні основи. Насамперед розглядають їх відношення до індикаторів. Лабораторним шляхом перевіряють дію лугів на фенолфталеїн, індикатор, ще не відомий учням. Крім того, випробовують дію лугу на фіолетовий лакмус і метиловий оранжевий. Особливо наочно ці досліди відбуваються під час демонстрування їх через графопроектор. Порівнюють дію одних і тих самих індикаторів на розчини кислот і лугів і результати записують у таку таблицю:
| Індикатори | Нейтральне середовище | Класи речовин | |
| кислоти | основи (луги) | ||
| Лакмус Метиловий оранжевий Фенолфталеїн | Фіолетовий Оранжевий Безбарвний | Червоний Рожевий Безбарвний | Синій Жовтий Малиновий |
Визначають тип реакції — це реакція обміну. Потім характеризують реакцію обміну між основами і кислотами як реакцію нейтралізації, розкриваючи суть терміна «нейтралізація».
Переходять до розгляду реакцій між лугами і кислотними оксидами. Можна висловити припущення про можливість такої реакції. Для доказу проводять – демонстраційний дослід «Взаємодія оксиду вуглецю (IV) з розчином гідроксиду кальцію і твердим гідроксидом натрію». Учні переконуються, що луги, як у розчині, так і в твердому стані, реагують з оксидами неметалів, утворюючи сіль і воду. Нерозчинні основи не вступають в реакцію обміну з кислотними оксидами. Тому реакція між лугами і кислотними оксидами належить до специфічних, бо вона не характерна для всіх основ.
Після розгляду цих реакцій пригадують, що основні оксиди взаємодіють з кислотами. Продуктами реакцій в обох випадках є сіль і вода. Таким чином, початкові уявлення про оксиди завдяки вивченню властивостей кислот і основ розвиваються. За наслідками порівняння взаємодії оксидів з кислотами і лугами учні складають схему:

Нарешті розглядають відношення основ до нагрівання. З цією метою проводять лабораторний дослід «Розклад гідроксиду міді (II) під час нагрівання» і перевіряють дію нагрівання на кристалічний гідроксид натрію або кальцію. Зіставляючи досліди, роблять висновок про те, що лише нерозчинні основи розкладаються під час нагрівання. Тому ця властивість основ також є особливою, а не загальною. Закріплюючи знання учнів, складають узагальнюючу схему (див. схему 13).
Завершують вивчення основ відомостями про їх добування. Для цього пропонують учням відповісти на таке запитання: Які хімічні властивості води можна використати для добування основ? Називають дві властивості – взаємодію активних металів (К, Nа, Са) та їх оксидів з водою. Роблять висновок, що згідно з
цим існують два способи добування лугів. Підкреслюють, що не всі оксиди металів реагують з водою, а лише ті, яким відповідають розчинні основи – луги.
Систематизація і закріплення знань учнів про основи, а разом з ними і про оксиди і кислоти, відбувається на семінарському занятті. Завдання передбачають різний рівень розвитку пізнавальної діяльності учнів, тому можна виділити 3 групи завдань.
Перша група – завдання, спрямовані на репродуктивну діяльність учнів: дати визначення основ (оксидів, кислот, солей), записати загальні формули, навести конкретні приклади, класифікувати їх за складом, назвати основні властивості певного класу речовин.
Друга група – завдання, що передбачають продуктивну діяльність учнів: виділити загальні і специфічні властивості основ (оксидів, кислот) і пояснити, чим вони зумовлені, розкрити на конкретних прикладах, як склад речовин впливає на їх властивості, здійснити перетворення у межах певного класу, наприклад (у загальному вигляді):

Третя група – завдання творчого характеру, розраховані на застосування знань у нестандартних умовах. Наприклад, здійснити перетворення і висловити припущення про взаємозв'язок між речовинами:

Завершити узагальнення знань про основи можна відповіддю на таке запитання: Чому всі речовини поділяються на класи і яка їх основна класифікаційна ознака? Це запитання є перехідним до узагальнення відомостей про найважливіші класи неорганічних сполук.
2.