Удосконалення класно-урочної системи
Урок сьогодні часто розглядається не стільки з точки зору формального поєднання і послідовності його етапів, скільки з позицій порушення і досягнення мети, ефективності пізнавальної діяльності. Вчитель сьогодні вільний у виборі структури уроку, лише б вона забезпечувала високу результативність навчання і виховання. Важливість цього нововведення можна зрозуміти, лише зіставляючи колишні жорсткі вимоги обов’язкового дотримання формальних східців уроку з нинішніми ідеями вільного конструювання навчальних занять. Однак відношення теоретиків і практиків до «безструктурного» уроку неоднозначне; розкріпачення вчителя, безумовно, прогресивний крок, але порушення закономірностей пізнавальної діяльності, що виникають в умовах довільного, необґрунтованого поєднання етапів уроку, – великий недолік. Важливим сучасним положенням є і те, що доцільність тих або інших типів і структур уроку пропонується оцінювати по ефективності всього навчально-виховного процесу (кінцевому результату), а не по структурній досконалості і завершеності окремих уроків.
Від Коменского і Гербарта бере початок класична чотирьохланкова структура уроку, що спирається на формальні східців (рівні) навчання: підготовка до засвоєння нових знань; засвоєння нових знань, вмінь; їхнє закріплення і систематизація; застосування на практиці. Відповідний їй тип уроку носить назву комбінованого(змішаного). Етапи комбінованого уроку розкладені на відрізки часу, мають такий вигляд:
| Організація роботи | Повторення вивченого (актуалізація знань) | Вивчення нових знань, формування нових вмінь | Закріплення, систематизація, застосування | Завдання додому |
| Етапи |
Не важко зрозуміти, чому такий тип уроку названий комбінованим – на ньому вчитель має можливість досягти декількох мети. Елементи (етапи) уроку можуть бути скомбіновані в будь-який послідовності, що робить урок гнучким і придатним для вирішення дуже широкого кола навчально-виховних задач. Цим, зокрема, і пояснюється широке розповсюдження комбінованого уроку в масовій практиці; за деякими даним, частка комбінованих уроків займає 75-80% від загального числа всіх уроків, що проводяться.
Стійкість класичного комбінованого уроку визначило і те, що він краще інших типів узгоджується з закономірностями навчально-виховного процесу, динамікою розумової працездатності і надає педагогам більше можливості пристосовуватися до конкретних умов.
Доцільність 45-хвилинної тривалості уроку інтуїтивно встановленою нашими попередниками, сьогодні підкріплюється психофізіологічними дослідженнями. Якщо уроки стають коротшими, то потрібно форсувати процес «втягнення» в роботу, відповідно скорочується час продуктивну діяльність. При більш тривалих уроках зростає необхідність вольової регуляції довільної уваги.
Окрім своєї важливої переваги – можливості досягати на одному уроці не однієї мети, комбінований урок має і недоліки. Вони виявляються в тому, що практично бракує часу не тільки на засвоєння нових знань, але і на всі інші види пізнавальної діяльності. З того часу, коли був запропонований комбінований урок, відбулися радикальні зміни: значно зріс обсяг знань, що вивчаються на уроці, в багатьох школах переповнені класи, що ускладнює управління пізнавальними процесами, погіршилося відношення учнів до навчання, а тому продуктивність всіх етапів уроку знизилася. З метою підвищення результативності навчальних занять виникли і практикуються інші типи уроків, на яких учні займаються здебільшого якимось одним видом діяльності. Це уроки засвоєння нових знань; формування нових вмінь; узагальнення і систематизації знань, вмінь; контролю і корекції знань, вмінь; застосування знань, вмінь на практиці. Не важко помітити, що всі названі типи являють собою «укорочений» комбінований урок. Структура виділених типів уроку складається звичайно з трьох частин: 1) організації роботи (1-3 хв.), 2) головної частини (формування, засвоєння, повторення, закріплення, контроль, застосування і т. д.) (35-40 хв.), 3) підведення підсумків і завдання додому (2-3 хв.).
Нестандартні уроки
З середини 70-х рр. у вітчизняній школі виявилася небезпечна тенденція зниження інтересу школярів до занять. Відчуження учнів від пізнавальної праці педагоги намагалися зупинити різноманітними методами. На загострення проблеми масова практика відреагувала так званими нестандартними уроками, що є головною метою збудження і утримання інтересу учнів до навчальної праці. Нестандартний урок – це імпровізоване навчальне заняття, що має нетрадиційну (невстановлену) структуру. Думки педагогів на нестандартні уроки розбігаються: одні бачать в них прогрес педагогічної думки, правильний крок в напрямку демократизації школи, а інші, навпаки, вважають такі уроки небезпечним порушенням педагогічних принципів, змушеним відступом педагогів під напором “обленившихся” учнів, не що бажають і не що уміють серйозно працювати.
Аналіз педагогічної літератури дозволив виділити декілька десятків типів нестандартних уроків. Їхні назви дадуть деяке поняття про мету, задачі, методику проведення таких занять. Перерахуємо найбільш розповсюджені типи нестандартних уроків.
| 1. Уроки-занурення 2. Уроки-ділові ігри 3. Уроки-прес-конференції 4. Уроки-змагання 5. Уроки типу КВК 6. Театралізовані уроки 7. Уроки-консультації 8. Комп’ютерні уроки 9. Уроки з груповими формами роботи 10. Уроки взаємонавчання учнів 11. Уроки творчості 12. Уроки-аукціони 13. Уроки, що ведуть учні 14. Уроки-заліки 15. Уроки-сумніви 16. Уроки-творчі звіти 17. Уроки-формули 18. Уроки-конкурси 19. Бінарні уроки 20. Уроки-узагальнення 21. Уроки-фантазії 22. Уроки-ігри 23. Уроки-суди 24. Уроки пошуку істини | 25. Уроки-лекції «Парадокси» 26. Уроки-концерти 27. Уроки-діалоги 28. Уроки «Слідство ведуть знавці» 29. Уроки-рольові ігри 30. Уроки-конференції 31. Уроки-семінари 32. Інтегральні уроки 33. Уроки-»кругове тренування» 34. Уроки «Мозкова атака» 35. Уроки-екскурсії 36. Уроки-ігри «Поле чудес» 37. Уроки-подорожі 38. Уроки-суспільний огляд знань 39. Уроки-інтерв’ю 40. Уроки-презентації 41. Уроки-казки 42. Уроки-захист дисертації 43. Уроки-аналіз першоджерел 44. Уроки-диспути 45. Уроки типу “Що? Де? Коли?” 46. Уроки-ерудиціони 47. Уроки спектаклі 48. Уроки-заліки |
От як організовує їх М. В. Смирнова – вчитель фізики 19-ї московської спецшколи. Мета уроку – закріплення вмінь вирішувати задачі різних типів. Заздалегідь формуються команди і журі. Журі підбирає задачі, готує обладнання для розв’язування експериментальних задач і матеріал для стислих повідомлень з теми. Починається урок з одного такого повідомлення (робить член журі); після цього – розминка (розв’язання командами якісних задач; демонструється дослід – вимагається його пояснити); далі – конкурс капітанів (розв’язання експериментальних задач); в цей час заслуховують ще одне повідомлення. Потім – конкурс команд: самостійне «на час» розв’язання розрахункових задач. Завершується урок підведенням підсумків і оголошенням команди-переможця.
Уроки типу КВК
Ці форми уроку «прийшли» з позакласних занять і стали популярними. Область їхнього застосування – здебільшого повторення тем і розділів.
От як проводить такий урок учителька 21-ї челябінської середньої школи І. А. Волкова в VI класі. Змагання складається з п’ятих конкурсів-етапів.
I етап – розминка. Завдання: скласти оповідання з пройденої теми; один учень починає оповідання, другий продовжує і т. д.
II етап – конкурс «Перевірка домашнього завдання». Потрібно зіграти сценку, де відбито все головне в темі.
ІІІ етап – розв’язання задач з вибором відповіді.
IV етап – конкурс «Відгадай». Один учень з команди виходить з класу, а коли повертається, інші прикладами і натяками підказують, яке хімічне поняття, що входить в дану тему, було загадано (наприклад, «молекула»).
V етап – конкурс «артистів» і «митців». «Митці» команди виходять за двері. Демонстратор показує експеримент і пояснює його. Запрошує «митця», і для нього «артист» пантомімою зображає дослід; «митець» повинен його узнати і зобразити малюнком.
Заключний етап – підведення підсумків.
Підготовка вчителя до уроку (2 години)
Етапи підготовки вчителя до уроку: вивчення вимог програми, ознайомлення з текстом підручника; опрацювання методичної літератури, формулювання мети і завдань уроку; вибір методів навчання; підготовка засобів навчання; розробка плану, написання конспекту.
План навчального заняття та вимоги до нього. Складові елементи і форма плану навчального заняття. Приклади планів (короткого і поширеного) навчальних занять.
Конспект навчального заняття, вимоги до його змісту. Зразки конспектів уроків та інших видів навчальних занять.
Спостереження й аналіз навчального заняття.
13.Методичні рекомендації щодо формування понять про класи неорганічних сполук
У темі «Кисень. Оксиди. Горіння» формується поняття про оксиди через накопичення чуттєвих і образних уявлень, що зумовлює індуктивний шлях до набуття знань.
Перш ніж почати вивчати оксиди, необхідно визначити, які знання про них повинні набути учні.
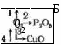
Опорним є поняття про хімічні властивості кисню. Для відтворення знань учні виконують завдання: 1. Здійсніть перетворення:
Напишіть відповідні хімічні рівняння. Назвіть продукти реакцій. Визначте їх тип.
2. Напишіть рівняння реакцій окислення складних речовий: сірководню Н2S, фосфіну РН3, метану СН4, ацетилену С2Н2. Продуктами кожної реакції є оксид відповідного неметалу і вода.
3. Зробіть висновок про добування оксидів. Пригадайте досліди, виконані на минулих уроках, і назвіть ознаки утворення оксиду сірки (IV) SO2, оксиду вуглецю (IV) СO2, оксиду заліза (III) Fе2Оз. Яке визначення можна дати оксидам?
Учні роблять висновок про те, що оксиди утворюються внаслідок реакцій окиснення як простих, так і складних речовин. Вони самостійно дають визначення оксидам.
Таким чином, на першому етапі учні одержують знання про добування оксидів.
На другому етапі висловлюється думка про необхідність класифікації оксидів. Основне питання, яке розв'язують учні, таке: За якою ознакою виділяють оксиди серед інших сполук і як можна класифікувати оксиди? Яку класифікаційну ознаку можна взяти за основу?
Відповіді передує виконання вправ:
1. Проаналізуйте формули речовин і випишіть з них формули оксидів: Н2О, НС1, SO2, SO3, NаСl, NaOH, Сu2O, СuО.
2. Як можна класифікувати оксиди, формули яких ви виписали?.
3. Випишіть оксиди неметалів в один стовпчик, оксиди металів –у другий. Що спільного в їх формулах і в чому різниця? Зробіть припущення про класифікацію оксидів за їх складом, відобразіть це у схемі.
Учні роблять висновок про те, що основною класифікаційною ознакою оксидів є наявність в молекулі двох елементів, один з яких кисень, а ознакою поділу оксидів за складом молекул є наявність елемента металу чи неметалу. Як наслідок обговорення даного питання вони складають узагальнюючу схему:

Потім учні виконують вправи на складання формул оксидів за валентністю елементів, у тому числі елементів із змінною валентністю, навчаються номенклатурі оксидів. Закріплюють знання про склад оксидів, виконуючи лабораторний дослід «Ознайомлення із зразками оксидів».
В узагальнюючому висновку вчитель підкреслює, що всі різноманітні оксиди об'єднуються в один клас – клас оксидів, бо всі вони мають подібний склад молекул. Це дає змогу відрізнити їх від інших класів неорганічних сполук. Таке співвідношення порівнюють з класифікацією у біології, коли окремі особини об'єднуються у вид, вид – у рід, рід – у родину і т. д.
У темі «Водень. Кислоти. Солі» учні відразу знайомляться з двома новими класами неорганічних сполук – кислотами і солями.
Розглядаючи способи добування водню в лабораторії, учні ознайомилися з реакціями цинку з соляною і сірчаною кислотами. їм відомо, що до складу молекул кислот обов'язково входять атоми водню. За цією ознакою вони відрізняють формули кислот від формул інших речовин. Ось чому вивчення кислот можна розпочати з виконання завдання на розпізнавання їх формул. Виходячи зі складу молекул, учням пропонують дати визначення кислотам. Визначення на цьому етапі може бути таким: кислоти – складні речовини, до складу молекул яких входять атоми водню, здатні заміщуватись на метал, і кислотний залишок. Далі, як і під час вивчення оксидів, розглядають класифікацію кислот. Учитель пропонує учням самостійно знайти основні ознаки класифікації кислот. Насамперед учні звертають увагу на наявність елемента кисню в молекулах деяких кислот і разом з учителем класифікують кислоти за складом на кисневмісні і безкисневі. Записують відповідні приклади.
На класифікацію кислот за основністю учні здебільшого виходять після навідного запитання: Чи може кількість атомів водню у молекулі кислоти бути класифікаційною ознакою? Після обговорення роблять узагальнюючий висновок про класифікацію кислот на одно-, двох- і трьохосновні за кількістю атомів водню, здатних заміщуватися на метал, і наводять приклади.
Для вивчення фізичних властивостей кислот використовують знання учнів про кислоти з побуту: оцтову, лимонну, молочну, яблучну, соляну та ін. Бесіду спрямовують таким чином, щоб виявити таку загальну властивість, як кислий смак їхніх розчинів. Учитель попереджає, що пробувати на смак кислоти не можна, і пояснює чому. Демонструючи кислоти, зауважують, що багато які кислоти (НС1, Н2SO4, НNО3) – безбарвні рідини. Відомі тверді кислоти – Н3РО4,НРO3. Майже всі кислоти, крім Н2SіО3, розчиняються у воді.
Із загальних хімічних властивостей кислот розглядають їх дію на індикатори. З Цією метою проводять лабораторний дослід «Дія розчинів кислот на індикатори». Встановлюють, що розчини кислот змінюють забарвлення індикаторів. Записують у зошити, якого кольору набувають лакмус і метиловий оранжевий у розчинах кислот. Далі розглядають таку характерну властивість кислот, як їх здатність взаємодіяти з деякими металами. Учні виконують лабораторні досліди «Відношення кислот (соляної, сірчаної) до металів (заліза, цинку, міді)». (Для дослідів беруть розчини кислот.) Перед виконанням лабораторних дослідів увагу учнів спрямовують на такі запитання: 1. Чи всі метали взаємодіють з кислотами? 2. Чи однаково активно відбуваються реакції між кислотами і металами?
Спостереження за дослідами учні заносять у таку таблицю:
| Метал | Кислота | Рівняння реакції | Тип реакції | |
| соляна | сірчана | |||
| Zn Fe Сu |
Знаком « + » позначається перебіг реакції, знаком «—»– її відсутність. Поряд записується ознака реакції. Учні разом з учителем розміщують метали у ряд за їх активністю по відношенню до кислот: Zn,Fе, Сu, формулюють висновки у відповідності з поставленими запитаннями. Не всі метали з однаковою активністю взаємодіють з кислотами. Для пояснення цього положення формується поняття про витискувальний ряд металів. Можна коротко розповісти про те, хто його склав і як ним користуватися для визначення тих металів, які можуть заміщати водень у кислотах. Зауважують, що від активності металу і властивостей кислоти залежить активність перебігу реакції між ними. На прикладі взаємодії кислот з металами закріплюються знання учнів про реакції заміщення.
Вивчення взаємодії кислоти з оксидами металів також починається з виконання відповідного лабораторного досліду. Особливість цієї реакції в тому, що вона належить до реакції обміну. Цей тип реакцій іде не вивчали. Тому вчитель шляхом бесіди обговорює з учнями, які речовини за складом реагують між собою і які при цьому утворюються. Формулюється визначення реакцій обміну. Учні самостійно складають відповідне рівняння, після чого вчитель пропонує виразити його у загальному вигляді.
Зіставляють реакції кислот з металами і з оксидами металів спочатку на конкретних прикладах, а потім на загальних схемах. Для конкретних прикладів доцільно брати метал і відповідний йому оксид, напри» кладметал магній і оксид магнію. Обговорюють при цьому такі питания:
1. Що спільне у цих реакціях? 2.Чим різняться між собою реакції? 3.Яке визначення кислот можна було б дати на основі їх взаємодії з металами або оксидами металів? 4. З якою властивістю оксиду металу ви ознайомилися?
Завершують вивчення кислот на цьому етапі узагальненням знань про загальні і особливі властивості кислот складанням узагальнюючої схеми:

2. Покажіть за допомогою рівнянь реакцій, як можна реалізувати наведену схему:
Метал Оксид металу Сіль
На прикладі реакцій кислот з металами і оксидами формується поняття про солі. Хімічні властивості солей поки ще не розглядають. Зупиняються на визначенні солей, виходячи з їх складу (якісна характеристика), та відпрацьовують уміння складати формули кислот за валентністю металів та кислотних залишків, ознайомлюються з номенклатурою солей. Інформацію про формули і назви кислот і солей записують у таблицю, самостійне складання якої полегшує усвідомлення учнями матеріал:
| Кислоти | Солі | ||||
| Формула | Кислотний залишок | Назва | Формула | Кислотний залишок | Назва |
Контроль знань і вмінь учнів і самоперевірка за складанням формул кислот і солей за їх назвами або навпаки можуть бути здійснені за допомогою відповідних дидактичних карток або знакових моделей на магнітній основі. Відомо, що уміння складати формули виробляється системою вправ.
Поняття про основи учні дістають під час вивчення теми «Вода. Розчини. Основи». Опорними для введення поняття «основи» є знання про взаємодію води з активними металами і основними оксидами активних металів, внаслідок якої утворюються розчинні основи (луги). Від визначення поняття «луги» переходять до написання формул основ і їх назв, а потім до вивчення властивостей основ. Спочатку розглядають фізичні властивості окремих основ, виконуючи лабораторний дослід «Ознайомлення з властивостями гідроксидів натрію, кальцію, міді (II) або заліза (III)» Поряд з агрегатним станом, кольором, запахом досліджують розчинність їх у воді. Проводять класифікацію основ за розчинністю у воді.
Складання таблиці допомагає учням установити, фенолфталеїн е специфічним реактивом на луг. Для закріплення знань учитель проводить лабораторну спробу на розпізнавання кислот і лугів за допомогою індикаторів. Результати дослідів обговорюються з учнями. Учитель запитує: 1. Чи можна дію індикаторів на луги вважати їх загальною властивістю? 2, Чому всі луги змінюють однаково забарвлення індикаторів? Відповідь на перше запитання показує, як учні засвоюють різницю між загальними і особливими (специфічними) властивостями, на друге - як вміють виділяти головне, саме те, що наявність гідроксогрупи в усіх лугах зумовлює подібність у їхніх властивостях.
Учитель продовжує: у складі лугів і нерозчинних основ є гідроксогрупа. Тому луги і нерозчинні основи повинні мати і спільні властивості. Запитує, чи згодом з цим учні. Як доказ пропонує учням провести два лабораторних досліди: «Взаємодія лугів з кислотами» 1 «Взаємодія нерозчинних основ з кислотами» і зробити відповідні конкретні висновки, записавши рівняння реакцій, в тому числі і в загальному вигляді:

Хімічні властивості основ вивчають, порівнюючи між собою луги і нерозчинні основи. Насамперед розглядають їх відношення до індикаторів. Лабораторним шляхом перевіряють дію лугів на фенолфталеїн, індикатор, ще не відомий учням. Крім того, випробовують дію лугу на фіолетовий лакмус і метиловий оранжевий. Особливо наочно ці досліди відбуваються під час демонстрування їх через графопроектор. Порівнюють дію одних і тих самих індикаторів на розчини кислот і лугів і результати записують у таку таблицю:
| Індикатори | Нейтральне середовище | Класи речовин | |
| кислоти | основи (луги) | ||
| Лакмус Метиловий оранжевий Фенолфталеїн | Фіолетовий Оранжевий Безбарвний | Червоний Рожевий Безбарвний | Синій Жовтий Малиновий |
Визначають тип реакції — це реакція обміну. Потім характеризують реакцію обміну між основами і кислотами як реакцію нейтралізації, розкриваючи суть терміна «нейтралізація».
Переходять до розгляду реакцій між лугами і кислотними оксидами. Можна висловити припущення про можливість такої реакції. Для доказу проводять – демонстраційний дослід «Взаємодія оксиду вуглецю (IV) з розчином гідроксиду кальцію і твердим гідроксидом натрію». Учні переконуються, що луги, як у розчині, так і в твердому стані, реагують з оксидами неметалів, утворюючи сіль і воду. Нерозчинні основи не вступають в реакцію обміну з кислотними оксидами. Тому реакція між лугами і кислотними оксидами належить до специфічних, бо вона не характерна для всіх основ.
Після розгляду цих реакцій пригадують, що основні оксиди взаємодіють з кислотами. Продуктами реакцій в обох випадках є сіль і вода. Таким чином, початкові уявлення про оксиди завдяки вивченню властивостей кислот і основ розвиваються. За наслідками порівняння взаємодії оксидів з кислотами і лугами учні складають схему:

Нарешті розглядають відношення основ до нагрівання. З цією метою проводять лабораторний дослід «Розклад гідроксиду міді (II) під час нагрівання» і перевіряють дію нагрівання на кристалічний гідроксид натрію або кальцію. Зіставляючи досліди, роблять висновок про те, що лише нерозчинні основи розкладаються під час нагрівання. Тому ця властивість основ також є особливою, а не загальною. Закріплюючи знання учнів, складають узагальнюючу схему (див. схему 13).
Завершують вивчення основ відомостями про їх добування. Для цього пропонують учням відповісти на таке запитання: Які хімічні властивості води можна використати для добування основ? Називають дві властивості – взаємодію активних металів (К, Nа, Са) та їх оксидів з водою. Роблять висновок, що згідно з цим існують два способи добування лугів. Підкреслюють, що не всі оксиди металів реагують з водою, а лише ті, яким відповідають розчинні основи – луги.
Систематизація і закріплення знань учнів про основи, а разом з ними і про оксиди і кислоти, відбувається на семінарському занятті. Завдання передбачають різний рівень розвитку пізнавальної діяльності учнів, тому можна виділити 3 групи завдань.
Перша група – завдання, спрямовані на репродуктивну діяльність учнів: дати визначення основ (оксидів, кислот, солей), записати загальні формули, навести конкретні приклади, класифікувати їх за складом, назвати основні властивості певного класу речовин.
Друга група – завдання, що передбачають продуктивну діяльність учнів: виділити загальні і специфічні властивості основ (оксидів, кислот) і пояснити, чим вони зумовлені, розкрити на конкретних прикладах, як склад речовин впливає на їх властивості, здійснити перетворення у межах певного класу, наприклад (у загальному вигляді):

Третя група – завдання творчого характеру, розраховані на застосування знань у нестандартних умовах. Наприклад, здійснити перетворення і висловити припущення про взаємозв'язок між речовинами:

Завершити узагальнення знань про основи можна відповіддю на таке запитання: Чому всі речовини поділяються на класи і яка їх основна класифікаційна ознака? Це запитання є перехідним до узагальнення відомостей про найважливіші класи неорганічних сполук.
18.періодичний закон д.і. менделєєва, періодична система хімічних елементів і теорія будови атома
Завдання вивчення теми. У процесі вивчення теми «Періодичний закон і періодична система Д.І. Менделєєва. Будова атома» розв'язується комплекс взаємопов'язаних освітніх, виховних і розвиваючих завдань.
Освітні завдання. Під час вивчення періодичного закону насамперед слід довести до розуміння учнів його зміст, сутність періодичної зміни властивостей хімічних елементів та їх сполук залежно від зростання відносних атомних мас та зарядів ядер атомів, розкрити причини періодичності. Встановити закономірності періодичної системи хімічних елементів, яка є теоретичним узагальненням і природною класифікацією всіх знань про елементи. Довести до свідомості учнів уявлення про те, що об'єктивно існуючий взаємозв'язок між хімічними елементами підлягає періодичному закону і відображений у періодичній системі. Удосконалити уміння аналізувати, порівнювати властивості хімічних елементів та характер відповідних їм оксидів, встановлювати причинно-наслідкові зв'язки, застосовувати теоретичні знання для прогнозування невідомих простих та складних речовин на основі знань про будову атомів хімічних елементів.
Виховні завдання. Вивчення періодичного закону і періодичної системи вносить істотний вклад у формування діалектико-матеріалістичних поглядів і переконань. Учням слід розкрити ідею матеріальної єдності хімічних елементів та речовин, внутрішню суперечливість у будові атомів елементів, значення цих протиріч для хімічних перетворень речовин. Важливо показати, що періодичний закон є загальним законом розвитку природи, а періодична система – величезним узагальненням хімічних знань про елементи і утворені ними речовини. Учитель ілюструє на конкретних прикладах прогнозуючу функцію теоретичних знань для розвитку сучасної науки і виробництва, підводить учнів до висновку про пізнаванність світу. При вивченні творчої діяльності Д. І. Менделєєва формує в учнів повагу до праці вченого, почуття патріотизму та національної гордості.
Під час вивчення цієї теми у курсі загальної хімії доводиться до розуміння учнями підтвердження найбільш загальних законів розвитку природи – закону єдності і боротьби протилежностей, закону переходу кількості в якість, закону заперечення-заперечення.
Розвиваючі завдання. Зміст теми значною мірою сприяє розвитку навчально-пізнавальних можливостей учнів. Передусім вчитель розвиває в учнів уміння виділяти головне, суттєве, навчає їх оперувати дедуктивними умовиводами, аналізувати, зіставляти властивості хімічних елементів та їх сполук на основі виявлених закономірностей, сприяючи тим самим розвитку логічного мислення учнів. Застосування проблемного підходу сприяє розвитку пізнавального інтересу школярів.
Для успішного розв'язання завдань навчання, виховання і розвитку учнів учитель повинен глибоко проаналізувати структуру понять теми, на яких ґрунтується її вивчення (табл.).
| Опорні поняття | Основні поняття і уявлення, що формуються | ||
| Міжпредметні | Внутрішньо-предметні | Нові | Перспективні |
| Атоми Молекули Ядерна модель атома Будова атомів водню, гелію, літію Фізичний зміст порядкового номера Будова електронних оболонок атомів Електрон Протон Нейтрон | Проста речовина Метал Неметал Складна речовина Оксид Гідроксид Хімічний елемент Валентність Класифікація основних класів неорганічних сполук Поняття про група подібних елементів Фізичні та хімічні властивості речовин | Амфотерний оксид Амфотерний гідроксид Порядковий (атомний) номер елемента Періодичність Заряд ядра атома Ізотоп Електронна оболонка Період: малий, великий Підгрупа: головна, побічна Перетворення хімічних елементів | Амфотерні оксиди та гідроксиди Природні родини типових металів Природні родини типових неметалів Періодична система Будова електронних оболонок атомів елементів малих та великих періодів: s-, p-, d-, f-елементи Періодична зміна в періодах і групах властивостей атомів елементів (радіуса, енергії, іонізації тощо) |
Диференційований підхід дає змогу виділити чотири групи понять: міжпредметні поняття, внутрішньопредметні поняття, нові поняття та перспективні поняття. Зрозуміло, що міжпредметні та внутрішньопредметні поняття становлять коло необхідних опорних знань, які вчитель актуалізує для свідомого сприймання періодичного закону і періодичної системи. Відомо, що протягом вивчення теми ці поняття розвиваються і вдосконалюються, збагачуються новими якісними і кількісними характеристиками. Одночасно формуються і нові поняття, частина з яких, так званих перспективних понять, розвивається і вдосконалюється. Обмірковуючи методику вивчення цієї навчальної теми, вчитель повинен враховувати наступність у формуванні відповідних понять.
Періодичний закон і теорія будови атома як науково-теоретична основа шкільного курсу хімії. Відкриття періодичного закону і створення системи хімічних елементів збагатило людство знанням однієї з фундаментальних закономірностей природи. Д.І. Менделєєв відхилив метафізичний погляд на елементи як на відокремлені і незалежні одна від одної форми матерії. Створивши періодичну систему хімічних елементів, він довів, що ми маємо справу з розвитком єдиної матерії при нескінченній різноманітності форм її існування. Періодичний закон і періодична система хімічних елементів відкрили шлях до пізнання будови матерії і її взаємозв'язку з фізичними і хімічними властивостями речовин. Надзвичайно розширилися наші уявлення про будову речовини.
Відкриття періодичного закону значною мірою сприяло розвитку хімії, поставило науку на міцний науковий фундамент і разом з іншими відкриттями привело до створення теорії будови атома. Ця теорія дала можливість глибше розкрити природу атома і пояснити закономірності періодичної системи. Періодичний закон – загальний закон природи. Періодична система хімічних елементів лежить в основі розв'язання сучасних завдань хімічної науки і промисловості.
На основі періодичного закону і періодичної системи успішно розвиваються геохімія, геологія, космохімія, ядерна фізика.
Враховуючи принцип відповідності навчального матеріалу рівню сучасної науки, неважко зрозуміти, чому періодичний закон і періодична система розкриваються у світлі електронної теорії, виступають науково-теоретичною основою шкільного курсу хімії і посідають у ньому центральне місце. Під час вивчення цієї навчальної теми учитель має можливість переконливо показати значення теорії в розвитку науки, її прогнозуючу роль у дослідженні і цим самим сприяти формуванню погляду на хімію як науку. У періодичній системі учні вбачають прояв могутності людської думки, значення наукового передбачення.
Слід підкреслити, що вивчення періодичного закону важливе ще й тому, що він виступає не лише науково-теоретичною, але й методичною основою вивчення шкільного курсу хімії. Відомий радянський методист К.Я. Парменов відзначав: «Розташування навчального матеріалу на основі періодичного закону і періодичної системи елементів не лише повною мірою забезпечує можливість його логічного розгортання... воно дає можливість учневі зрозуміти зміст курсу і навіть, більше того, не тільки свідомо засвоїти матеріал, який підлягає вивченню, але й оволодіти ним». Після вивчення періодичної системи змінюється характер викладання курсу хімії; нові факти співвідносяться із закономірностями, що передбачені системою, на допомогу пам'яті все частіше приходять умовиводи, дедукція займає належне місце поряд з індукцією. Все це можливо завдяки пояснювальній, узагальнюючій і прогнозуючій функціям, які виконує періодичний закон як методична основа вивчення хімії в середній школі. А тому вчителі особливо ретельно готуються до вивчення цієї теми, розуміючи наукову і дидактичну вагомість її як найбільш відповідальної частини всього шкільного курсу хімії.
Характеристика методичних підходів до вивчення теми. Підготовка учнів до свідомого сприймання періодичного закону. Особливості функцій, які відіграє періодичний закон у навчанні хімії, вимагають ретельного обґрунтування місця його вивчення у шкільному курсі хімії. Насамперед слід знайти відповідь на такі запитання: Коли найкраще вивчати періодичний закон? Яким повинен бути зміст попередньої підготовки, щоб сприймання його учнями було свідомим?
Історія розвитку викладання шкільного курсу хімії свідчить про існування різних думок з цього приводу. Одна частина вчителів та методистів вважає, що вивченню періодичного закону повинно передувати нагромадження можливо більшої інформації про елементи та їх сполуки для того, щоб вивчення періодичного закону було достатньо переконливим. Переоцінка такого підходу в старих програмах мала своїм наслідком методичну помилку, згідно якої періодичний закон вивчався на завершення курсу як узагальнення, а всі елементи та їх сполуки – до нього. Теорія будови атома вивчалася як переконливе підтвердження його об'єктивності. При такому варіанті учні не могли засвоїти електронну теорію і скористатися нею для пояснення суті хімічних процесів. Більша частина курсу вивчалася учнями без знання періодичної системи, що свідчило про ігнорування такої функції періодичного закону, як засобу навчання. Все це значно знижувало науковий рівень шкільного курсу хімії.
Інші вважають, що періодичний закон і періодичну систему слід вивчати якомога раніше, після ознайомлення з невеликою кількістю елементів і навіть перед вивченням груп хімічних елементів. При такому підході значно посилюється його функція як засобу навчання. Але в той же час досить раннє вивчення закону, перенесення його на самий початок курсу без достатньої бази фактичного матеріалу може призвести до формальних знань, догматичного сприймання періодичного закону і як результат до негативного впливу на засвоєння хімії як навчального предмета.
Аналіз розвитку шкільної хімічної освіти дає змогу зробити висновок про те, що згідно з принципом провідної ролі теорії у навчанні має місце тенденція наближення періодичного закону до початку курсу. Вона спрямована насамперед на посилення теоретичного рівня змісту, функції пояснення, узагальнення та передбачення.
За сучасною програмою вивчення періодичного закону передує вивченню хімічних елементів та їх сполук. В той же час у структурі курсу є так званий підготовчий етап, на якому здійснюється підготовка учнів до виведення періодичного закону. Які ж знання слід вважати з цього приводу опорними? З менделеєвського формування періодичного закону випливає, що учні повинні знати передусім властивості простих речовин, тобто елементів у вільному стані. Оскільки ці властивості необхідні для порівняння і зіставлення закономірностей в їх змінах, то бажано, щоб вони мали як якісну, так і кількісну характеристики. Якісна характеристика передбачає знання відношення речовин до кисню, водню, металів. Важливо знати порівняльну активність цих елементів, склад і характер вищих солетворних оксидів, гідроксидів, а також їхніх сполук з воднем. До кількісної характеристики речовий слід віднести: відносну атомну масу, валентність їх у сполуках з воднем та киснем.
Перед вивченням періодичного закону учні ознайомлюються детальніше з двома хімічними елементами – воднем та киснем і дещо поверхнево з такими металами і неметалами, як залізо, цин, магній, кальцій, натрій, фосфор, сірка, вуглець. Учні мають уявлення про характер їх оксидів і гідроксидів. Але ці знання не є достатніми. Для з'ясування умовності поділу елементів на метали і неметали учні повинні володіти уявленнями про амфотерні оксиди і гідроксиди. Тому важливо підкреслити, що у підготовці учнів до свідомого засвоєння періодичного закону особливого значення набуває вивчення класів неорганічних сполук, узагальнення і систематизація відомостей про них на рівні атомно-молекулярного вчення. При цьому закладаються уявлення про причини різноманітності речовин, формується загальнонаукове поняття «класифікація», розвиваються уміння встановлювати істотні ознаки, що лежать в основі класифікації неорганічних сполук, забезпечується засвоєння положень про генетичний зв'язок речовин, про причинно-нacлідкову залежність між природою хімічних елементів і властивостями утворених ними простих речовин, оксидів і гідроксидів. В учнів виробляються уміння складати генетичний ряд хімічного елемента, прогнозувати властивості сполук, які його утворюють.
Важливо пояснити учням, що всі класифікації об'єктивні і в той же час відносні. Так, при обговоренні генетичних рядів елементів-металів і елементів-неметалів учні приходять до висновку про те, що хімічні елементи, які утворюють амфотерні оксиди і гідроксиди, є «родоначальниками» особливих генетичних рядів. Це ряди хімічних елементів, які виявляють перехідні хімічні властивості, тобто за хімічними властивостями їх не можна віднести ні до типових металів, ні до типових неметалів. Вони і зв'язують елементи-метали і елементи-неметали. Робиться висновок про відсутність в природі різкої межі між явищами. Цей зв'язок генетичних рядів відображають схематично:
Робиться висновок, що у природі спостерігається поступовий перехід від металів до неметалів. Для всієї подальшої роботи з розкриття суті періодичної зміни властивостей хімічних елементів і відповідних їм сполук важливо, щоб учні засвоїли взаємозв'язок, який можна зобразити схемою: проста речовина хімічний елемент хімічна сполука
Ця ідея розвивається і на наступному етапі підготовки учнів до засвоєння періодичного закону – формуванні знань про існування природних родин хімічних елементів, об'єднаних в них за ознакою подібності властивостей і характеру утворених ними хімічних сполук і простих речовин.
Програма орієнтує дати перші поняття про природні групи елементів на прикладі таких родин, як лужні метали, галогени, благородні гази. Зокрема, учні ознайомлюються з фізичними властивостями лужних металів, із зміною цих властивостей, із зростанням відносних атомних мас. Під час вивчення хімічних властивостей лужних металів розглядається взаємодія їх з водою, киснем, записуються відповідні рівняння реакцій. Учнів підводять до висновку про те, що із зростанням відносних атомних мас хімічних елементів відбувається закономірна зміна не тільки фізичних, але й хімічних властивостей лужних металів. Підкреслюючи спільність хімічних властивостей лужних металів, учитель наголошує, що про причини явища учні дізнаються пізніше.
Порядок вивчення групи галогенів приблизно такий самий: спочатку, демонструючи галогени, відмічають ознаки подібності і відмінності їх за фізичними властивостями, потім розглядають у порівняльному плані їх відношення до водню і металів. Бажано, щоб висновок про зменшення хімічної активності галогенів відносно водню і натрію у зв'язку із зростанням відносної маси галогену учні зробили самостійно.
Потім учитель коротко повідомляє і про природну родину – благородні гази, утворену інертними елементами. Зазначаючи властивості металів і неметалів у зв'язку із зміною відносних атомних мас цих елементів, формують поняття про їх природні групи, що значною мірою полегшить свідоме виведення періодичного закону самими учнями.
Співвідношення історичного і логічного підходу у різних варіантах вивчення періодичного закону. Зміст теми «Періодичний закон і періодична система хімічних елементів Д.І. Менделєєва. Будова атома» включає, з одного боку, відомості про періодичну зміну властивостей елементів і речовин в залежності від зростання відносних атомних мас елементів, а з другого – відомості про будову атомів елементів. Розкрити причинно-наслідкові зв'язки між цими компонентами змісту, суть періодичного закону на його фізичній основі – електронній теорії – головна освітня мета вивчення даної теми. Яким же чином досягається ця мета? Як узгодити класичне менделєєвське і сучасне формулювання періодичного закону? Яке співвідношення історичного і логічного підходу можливе у різних варіантах вивчення періодичного закону? Як це позначається на побудові висвітлення теми? Насамперед підкреслимо, що таких варіантів існує кілька.
Перший варіант послідовності вивчення періодичного закону і періодичної системи та електронної теорії будови атома відповідає історії відкриття закону і розробки електронної теорії. Згідно з цим варіантом спочатку вивчають періодичний закон і періодичну систему на основі лише відносних атомних мас, а потім вводять уявлення про будову атома, після чого знову переходять до періодичної системи вже на цій теоретичній основі. Переоцінювання у цьому випадку принципу історизму призводить до дублювання матеріалу, значних витрат часу, зниження інтересу до предмета.
За другим варіантом вивчення будови атома передує вивченню періодичного закону і періодичної системи. Останні вивчаються вже на основі електронної будови атома. В даному разі повністю ігнорується принцип історизму, що теж негативно позначається на виховній і розвиваючій функціях навчання. Адже успішна розробка електронної теорії стала можливою завдяки тому, що періодична система Д.І. Менделєєва спрямувала пошуки причин періодичності і тим самим стимулювала розвиток науки. Розкриття історичних закономірностей допомагає учням сприймати хімію як систему знань, що розвиваються, збагнути безмежність хімічного пізнання. Учні повинні зрозуміти ціну знань і відкриттів, побачити за цим боротьбу ідей і поглядів, подолання протиріч, наукові подвиги вчених.
Два зазначені варіанти відрізняються між собою переоцінюванням то історичного, то логічного підходів до вивчення періодичного закону.
При побудові змісту теми у сучасній програмі використаний третій, так званий історико-логічний підхід. Згідно з ним учні переконуються спочатку у виявленій Д.І. Менделєєвим залежності властивостей хімічних елементів і речовин від величини відносних атомних мас елементів, потім розкриваються причина цієї залежності, а також структура періодичної системи на основі будови атомів елементів. Історико-логічний підхід, з одного боку, створює оптимальні умови для організації пошукової діяльності учнів, оскільки дає змогу відтворити на уроках проблеми, що виникали в процесі розвитку наукових знань, і тим самим активізує навчальний процес. З другого – дає можливість перейти до вивчення ряду питань відразу ж із сучасних позицій, орієнтуючись на логічні зв'язки навчального матеріалу, повною мірою розкрити науковий подвиг Д.І. Менделєєва, який відкрив періодичний закон лише на основі порівняння відносних атомних мас елементів і хімічних властивостей речовин.
Впровадженню саме цього варіанта вивчення періодичного закону в шкільну практику сприяло те, що напередодні вивчення періодичного закону в курсі фізики учні ознайомлюються з електронною будовою атома і цілим комплексом понять, пов'язаних з нею, які у курсі хімії використовуються як опорні міжпредметні поняття. Саме на цьому варіант ті вивчення періодичного закону і періодичної системи ми зупинимося детальніше.
Побудова теми «Періодичний закон і періодична система хімічних елементів д.І. Менделєєва» у шкільній програмі. Згідно з третім варіантом вивчення тема починається з актуалізації внутрішньопредметних понять, з якими учні ознайомилися у вступній частині курсу, необхідних для розуміння явища періодичності. Водночас, як уже зазначалося, відбувається збагачення цих понять новими. До них насамперед належить поняття амфотерності та груп подібних елементів. Робляться висновки про недосконалість класифікації елементів на метали і неметали і при цьому акцентується увага учнів на тому, що в пошуках більш досконалої класифікації вчені намагалися згрупувати елементи згідно з їхніми властивостями, в чому учні переконалися, ознайомившись з природними родинами лужних металів, галогенів та благородних газів.
Учням повідомляють про доменделєєвські спроби класифікації елементів, зроблені німецьким хіміком й. Деберейнером (1829), англійським хіміком Дж. Ньюлендсом (1864) і німецьким хіміком Л. Мейєром (1864), який найближче підійшов до відкриття періодичного закону. Робиться наголос на тому, що ні одна із цих спроб не привела до створення природної системи, яка б охоплювала всі хімічні елементи, відображала природу їх подібності й відмінності, відкривала можливості передбачення властивостей ще не відомих елементів. Це завдання вдалося розв'язати лише нашому вітчизняному вченому Д.І. Менделєєву.
На відміну від своїх попередників, які відчували існування якоїсь закономірності, але були неспроможні її встановити, Д.І. Менделєєв був переконаний у тому, що між всіма хімічними елементами повинен існувати закономірний зв'язок і що в основу класифікації повинна бути покладена фундаментальна кількісна характеристика елемента – його відносна атомна маса. Зауважують, що знайти таку закономірність було нелегко. Далеко не всі елементи були відомі на той час, а відносні атомні маси деяких з них не були точними, і їх формальне зіставлення призводило до непорозумінь.
Слід виділити думку і про те, що, на відміну від своїх попередників, російський вчений порівнював між собою і не подібні елементи. Учням пропонується скористатися прийомом, який застосував Д.І. Менделєєв, і розмістити всі елементи від водню до криптону у порядку зростання відносних атомних мас. Номер, який одержує кожний елемент, називаємо порядковим номером. За періодичною таблицею з учнями порівнюють властивості простих речовин, склад і властивості оксидів і гідроксидів, утворених елементами 2-го та 3-го періодів, а також валентність у кисневих і водневих сполуках.
На основі роботи з таблицею вчитель підводить учнів до таких висновків:
1. У ряду від літію до фтору із зростанням відносних атомних мас спостерігається поступове послаблення металічних і посилення неметалічних властивостей елементів.
2. Із зростанням відносних атомних мас від літію до вуглецю валентність у сполуках з киснем збільшується від 1 до 4. Починаючи з вуглецю, у елементів цього ряду утворюються леткі сполуки з воднем. Валентність у сполуках з воднем зменшується від 4 у вуглецю до 1 у фтору.
3. Починаючи з елемента № 11 (натрій), спостерігається повторення властивостей елементів попереднього ряду. Аналогічно і валентність у сполуках з киснем зростає від 1 у елемента натрію до 7 у елемента хлору. Валентність у сполуках з воднем зменшується від 4 у кремнію до 1 у хлору.
4. Починаючи з елемента № 19 (калій), знову відбувається поступова зміна властивостей від типового лужного металу до типового неметалу галогену. Але в цьому ряду розміщено не 8, а 18 елементів.
До цих висновків учитель може підвести учнів і за допомогою традиційної роботи з картками перших двадцяти елементів, які вони готують заздалегідь вдома. В картках зазначаються символ елемента, відносна атомна маса, порядковий номер, формули вищих оксидів, водневих (летких) сполук і гідроксидів, валентність у вищих кисневих і водневих (газоподібних) сполуках. Учням пропонують розмістити картки у порядку зростання відносних атомних мас елементів.
Учитель підкреслює, що в природному ряду елементів (тобто елементів, розміщених у порядку зростання відносних атомних мас) хімічні властивості змінюються не монотонно, а періодично. Подібні у хімічному відношенні елементи зустрічаються у природному ряду через правильні інтервали і, таким чином, повторюються періодично. Все це дало можливість Д.І. Менделєєву відкритий ним закон назвати «законом періодичності» і сформулювати його так: властивості простих тіл, а також форми і властивості сполук елементів перебувають у періодичній залежності від величини атомних ваг елементів. Робиться наголос на тому, що періодичний закон – це фундаментальний закон природи, вій відображає взаємозв'язок, який існує між усіма хімічними елементами.
Повідомляють, що Д.І. Менделєєв не зупинився на відкритті закону періодичності. На його основі складена періодична система, яка є графічним зображенням періодичного закону. Вона практично будується учнями при обґрунтуванні періодичного закону. На прикладі короткого варіанта системи наводиться визначення періоду, групи. Даються перші, поки що формалізовані, уявлення про малі і великі періоди, головні і побічні підгрупи.
Наступне вивчення періодичного закону пов'язане з актуалізацією міжпредметних понять, які закладені у курсі фізики під час ознайомлення з електронною будовою атома. З метою логічного переходу до цього етапу вивчення закону учитель формулює ряд навчальних проблем: Чому властивості хімічних елементів, розміщених у порядку зростання відносних атомних мас, міняються періодично? Чому Д.І. Менделєєв допускав у ряді випадків відхилення у розміщенні елементів за значенням відносних атомних мас (аргон і калій, кобальт і нікель, телур і йод тощо)? Чому одні елементи виявляють металічні властивості, а інші – неметалічні? Чому елементи однієї природної групи мають подібні властивості, а властивості елементів різних груп різняться?
Звернувшись до будови атома, учні зможуть знайти відповіді на ці запитання. Вчитель пропонує пригадати матеріал, засвоєний на уроках фізики, про існування двох видів зарядів – позитивного і негативного, про притягування протилежно заряджених тіл і відштовхування тіл з однойменними зарядами. Учні знайомі також з дослідом Е. Резерфорда, їм відома ядерна модель атома, відповідно до якої атом являє собою систему частинок. До складу цієї системи входить позитивно заряджене ядро, навколо якого рухаються негативно заряджені електрони. Атом в цілому електронейтральний. На уроці «Порядковий номер елемента – заряд ядра його атома» важливо показати учням, що результатом цілого ряду експериментів вчених-фізиків став висновок про рівність чисельних значень заряду ядра атома і порядкового номера хімічного елемента, наданого йому Д.І. Менделєєвим. Повідомляють учням про результати роботи англійських вчених-фізиків, зокрема Г. Мозлі у 1913 р. підтвердив висновок з досліду Е. Резерфорда (1911) про те, що заряд ядра, виражений в одиницях заряду електрона, чисельно дорівнює порядковому номеру елемента у періодичній системі. Англійський вчений Д. Чедвік досить точно визначив у 1920 р. заряди ядер кількох елементів. Так був встановлений фізичний зміст порядкового номера хімічного елемента.
Після цього коротко розглядають питання про склад атомних ядер. Повідомляють, що у 1932 р. Д. Чедвік відкрив нейтрони, а російський вчений Д.Д. Іваненко незалежно від нього, а також німецький вчений В. Гейзенберг розробили протонно-нейтронну теорію будови атомного ядра.
19.Формування поняття про хімічний елемент. Хімічний елемент – одне з основних понять хімії.
Воно пов'язане з поняттями «атом», «речовина». Ось чому знання про речовину, її склад на рівні атомно-молекулярної теорії є базою для. формування знань про хімічний елемент. Це поняття далі розвивається і поглиблюється під час вивчення електронної будови атома. Звертаємо увагу вчителя, що формувати знання про хімічний елемент значно складніше, ніж про речовину, бо дане поняття абстрактне.
Отже, завдання полягає в тому, щоб довести реальність існування хімічних елементів і схарактеризувати їх як з якісного, так і з кількісного боку.
Для формування поняття про хімічний елемент можна використати пошуковий підхід, бо учні на перших уроках уже підтвердили і закріпили знання про речовину. їм відомо, що речовини мають різні фізичні властивості залежно від їх складу. Демонструють розклад води електричним струмом і наголошують, що в результаті цього утворилося дві нові речовини – водень і кисень. Вчитель показує модель молекули води, відому учням з курсу фізики. За її допомогою учні усвідомлюють, що відбувається з молекулами води під впливом електричного струму: молекули розпадаються на два види атомів. З цих атомів виникають нові речовини – один вид атомів утворюють молекули кисню, другий – молекули водню. Отже, до складу молекул води входять два різні види атомів, або хімічних елементів. Відомо 118 видів атомів, або 118 хімічних елементів. Робиться висновок, що хімічний елемент – це складова частина речовини, яка являє собою певний вид атомів. Вони поєднуються у різних сполученнях і утворюють усю різноманітність речовин, яка спостерігається у природі і в лабораторії. Важливо підкреслити, що хімічний елемент – це не один окремий атом, а всі атоми одного виду. Через поняття «хімічний елемент» уточнюють визначення атома: атом – це найдрібніша частинка хімічного елемента.
Вчитель повідомляє, що для зручності хіміки домовилися позначати кожний хімічний елемент певним знаком (символом). Практика свідчить, що запам'ятати символи хімічних елементів допомагає використання періодичної системи як довідкової таблиці, з якої можна дізнатися про символ і назву хімічного елемента. Крім того, велике значення має написання хімічних диктантів.
Перш ніж розкрити суть хімічного символу, необхідно ознайомити учнів з кількісною характеристикою хімічного елемента. З цією метою учитель розповідає про масу атомів і відносну атомну масу. У класах хіміко-біологічного або хіміко-технологічного профілю доцільно навести математичний вираз відносної атомної маси.
У шкільних умовах краще сказати, що значення відносної атомної маси виражається абстрактним числом або «просто» числом. Слід показати, що точні значення відносних атомних мас наведені в таблиці «Періодична система хімічних елементів Д.І. Менделєєва», яка вивішена в хімічному кабінеті, і зазначити, що при хімічних розрахунках найчастіше використовують заокруглені, як правило, до цілих чисел значення відносних атомних мас хімічних елементів.
Тепер є всі підстави для узагальнення набутих знань про символ хімічного елемента. Допоможе в цьому схема 1:
Схема 1:

На закріплення знань учні виконують вправи різного ступеня складності.
На основі засвоєння поняття про хімічний елемент учнів ознайомлюють з поділом речовин за складом на прості і складні. Звертають увагу на те, що прості речовини в свою чергу за властивостями поділяють на метали і неметали. Під час пояснення вчитель демонструє набір деяких металів і неметалів, потім учні виконують лабораторні досліди «Ознайомлення із зразками простих і складних речовин, металів і неметалів». Шляхом бесіди спільними зусиллями з'ясовують агрегатний стан металів і неметалів, виділяють їхні основні фізичні властивості. Як наслідок обговорення в зошитах учнів з'являється схема 2:

Під час відпрацювання знань на спеціально виділеному семінарському занятті або повторення і закріплення матеріалу на звичайному уроці звертають увагу на необхідність розмежування понять «хімічний елемент» і «проста речовина». З цією метою можна використати знання учнів з курсу природознавства про склад повітря і поставити, наприклад, таке проблемне запитання: Чи можна стверджувати, як на ваш погляд, що до складу повітря входять хімічні елементи нітроген і оксиген? Практика свідчить, коли учні вважають, що так стверджувати не можна, бо повітря – це суміш простих речовин азоту і кисню, то деякі вчителі погоджуються з цим. Насправді ж тут відбувається протиставлення двох понять – «хімічний елемент» і «проста речовина».
Щоб навчити учнів розрізняти ці поняття, потрібно проробити з ними тренувальні вправи. При цьому важливо навести такий приклад, щоб учні порівнювали просту речовину і складну, до складу якої входить хімічний елемент, що утворює просту речовину, наприклад проста речовина – кисень і складна речовина – вода. Далі варто запропонувати складніші завдання, наприклад: висловіть своє судження, в якому випадку йдеться про оксиген як хімічний елемент, а в якому – як про просту речовину, проаналізувавши формули таких речовин: кисень – O2, вода – H2O; озон – О3, пероксид водню – H2O2; вуглекислий газ – CO2, суміш газів – O2, CO2.
Судження має бути таким: атоми одного і того самого хімічного елемента оксигену можуть входити до складу як простих, так і складних речовин. У даному разі в усіх випадках оксиген входить до складу названих речовин і суміші газів як хімічний елемент, а коли зустрічається формула O2,про нього можна сказати і як про просту речовину, і як про хімічний елемент у вільному стані одночасно.
Розвитком знань про хімічний елемент є повідомлення про форми його існування у вигляді простих і складних речовин, а також поодиноких атомів, які можуть утворитися при високих температурах (схема 4).
Для закріплення цього матеріалу учні виконують систему завдань різного рівня складності.
11,12.Формування понять про хімічний зв'язок і структуру твердих речовин