Структурные параметры гликольурила и димера гликольурила.
Структурные параметры гликольурила показаны в таблице 2. Модель химической системы гликольурила построенная в программном пакете molden представлена на рисунке 2.
| Параметр | Гликольурил |
| R(C2-O1) | 1,21530А |
| R(N4-C2) | 1,43842А |
| R(C6-N4) | 1,49242А |
| R(N4-H10) | 0,99603А |
| R(C6-C2) | 2,39317А |
| O1-C2-N4 | 124,988° |
| H10-N4-C2 | 117,975° |
| C6-N4-C2 | 109,467° |
| N4-C6-N8 | 116,431° |
| N4-C6-H12 | 108,052° |
| N4-C6-C5 | 105,085° |
| O1-C2-N4-C6 | -175,861° |
| H10-N4-C2-O1 | -37,459° |
| C2-N4-C6-C5 | -8,861° |
| H10-N4-C6-C5 | -147,346° |
| C2-N4-C6-N8 | 107,030° |
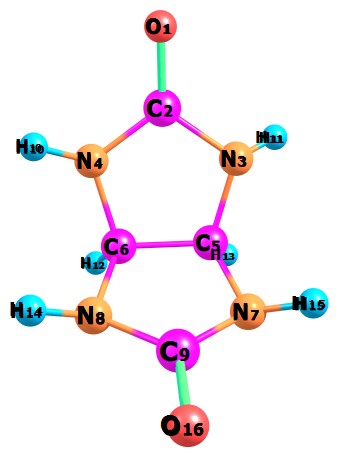
Рисунок 2. Гликольурил
Таблица 2. Структурные параметры гликольурила
Описание структурных данных гликольурила и димера гликольурила велась путём описания только верхнего пятиугольника каждого из веществ, так как они симметричны и не требуют описания всех пятиугольных колец.
Структурные параметры димер гликольурила показаны в таблице 3. Модель химической системы димер гликольурила построена в программном пакете molden представлена на рисунке 3.
| Параметр | Димер гликольурила |
| R(C7-O21) | 1,21529 А |
| R(N6-C7) | 1,44340 А |
| R(C2-N6) | 1,49236 А |
| R(N6-H27) | 0,99663 А |
| R(C2-C7) | 2,39404 А |
| O21-C7-N6 | 124,544° |
| H27-N6-C7 | 116,114° |
| C2-N6-C7 | 109,258° |
| N6-C2-N1 | 112,105° |
| N6-C2-H28 | 107,334° |
| N6-C2-C3 | 105,652° |
| O21-C7-N6-C2 | -177,360° |
| H27-N6-C7-O21 | -43,419° |
| C7-N6-C2-C3 | -8,024° |
| H27-N6-C2-C3 | -141,877° |
| C7-N6-C2-N1 | 106,344° |
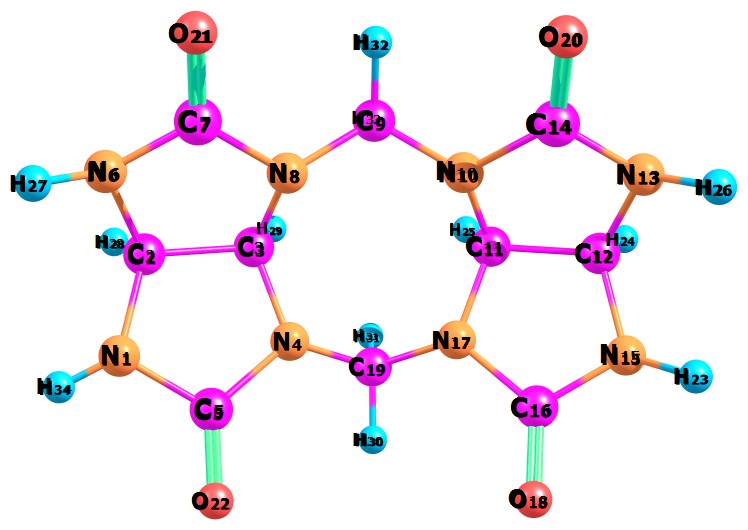
Рисунок 3. Димер гликольурил
Таблица 3. Структурные параметры димер гликольурила
Структурные параметры гликольурила и димера гликольурила показанные в таблицах 2-3 не значительно отличаются друг от друга.
Термохимические (энтальпию и свободную энергию Гиббса) параметры реакции образования димера гликольурила.
Энтальпия
Энтальпия — это свойство вещества, указывающее количество энергии, которую можно преобразовать в теплоту[12].
Энтальпия — это термодинамическое свойство вещества, которое указывает уровень энергии, сохраненной в его молекулярной структуре. Это значит, что, хотя вещество может обладать энергией на основании температуры и давления, не всю ее можно преобразовать в теплоту. Часть внутренней энергии всегда остается в веществе и поддерживает его молекулярную структуру. Часть кинетической энергии вещества недоступна, когда его температура приближается к температуре окружающей среды. Следовательно, энтальпия — это количество энергии, которая доступна для преобразования в теплоту при определенной температуре и давлении. Единицы энтальпии — британская тепловая единица или джоуль для энергии и Btu/lbm или Дж/кг для удельной энергии.
Количество энтальпии
Количество энтальпии вещества основано на его данной температуре. Данная температура — это значение, которая выбрано учеными и инженерами, как основание для вычислений. Это температура, при которой энтальпия вещества равна нулю Дж. Другими словами, у вещества нет доступной энергии, которую можно преобразовать в теплоту. Данная температура у различных веществ разная. Например, данная температура воды — это тройная точка (О °С), азота 150°С, а хладагентов на основе метана и этана 40°С.
Если температура вещества выше его данной температуры или изменяет состояние на газообразное при данной температуре, энтальпия выражается положительным числом. И наоборот при температуре ниже данной энтальпия вещества выражается отрицательным числом. Энтальпия используется в вычислениях для определения разницы уровней энергии между двумя состояниями. Это необходимо для настройки оборудования и определения коэффициента полезного действия процесса[12].
Энтальпию часто определяют как полную энергию вещества, так как она равна сумме его внутренней энергии (и) в данном состоянии наряду с его способностью проделать работу (pv). Но в действительности энтальпия не указывает полную энергию вещества при данной температуре выше абсолютного нуля (-273°С). Следовательно, вместо того, чтобы определять энтальпию как полную теплоту вещества, более точно определять ее как общее количество доступной энергии вещества, которое можно преобразовать в теплоту.
H = U + pV