Закон эквивалентов. Способы выражения концентрации растворов.
Контрольные вопросы.
1. Правила работы и техники безопасности в химической лаборатории.
2. Правила пользования реактивами и химической посудой.
3. Основные химические понятия: атомная масса, молекулярная масса.
4. Основные законы химии: а) закон постоянства состава; б)закон кратных отношений; в) закон объемных отношений; г) закон Авогадро; д) закон эквивалентов.
5. Эквивалент. Химический эквивалент элемента и химический эквивалент сложного вещества. а) молярная масса эквивалента кислоты; б) молярная масса эквивалента гидроксида; в) молярная масса эквивалента соли; г) молярная масса эквивалента оксида.
6. Способы выражения концентрации растворов: массовая доля, мольная доля, молярная и молярная концентрация эквивалента (нормальная концентрация).
7. Перевод одних концентраций в другие.
8. Решение задач.
9. Решение задач.
Закон эквивалентов: элементы соединяются друг с другом или замещают друг друга в отношении их эквивалентов:
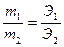
где m и Э – массы и их эквиваленты соответственно.
Эквивалент элемента Э, атомная масса А и валентность, степень окисления элемента В связаны соотношением: Э = А/В. масса одного моля эквивалента элемента или сложного вещества называется молярной массой эквивалента или эквивалентной массой (г/моль)
Эквивалентом сложного вещества называется такая его масса, которая взаимодействует без остатка с эквивалентом (эквивалентной массой) водорода или любого другого вещества.
Эквиваленты сложных веществ вычисляют по формулам:
Экислоты = 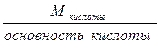
Эоснования = 
Эсоли = 
Эоксида = 
Число молярных масс эквивалента сложного вещества в соответствии с законом эквивалентов зависит от того, в какой конкретно реакции это сложное вещество участвует.
Число молярных масс эквивалента, содержащихся в 1л раствора определяет молярную концентрацию эквивалента (нормальность) раствора. Раствор, содержащий в 1л 1 молярную массу эквивалента растворенного вещества, называется однонормальным раствором (1н), 0,1 молярную массу эквивалента - децимолярным и т.д.
Основными методами определения эквивалентов (молярных масс эквивалентов) простых веществ являются методы:
a) аналитический метод;
b) электрохимический метод;
c) метод вытеснения водорода.
Примеры вычисления эквивалента металла:
Пример 1. При сжигании 2,28 г металла было получено 3,78 г его оксида. Определить эквивалент металла.
Решение:
Сначала находим массу кислорода, пошедшего на окисление металла: 3,78 - 2,28 = 1,5г. Далее из пропорции находим эквивалент металла:
 2,28г 1,5 г кислорода
2,28г 1,5 г кислорода
 Э металла 8 г/моль кислорода,
Э металла 8 г/моль кислорода,
откуда
Э =  = 12,16 г/моль
= 12,16 г/моль
Пример 2. Вычислить эквивалент металла, если установлено химическим анализом, что сульфид металла содержит 67,15% металла (по массе), а эквивалент серы равен 16.
Решение:
67,15 массовой части металла соединяются с 32,85 части массы серы, а эквивалент металла соединяется с эквивалентом серы (закон эквивалентов). Отсюда
Эметалла =  = 32,71
= 32,71
Пример 3. Определить эквивалент никеля, если для выделения на катоде 4г металла было пропущено через раствор его соли 13150 кулонов (Кл) электричества.
Решение:
В соответствии с уравнением, объединяющим первый и второй законы Фарадея,
m = 
m - масса продукта электролиза
F - число Фарадея (96500 Кл)
Q -количество, прошедшего через раствор электричества
Э - эквивалент металла
Э =  = 29,35
= 29,35
Пример 4. При взаимодействии 5г металла с кислотой выделилось 2,8 г водорода (н.у.). Вычислить эквивалент металла.
Решение:
По определению эквивалент металла вытеснит из кислоты эквивалент (11,2л) водорода (н.у.). Составим пропорцию:
 5 г металла 2,8 г водорода
5 г металла 2,8 г водорода
 Э металла 11,2 л водорода
Э металла 11,2 л водорода
Э =  = 20
= 20
Пример 5. При растворении 0,27 г металла в кислоте выделилось 118 мл водорода при 210С и 101,8 кПа. Определить эквивалент металла.
Решение.
Приведем объем выделившегося водорода к нормальным условиям по формуле объединенного закона Бойля-Мариотта и Гей-Люссака:


 =
=  Vo =
Vo = 
Далее по закону эквивалентов находим искомое значение эквивалента металла:
 0,27г 110 мл
0,27г 110 мл
 Э водорода 11200 мл,
Э водорода 11200 мл,
откуда Э = 27,49 г/моль
Пример 6. Определить эквивалент серной кислоты в следующих химических реакциях:
NaOH + H2SO4 = NaHSO4 + H2O (1)
PbCl2 + H2SO4 = PbSO4 + 2HCl (2)
В реакции (1) эквивалент NaOH численно равен его молярной массе, следовательно, по закону эквивалентов эквиалент NaOH взаимодействует с эквивалентом H2SO4 и эквивалент H2SO4 равен его молярной массе (98 г/моль).
В реакции (2) эквивалент PbCl2 равен М/2, следовательно, и эквивалент серной кислоты будет равен М/2 = 49 г/моль.
Задачи:
1. 1,96г металла вытесняют из раствора кислоты 0,672л водорода (н.у.). Вычислить эквивалент металла.
2. Вычислить эквивалент элемента, 1,2г которого вытесняют из раствора кислоты при 20оС и 101,3 кПа 442 мл водорода.
3. Определить эквивалент хлорида никеля, если 1,621г хлорида взаимодействует без остатка с 1г гидроксида натрия, эквивалент которого равен 40.
4. На нейтрализацию 1г кислоты израсходовано 0,313г гидроксида натрия. Вычислить эквивалент кислоты.
5. На восстановление 6,33г оксида металла израсходовано 0,636л водорода (н.у.) Определить эквивалент металла.
6. Вычислить эквивалент карбоната калия в следующих реакциях:
§ K2CO3 + HI --- KHCO3 + KI
§ K2CO3 + 2HI ---- H2CO3 + 2KI
7. Какое количество водорода выделится в результате взаимодействия 9г алюминия с избытком соляной кислоты, с избытком водного раствора щелочи?
8. Какое количество оксида получится при окислении 9г алюминия?
9. Эквивалент оксида равен 28. Вычислите эквивалент металла.
10. Вычислите эквивалент фосфорной кислоты при реакциях обмена, в результате которых образуются кислые и нормальные соли.
11. Исходя из молекулярных масс HNO3, H2SO4, HCl, Na2B4O7 10H2O, KOH, Ba(OH)2, BaSO4, FeSO4 7H2O, Na2CO3 10H2O вычислите их эквивалент.
12. Для нейтрализации щавелевой кислоты гидроксидом калия на 1,244г кислоты потребовался 1г КОН, эквивалент которого 56. Вычислить эквивалент кислоты.
13. Вычислить эквивалент кислоты, если на нейтрализацию 0,234г ее потребовалось 28,9 мл 0,1N раствора NaOH.
Раствором называется гомогенная система, состоящая из двух или более компонентов. Жидкие растворы имеют наибольшее значение для живых организмов, так как именно в них протекают все жизненно важные процессы. Плазма крови, лимфа, внутриклеточные жидкости, желудочный сок - все это растворы. В виде растворов поступают в организм и лекарственные препараты (инъекции, микстуры). Нерастворимое вещество не может действовать в качестве лекарства.
При проведении анализов образцы веществ и различные пробы переводят в раствор.
Важнейшей характеристикой раствора является концентрация, т.е. относительное содержание растворенного вещества.
Процентная концентрация (относительная массовая доля) (С%) - отношение массы растворенного вещества к массе раствора, выраженное в процентах, или количество граммов растворенного вещества в 100г раствора:
C% =  . 100%
. 100%
где – mВ - масса растворенного вещества В;
mА - масса растворителя А.
Мольная доля - отношение числа молей растворенного вещества к сумме молей всех компонентов в растворе:
NВ =  =
=  ,
,
где М - грамм-молекулярная масса; n - количество молей (вещества В и растворителя А).
Молярная концентрация, или моляльность, - количество молей растворенного вещества в 1 литре раствора:
Cm = m/(VM)
m - масса растворенного вещества, г;
V - объем раствора, л.
При одинаковой молярной концентрации равные объемы растворов различных веществ содержат одинаковое число молекул. Молярность легко вычислить, зная процентную концентрацию и плотность раствора.
Сm = 
Нормальная концентрация, или нормальность (N), - количество грамм-эквивалентов растворенного вещества в 1 литре раствора:
N = 
Так как химические вещества взаимодействуют друг с другом в эквивалентных количествах (закон эквивалентов), то растворы одинаковой нормальности реагируют в равных объемах. В общем случае объемы растворов прореагировавших веществ обратно пропорциональны их нормальностям:
V1/V2 = N2/N1 N1V1 = N2V2
Очень важно уяснить, что произведение NV - общее количество грамм-эквивалентов растворенного вещества в объеме раствора V. Если известна процентная концентрация раствора, то нормальность рассчитывают по формуле:
N = 
Титр (Т) - количество граммов растворенного вещества в 1 мл раствора. Титр и нормальность связаны между собой простым соотношением:
Т =  или N =
или N = 
Связь между титром и процентной концентрацией устанавливается формулой
Т = 
Моляльность - количество молей растворенного вещества, приходящееся на 1000г растворителя:
С = 
Приготовление растворов.
Приготовление растворов является одной из важнейших операций в химической практике. Одним из основных растворителей в хим. анализе является вода. Вода используется только дистиллированная, так как обычная питьевая вода содержит помимо солей жесткости ряд органических соединений, растворенный в воде углекислый газ, хлор и соединения хлора, образовавшиеся в результате хлорирования воды.
Чаще всего растворы готовят из рассчитанных количеств отдельных компонентов. При этом обычно твердые вещества берут по массе, а жидкие - по объему. Для приготовления растворов приблизительной концентрации навеску вещества берут на технохимических весах, требуемый объем растворителя отмеривают с помощью мерного цилиндра. Растворение ведут в стакане или колбе, в которой предполагается хранить раствор.
Массу растворяемого вещества, необходимую для приготовления определенного количества раствора заданной процентной концентрации, рассчитывают по формулам:
mB = c%m/100
mB = c%Vp/100
где m - масса раствора, г;
V - объем раствора, мл;
р - его плотность, г/мл
В первом случае массу воды, которая требуется для приготовления заданного раствора, определяют по разности:
mA = m - mB
Если для растворения применяют твердое вещество, содержащее кристаллизационную воду, то его массу находят по формуле:
mB = 
где М1 и М2 - молекулярные массы кристаллогидрата и безводного вещества соответственно.
Для приготовления раствора определенной концентрации разбавлением более концентрированного раствора или путем смешения двух растворов с различной концентрацией пользуются правилом смешения:
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ.
1. Какой объем воды надо прилить к 0,5 г сахара, чтобы получить 1 %-ный раствор? Ответ: 49,5 мл.;
m (сахара) = 0,5 г
(cах.) = 0,01 (1 %)
V(Н2О) = ?
Решение:
1) m (р-ра) В 100 г р-ра – 1 г сахара
х - 0,5 г сахара
2) m (H2O) = 50 – 0,5 = 49,5 г
49,5 г
3) V(Н2О) = ------------ = 49,5 мл
1 г/мл
Ответ: V(Н2О) = 49,5 мл
2. Какую массу соли надо добавить к 200 мл воды, чтобы получить 3 %-ный раствор? Ответ: 6,2 г.;
V(Н2О) = 200 мл
(соли) = 0,03 (3 %)
m (соли) = ?
Решение:
1) 3 %-ный раствор – это на 100 г р-ра – 3 г соли и 97 г воды
2) 2) m (200 мл Н2О) = 200 мл · 1 г/мл = 200 г
3) 3) m (соли) = ?
3 г соли – на 97 г Н2О
х - 200 г Н2О
3 х 200
х = ---------- = 6,2 г.
97
Ответ: m (соли) = 6,2 г
3. Смешали 0,4 г соли и 200 мл воды. Какова массовая доля соли в полученном растворе? Ответ: 0,002.;
m (с) = 0,4 г
V(Н2О) = 200 мл
(с) = ?
Решение:
1) m (H2O) = 200 мл х 1 г/мл = 200 г
m (р-ра) = 200 г х 0,4 г = 200,4 г
2) m (H2O) = 50 – 0,5 = 45,5 г
0,4 г
(c) = ---------- = 0,002 (0,2 %-ный)
200,4 г
Ответ: (с) = 0,002 (0,2 %-ный)
4. Смешали гидроксид натрия NaOH в количестве 1 моль с 1 л воды. Какова массовая доля гидроксида натрия в полученном растворе? Ответ: 0,038;
n(NaOH) = 1 моль
V(Н2О) = 1 л
n(NaOH) = ?
Решение:
m(NaOH) = 1 моль х 40 г/моль = 40 г
m (H2O) = 1000 мл х 1 г/мл = 1000 г
m (р-ра) = 1000 г + 40 г = 1040 г
40 г
(NaOH) = ------ = 0,038 (3,8 %)
1040 г
Ответ: (NaOH) = 0,038 (3,8 %)
5. К 150 г 20 %-ного раствора соляной кислоты прилили 200 мл воды. Каково процентное содержание соляной кислоты во вновь полученном растворе? Ответ: 0,086 (8,6 %).;
m (p. HCl) = 150 г
W(HCl) = 0,2 (20 %)
V(Н2О) = 200 мл
(HCl) = ?
Решение:
m (HCl) = 150 г х 0,2 = 30 г
m (p-ра) = 150 г + 200 г = 350 г
m (H2O) = 200 мл х 1 г/мл = 200 г
30 г
(HCl) = ----------------- = 0,086 (8,6 %)
350 г
Ответ:(HCl) = 0,086 (8,6 %).
6. К 120 г 1 %-ного раствора сахара прибавили 4 г сахара. Каково процентное содержание сахара во вновь полученном растворе? Ответ: 0,042 (4,2 %).;
m (p. сахара) = 120 г
= 0,01 (1 %)
m(сахара) = 4 г
(сахара) = ?
Решение:
m(сахара) = 120 г х 0,01 = 1,2 г
m(всего сахара) = 1,2 + 4 г = 5,2 г
m (р-ра) = 120 г + 4 г = 124 г
5,2 г
(cахара)= -------------- = 0,042 (4,2 %)
124 г
Ответ: 0,042 (4,2 %).
Задачи:
1. Какую массу соли и объем воды необходимо взять для приготовления: 70 г 2 %-ного раствора (ответ: 1,4 г, H2O - 68,6 мл);
70 г 2 %-ного раствора (ответ: 1,4 г, H2O - 68,6 мл);
2. Какой объем воды надо прилить к 0,5 г сахара, чтобы получить 1 %-ный раствор? Ответ: 45,5 мл.;
3. Смешали 0,5 г соли и 300 мл воды. Какова массовая доля соли в полученном растворе? Ответ: 0,00166.;
4. Смешали гидроксид натрия NaOH в количестве 1 моль с 1 л воды. Какова массовая доля гидроксида натрия в полученном растворе? Ответ: 0,038;
5. К 200 г 40 %-ного раствора уксусной кислоты долили 300 мл воды. Каково процентное содержание уксусной кислоты во вновь полученном растворе? Ответ: 0,16 (16 %).;
6. Сколько миллилитров воды надо добавить к 70 г 20 %-ного раствора серной кислоты, чтобы получить 3 %-ный раствор? Ответ: 396,7 мл.;
7. Смешали 20 г 0,5 %-ного раствора сахара с 20 г 1 %-ного раствора сахара. Какова массовая доля сахара во вновь полученном растворе? Ответ: 0,0075 (0,75 %).;
8. Какова массовая доля нитрата калия в растворе, полученном после смешивания 90 г 2 %-ного раствора и 110 г 5 %-ного раствора нитрата калия. Ответ: 0,0365 (3,65 %).;
9. Определить молярную концентрацию 18 %-ного раствора соляной кислоты, плотность которого равна 1,089 г/мл. Ответ: 5,37 моль/л.;
10. Какой объем 36,5 %-ного раствора соляной кислоты (пл. 1,18 г/мл) необходимо взять для приготовления 1000 мл 0,1 молярного раствора? Ответ: 8,47 мл.;
11. Определить массовую долю бромоводорода в растворе, полученном при растворении 280 л (н. у.) бромоводорода в 1 л воды. Ответ: 50,31 %.;
12. Определить массу воды, в которой нужно растворить 44,8 л хлороводорода (н. у.), чтобы получить 14,6 %-ный раствор соляной кислоты. Ответ: 427 г.;
13. Сколько граммов надо взять 10 %-ного раствора и 35 %-ного раствора соляной кислоты, чтобы получить 300 г 20 %-ного раствора соляной кислоты? Ответ: 120 г (35 %) и 180 г (10 %).;
14. Как превратить 40 %-ный раствор соли в 5 %-ный? Ответ: 1 : 7.;
15. Рассчитайте объем 6 М раствора KOH ( = 1,395 г/мл), необходимый для приготовления 100 г 10% раствора KOH.
16. Вычислите массовую долю раствора Na2SO4, полученного при растворении 10г Na2SO4 × 10H2O в 150 г 5%-ного раствора Na2SO4.
17. Рассчитайте молярную концентрацию 0,9 %-ного раствора хлорида натрия ( = 1 г/мл).