ТЕМА 4. РОЗЧИНИ. СПОСОБИ ВИРАЖЕННЯ
077-140
МЕТОДИЧНІ ВКАЗІВКИ
до виконання контрольної роботи з навчальної
дисципліни „Хімія” для студентів заочної форми навчання
за напрямом підготовки 6.060101 „Будівництво”
Затверджено на засіданні
методичної комісії
напряму підготовки
6.060101 „Будівництво”
Протокол №3 від 24.11.2010 р.
Рівне – 2010
Методичні вказівки до виконання контрольної роботи з навчальної
дисципліни „Хімія” для студентів заочної форми навчання за напрямом підготовки 6.060101 „Будівництво”/ І.Є.Манековська - Рівне: НУВГП, 2010. – 28 с.
Упорядник: І.Є.Манековська, доцент кафедри хімії.
Відповідальний за випуск: М.В.Яцков, канд.техн.наук,
завідувач кафедри хімії
© І.Є.Манековська І.Є., 2011
© НУВГП, 2011
З М І С Т
Стор.
ПЕРЕДМОВА................................................................................4
ТЕМА 1. ОСНОВНІ ПОНЯТТЯ ТА ЗАКОНИ ХІМІЇ............5
1.1. Визначення відносних молекулярних та молярних
мас газоподібних речовин..................................................................5
1.2. Хімічний еквівалент. Закон еквівалентів..............................5
ТЕМА 2. БУДОВА АТОМА. ПЕРІОДИЧНИЙ ЗАКОН
І ПЕРІОДИЧНА СИСТЕМА ЕЛЕМЕНТІВ З ПОГЛЯДУ
БУДОВИ АТОМА..............................................................................6
ТЕМА 3. ХІМІЧНА КІНЕТИКА І РІВНОВАГА.....................7
3.1. Швидкість хімічних реакцій....................................................7
3.2. Хімічна рівновага. Зміщення рівноваги. Принцип
Ле Шательє..........................................................................................8
ТЕМА 4. РОЗЧИНИ. СПОСОБИ ВИРАЖЕННЯ
СКЛАДУ РОЗЧИНІВ.......................................................................9
ТЕМА 5. РЕАКЦІЇ ОБМІНУ В РОЗЧИНАХ ЕЛЕКТРО-
ЛІТІВ...................................................................................................10
ТЕМА 6. ДИСОЦІАЦІЯ ВОДИ. ВОДНЕВИЙ ПОКАЗНИК11
ТЕМА 7. ГІДРОЛІЗ СОЛЕЙ......................................................12
ТЕМА 8. ОКИСНО-ВІДНОВНІ РЕАКЦІЇ...............................12
ТЕМА 9. РЯД СТАНДАРТНИХ ЕЛЕКТРОДНИХ
ПОТЕНЦАЛІВ МЕТАЛІВ...............................................................13
ТЕМА 10. ГАЛЬВАНІЧНІ ЕЛЕМЕНТИ..................................13
ТЕМА 11. КОРОЗІЯ МЕТАЛІВ І ЗАХИСТ ВІД КОРОЗІЇ....14
ТЕМА 12. ТВЕРДІСТЬ ВОДИ....................................................15
ПРИКЛАДИ РОЗВ’ЯЗУВАННЯ ЗАВДАНЬ............................16
ЛІТЕТАТУРА................................................................................28
ПЕРЕДМОВА
За навчальним планом студенти заочної форми навчання за напрямом „Будівництво” при вивченні дисципліни „Хімія” виконують одну контрольну роботу. Контрольна робота виконується в зошиті з полями. Обов’язково треба писати умови завдань. Відповіді мають бути чіткі, лаконічні, аргументовані, а розв’язки задач повинні супроводжуватись відповідними поясненнями. Варіант контрольної роботи визначається за останньою цифрою залікової книжки. Належним чином оформлена робота надсилається на кафедру хімії на рецензію не пізніше ніж за два тижні до екзаменаційної сесії. За умови недотримання усіх вимог щодо виконання контрольної роботи, робота повертається студенту для доопрацювання. Виправлення помилок з врахуванням зауважень викладача має бути виконане в тому самому зошиті. Після доопрацювання робота надсилається для повторного рецензування. За вірно виконану і захищену контрольну роботу нараховується до 30 білів.
ТЕМА 1. ОСНОВНІ ПОНЯТТЯ ТА ЗАКОНИ ХІМІЇ
1.1.Визначення відносних молекулярних та молярних
мас газоподібних речовин
Варіанти завдань
1. Маса 344 мл газу при температурі 420С і тиску 772 мм рт.ст. дорівнює 0,865 г. Обчислити відносну молекулярну масу газу.
2. Маса 85,5 мл пари метанолу при температурі 910С і тиску 768 мм рт.ст. дорівнює 0,0925 г. Обчислити молярну масу спирту.
3. Маса 87 мл пари при температурі 620С і тиску 758 мм рт.ст. дорівнює 0,24 г. Обчислити відносну молекулярну масу речовини.
4. Пара сірки при температурі вище 3000С має густину відносно водню 32. Обчислити молекулярну масу сірки при цій температурі і встановити, скільки атомів Сульфуру входить до складу його молекули.
5. Обчислити молярну масу газу, якщо маса газу дорівнює 1,714 г і займає об’єм 600 мл за нормальних умов.
6. Маса 0,001 м3 газу за нормальних умов дорівнює 0,0021 кг. Визначити молярну масу газу та його густину відносно повітря.
7. Обчислити молярну масу ацетону, якщо маса 500 мл його пари при температурі 870С і тиску 96 кПа дорівнює 0,93 г.
8. Маса 624 мл газу при температурі 170С і тиску 104 кПа дорівнює 1,56 г. Обчислити відносну молярну масу газу.
9. Маса 1 л газу за нормальних умов дорівнює 1,25 г. Обчислити: а) відносну молекулярну масу; б) масу молекули газу.
10. Маса 1 л деякого газу за нормальних умов дорівнює 1,52 г, а маса 1 л азоту дорівнює 1,25 г. Обчислити молярну масу газу.
1.2.Хімічний еквівалент. Закон еквівалентів
Варіанти завдань
1. Для повного відновлення 1,59 г оксиду металу до металу використано 478 мл водню при температурі 70С і тиску 730 мм рт.ст. Визначити молярну масу еквівалента металу.
2. 0,934 г металу витіснили з хлоридної кислоти 348 мл водню при температурі 200С і тиску 750 мм рт.ст. Обчислити молярну масу еквівалента металу.
3. Молярна маса еквівалента металу дорівнює 8,99 г/моль. Який об’єм водню при температурі -30С і тиску 800 мм рт.ст. можна одержати при взаємодії 0,4495 г металу з хлоридною кислотою?
4. 1 г металу сполучається з такою ж самою масою хлору, який займає об’єм 336 мл при температурі 370С і тиску 735 мм рт.ст. Визначити молярну масу еквівалента металу.
5. Обчислити молярну масу еквівалента цинку, якщо 0,584 г його витіснили з кислоти 219 мл водню, виміряного при температурі 170С і тиску 740 мм рт.ст.
6. Обчислити молярну масу еквівалента Сульфуру в сполуці його з Ферумом, якщо на 0,165 г Сульфуру припадає 0,279 г Феруму і якщо валентність Феруму дорівнює 2.
7. Обчислити молярну масу еквівалента хлору, якщо 0,824 г міді з’єднується з 291 мл хлору, виміряного за н.у., а валентність міді дорівнює 2.
8. 0,2046 алюмінію розчинили в хлорид ній кислоті. Водень, що виділився, зайняв об’єм 274 мл при температурі 190С і тиску 755 мм рт.ст. Обчислити молярну масу еквівалента алюмінію.
9. Обчислити молярну масу еквівалента Хрому в оксиді, в якому міститься 5”% Хрому і 48% Оксигену.
10. На нейтралізацію 0,728 г лугу витратили 0,535 г нітратної кислоти. Обчислити молярну масу еквівалента лугу.
ТЕМА 2. БУДОВА АТОМА. ПЕРІОДИЧНИЙ ЗАКОН
І ПЕРІОДИЧНА СИСТЕМА ЕЛЕМЕНТІВ З ПОГЛЯДУ
БУДОВИ АТОМА
Написати електронні формули запропонованих елементів. Вказати період, групу та електронну родину, до якої належить елемент. Скласти енергетичні схеми розподілу електронів по атомних електронних орбіта лях та визначити можливу валентність в нормальному і в збудженому станах. Скласти формули можливих оксидів і можливих сполук з Гідрогеном. Зробити висновок про хімічні властивості елементів та їхніх сполук на основі розміщення їх в періодичній системі.
Варіанти завдань
1. Елемент №13 і №21.
2. Елемент №15 і №23.
3. Елемент №17 і №25.
4. Елемент №20 і №30.
5. Елемент №23 і №33.
6. Елемент №14 і №22.
7. Елемент №19 і №29.
8. Елемент №16 і №24.
9. Елемент №9 і №17.
10. Елемент №7 і №15.
ТЕМА 3. ХІМІЧНА КІНЕТИКА І РІВНОВАГА
3.1. Швидкість хімічних реакцій
Варіанти завдань
1. У скільки разів необхідно збільшити концентрацію карбон(ІІ) оксиду в системі 2СО(г) = СО2(г) + С(г), щоб швидкість реакції збільшилась в 4 рази?
2. Написати рівняння швидкості реакції С(гр.) + О2(г) = СО2(г) та визначити, в скільки разів збільшиться швидкість реакції при збільшенні: а) концентрації кисню в 3 рази; б) тиску в системі в 4 рази.
3. Реакція між нітроген(ІІ) оксидом та хлором відбувається за рівнянням: 2NO(г) + Cl2(г) L 2NOCl(г). Як зміниться швидкість реакції при збільшенні: а) концентрації нітроген(ІІ) оксиду в 2 рази; б) концентрації хлору в 2 рази; 3) концентрації обох речовин в 2 рази?
4. В скільки разів необхідно збільшити тиск, щоб швидкість утворення нітроген(IV) оксиду по реакції 2NO(г) + О2(г) L 2NO2(г) збільшилась в 1000 разів?
5. В скільки разів необхідно збільшити концентрацію водню в системі N2(г) + 3Н2(г) L 2NН3(г), щоб швидкість реакції збільшилась в 100 разів?
6. В скільки разів збільшиться швидкість хімічної реакції при підвищенні температури на 400, якщо =3,2?
7. На скільки градусів необхідно підвищити температуру системи, щоб швидкість реакції зросла в 30 разів (=2,5)?
8. При збільшенні температури на 500С швидкість реакції зросла в 1200 разів. Обчислити .
9. В скільки разів необхідно збільшити концентрацію речовини В2 в системі 2А2(г) + В2(г) = 2А2В(г), щоб при зменшенні концентрації речовини А в 4 рази швидкість прямої реакції не змінилась?
10. Температурний коефіцієнт швидкості реакції дорівнює 2,3. В скільки разів збільшиться швидкість цієї реакції., якщо підвищити температуру на 25 градусів?
3.2. Хімічна рівновага. Зміщення рівноваги.
Принцип Ле Шательє
Варіанти завдань
1. При деякій температурі рівноважні концентрації в системі 2SO2(г) + О2(г) L 2SO3(г) дорівнюють відповідно: [SO2] = 0,04 моль/л, [O2] = 0,06 моль/л, [SO3] = 0,02 моль/л. Обчислити константу рівноваги і початкові концентрації сульфур(IV) оксиду і кисню. Як треба змінити концентрації реагуючих речовин, щоб рівновага змістилась в напрямку прямої реакції?
2. В стані рівноваги в системі N2(г) + 3H2(г) L 2NH3(г); Н = -92,4 кДж концентрації реагуючих речовин дорівнюють: [N2] = 3 моль/л, [H2] = 9 моль/л, [NH3] = 4 моль/л. Визначити: а) початкові концентрації Н2 та N2; б) в якому напрямку зміститься рівновага з ростом температури?
3. При деякій температурі рівновага в системі 2NO2(г) L 2NO(г) + О2(г) встановилось при таких концентраціях: [NО2] = 0,006 моль/л, [NO] = 0,024 моль/л. Обчислити константу рівноваги і початкову концентрацію NO2.
4. Система С(ГРАФІТ) + СО2(г) L 2СО(г); Н0 = 172,5 кДж знаходиться в стані рівноваги. Вказати: а) як зміниться вміст СО в рівноважній суміші з підвищенням температури при незмінному тиску; б) з ростом загального тиску при незмінній температурі?
5. В якому напрямку зміститься рівновага:
2СО(г) + О2(г) L 2СО(г); Н0 = -566 кДж;
N2(г) + О2(г) L 2NО(г); Н0 = 180 кДж.
а) при пониженні температури;
б) при підвищенні тиску?
Написати вирази констант рівноваги.
6. Як вплине на рівновагу реакцій:
2Н2(г) + О2(г) L 2Н2О(г); Н0 = -483,6 кДж;
СаСО3(к) L СаО(к) + СО2(г); Н0 = 179 кДж.
а) підвищення тиску;
б) підвищення температури.
Написати вирази констант рівноваги.
7. В якому напрямку зміститься рівновага в системах:
2НBr(г) L H2(г) + Br2(г); Н0 = -70,18 кДж;
2NO(г) + О2(г) L 2NО2(г); Н0 = 117,2 кДж.
а) при підвищенні тиску;
б) при підвищенні температури.
Написати вирази констант рівноваги.
8. В системі СО(г) + С12(г) L СОСl2(г) Рівноважні концентрації речовин [С12] = 0,3 моль/л, [СO] = 0,2 моль/л та [СОС12] = 1,2 моль/л. Обчислити константу рівноваги системи і початкові концентрації хлору та карбон(ІІ) оксиду. Якими змінами концентрацій можна змістити рівновагу вправо?
9. Написати вирази констант рівноваги систем:
2NО(г) + О2(г) L 2NО2(г); Н0 = 117,2 кДж;
4НС1(г) + О2(г) L 2Н2О(г) + 2С12(г);
Н2(г) + S(к) L Н2S(г).
В якому напрямку зміститься рівновага в системах при підвищенні тиску?
10. Який вплив на систему 4НС1(г) + О2(г) L 2С12(г) + 2 Н2О(г); призведе до зміщення рівноваги вліво? Написати вираз константи рівноваги.
ТЕМА 4. РОЗЧИНИ. СПОСОБИ ВИРАЖЕННЯ
СКЛАДУ РОЗЧИНІВ
Варіанти завдань
1. Скільки грамів FeCl3 міститься в 20 мл 40%-ного розчину, густина якого 1,133 г/мл?
2. Скільки грамів ВаС12 міститься в 25 мл: а) 0,5М розчину; б) 0,5 н розчину?
3. Скільки грамів кухонної солі NaCl необхідно розчинити в 10 л води, щоб одержати розчин з масовою часткою 2%?
4. 2 г глюкози С6Н12О6 розчинили в 60 г води. Обчислити моляльну концентрацію розчину і масову частку глюкози в цьому розчині.
5. Обчислити молярну та молярну концентрацію еквівалента розчину K2SO4, в 20 мл якого міститься 1,74 г розчиненої речовини.
6. В якій кількості води необхідно розчинити 2 кг цукру, щоб одержати розчин з масовою часткою 10%?
7. Скільки грамів натрій фосфату необхідно взяти, щоб приготувати 2 л розчину, молярна концентрація еквівалента якого 0,5 моль-екв/л? Яка молярна концентрація цього розчину?
8. Скільки грамів купрум(ІІ) сульфату міститься в 10 мл розчину, молярна концентрація якого 0,2 моль/л? Яка молярна концентрація еквівалента цього розчину?
9. Скільки кг води необхідно додати до 1 кг розчину з масовою часткою 50%, щоб одержати розчин з масовою часткою 10%?
10. Обчислити молярну концентрацію розчину нітратної кислоти, масова частка якого 10%, а густина дорівнює 1,056 г/мл.
ТЕМА 5. РЕАКЦІЇ ОБМІНУ В РОЗЧИНАХ
ЕЛЕКТРОЛІТІВ
а) Написати молекулярні, йонно-молекулярні та скорочені йонно-молекулярні рівняння реакцій. Зробити висновок щодо необоротності або оборотності перебігу реакцій;
б) Скласти молекулярні рівняння реакцій, що виражаються запропонованими йонно-молекулярними рівняннями.
Варіанти завдань
1. а) NiCl2 + H2S;
б) NO2- + H+ = HNO2.
2. а) CuSO4 + NaOH;
б) Pb2+ + 2I- = PbI2.
3. а) Na2SO3 + H2SO4;
б) Fe3+ + 3OH- = Fe(OH)3.
4. а) K2CO3 + HCl;
б) 2H+ + S2- = H2S.
5. а) FeS + HCl;
б)Cu2+ + 2OH- = Cu(OH)2.
6. а) Fe(OH)3 + HNO3;
б) HCO3- + H+ = H2CO3.
7. а) AlBr3 + AgNO3;
б) Ca2+ + CO32- = CaCO3.
8. а) HCl + Ba(OH)2;
б) Cu2+ + S2- = CuS.
9. а) H2S + NH4OH;
б) CH3COO- + H+ = CH3COOH.
10. а) Na2S + H2SO4;
б) NH4+ + OH- = NH4OH.
ТЕМА 6. ДИСОЦІАЦІЯ ВОДИ. ВОДНЕВИЙ ПОКАЗНИК
Варіанти завдань
1. Визначити рН, молярну концентрацію йонів ОН- у водних розчинах, в яких концентрація йонів Гідрогену (в моль/л) дорівнює: а) 10-3; б) 6,5 . 10-8; в) 1,4 . 10-2.
2. Визначити рН і молряну концентрацію йонів ОН- у водних розчинах, в яких концентрація йонів Н+ (в моль/л) дорівнює: а) 2 . 10-7; б) 8,1 . 10-3; в) 2,7 . 10-10.
3. Визначити рН розчину, в 1 л якого міститься 0,1 г NaOH. Дисоціацію лугу вважати повною.
4. Скільки йонів Н+ містить 1 мл розчину, рН якого дорівнює 13?
5. Обчислити рН розчинів таких сильних і слабких електролітів: 0,02М NH4OH; 0,01M HNО3; 0,01M HCN; 0,001M NaOH ( 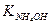 = 1,8 . 10-5;
= 1,8 . 10-5;  = 7,2 . 10-10).
= 7,2 . 10-10).
6. Як зміниться рН розчину, якщо в два рази розбавити водою: а) 0,2М розчин НС1; б) 0,2М розчин СН3СООН ( 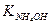 = 1,8 . 10-5)?
= 1,8 . 10-5)?
7. Визначити рН розчину, в 1 л якого міститься 7,3 г НС1. Дисоціацію кислоти вважати повною.
8. Визначити рН та концентрацію йонів Н+ в розчинах, в яких концентрація йонів ОН- (в моль/л) дорівнює: а) 6,5 . 10-6; б) 9 . 10-9; в) 8,7 . 10-8.
9. Визначити молярні концентрації сильних кислот, що мають такі значення рН: а) 1,6; б) 3; в) 3,7.
10. Визначити молярні концентрації сильних основ, що мають такі значення рН: а) 11; б) 10,3; в) 12,7.
ТЕМА 7. ГІДРОЛІЗ СОЛЕЙ
Вказати, які з наведених солей підлягають гідролізу. Які солі гідролізують ступінчасто? Для яких солей можливий спільний гідроліз? Написати йонно-молекулярні рівняння гідролізу солей і вказати рН їхніх водних розчинів.
Варіанти завдань
1. KCl, NaNO2, FeCl3.
2. Na2SO4, Na2SO3, AlCl3.
3. Ca(NO3)2, Na2SiO3, Fe(NO3)3.
4. CuSO4, NaNO3, Na2S.
5. K2CO3, Cr(NO3)3, NaCl.
6. ZnCl2, KCN, CaCl2.
7. NH4Cl, FeCl3, K2SO4.
8. ZnBr2, K2S, Na2SO4.
9. MgSO4, K2SO3, KNO3.
10. Al2(SO4)3, Na2CO3, KBr.
ТЕМА 8. ОКИСНО-ВІДНОВНІ РЕАКЦІЇ
Визначити ступені окиснення елементів, скласти електронні рівняння, розставити коефіцієнти в рівняннях окисно-відновних реакцій. Визначити окисники та відновники, обчислити молярні маси еквівалентів окисників та відновників. Визначити тип окисно-відновної реакції.
Варіанти завдань
1. NaBr + MnO2 + H2SO4 MnSO4 + Na2SO4 + Br2 + Н2О;
2. HNO3 + Zn Zn(NO3)2 + NH4NO3;
3. H2SO3 + K2Cr2O7 + H2SO4 Cr2(SO4)3 + K2SO4 + Н2О;
4. KI + K2Cr2O7 + H2SO4 I2 + Cr2(SO4)3 + K2SO4 + Н2О;
5. HNO3 + As2S3 H3AsO4 + H2SO4 + NO;
6. KClO3 + FeSO4 + H2SO4 KCl + Fe2(SO4)3 + H2O;
7. KBrO + MnCl2 + KOH KBr + MnO2 + KCl + H2O;
8. Zn + HNO3 Zn(NO3)2 + N2 + H2O;
9. K2SO3 + KMnO4 + KOH K2SO4 + K2MnO4 + H2O;
10. K2Cr2O7 + H2S + H2SO4 Cr2(SO4)3 + S + K2SO4 + H2O.