Схема использования глюкозы в организме
Роль углеводного обмена. Источники глюкозы и пути ее использования в организме.
49. Упрощенная схема гидролиза крахмала и гликогена в животном организме.
50. Гликолиз и его основные стадии. Значение гликолиза.
Сущность, суммарные реакции и КПД гликолиза.
Роль углеводного обмена. Источники глюкозы и пути ее использования в организме.
Основная роль углеводов определяется их энергетической функцией.
Глюкоза (от др.-греч. сладкий) (C6H12O6), или виноградный сахар - это белое или бесцветное вещество без запаха, имеющее сладкий вкус, растворимое в воде. Тростниковый сахар приблизительно на 25% слаще глюкозы. Глюкоза является самым важным для человека углеводом. В организме человека и животных глюкоза является основным и наиболее универсальным источником энергии для обеспечения метаболических процессов. Глюкоза депонируется у животных в виде гликогена, у растений — в виде крахмала.
Источники глюкозы
В обычных условиях основным источником углеводов для человека являются углеводы пищи. Суточная потребность в углеводах составляет примерно 400 г. В процессе усвоения пищи все экзогенные полимеры углеводной природы расщепляются до мономеров, во внутреннюю среду организма из кишечника поступают лишь моносахариды и их производные.
Глюкоза крови является непосредственным источником энергии в организме. Быстрота ее распада и окисления, а также возможность быстрого извлечения из депо обеспечивают экстренную мобилизацию энергетических ресурсов при стремительно нарастающих затратах энергии в случаях эмоционального возбуждения, при интенсивных мышечных нагрузках и др.
Уровень глюкозы в крови составляет 3,3—5,5 ммоль/л (60— 100 мг%) и является важнейшей гомеостатической константой организма. Особенно чувствительной к понижению уровня глюкозы в крови (гипогликемия) является ЦНС. Незначительная гипогликемия проявляется общей слабостью и быстрой утомляемостью. При снижении уровня глюкозы в крови до 2,2—1,7 ммоль/л (40— 30 мг%) развиваются судороги, бред, потеря сознания, а также вегетативные реакции: усиленное потоотделение, изменение просвета кожных сосудов и др. Это состояние получило название «гипогликемическая кома». Введение в кровь глюкозы быстро устраняет данные расстройства.
Энергетическая роль глюкозы.
1. В клетках глюкоза используется как источник энергии. Основная часть глюкозы, пройдя ряд преобразований, расходуется на синтез АТФ в процессе окислительного фосфорилирования. Более 90% углеводов расходуется для выработки энергии в процессе гликолиза.
2. Дополнительный путь энергетического использования глюкозы – без образования АТФ. Этот путь получил название пентозофосфатного. В печени он составляет около 30% преобразования глюкозы, в жировых клетках – несколько больше. Эта энергия расходуется для образования НАДФ, который служит донором водорода и электронов, необходимых для синтетических процессов – образования нуклеиновых и желчных кислот, стероидных гормонов.
3. Превращение глюкозы в гликоген или жир происходит в клетках печени и жировой ткани. Когда запасы углеводов низки, например, при стрессе, развивается глюнеогенез – синтез глюкозы из аминокислот и глицерина.
Схема использования глюкозы в организме
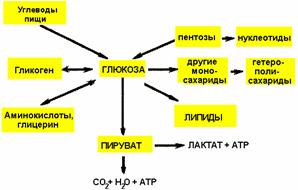
Метаболизм углеводов в организме человека состоит из следующих процессов:
1. Расщепление в пищеварительном тракте поступающих с пищей поли- и дисахаридов до моносахаридов, дальнейшее всасывание моносахаридов из кишечника в кровь.
2. Синтез и распад гликогена в тканях (гликогенез и гликогенолиз), прежде всего в печени.
Гликоген - основная форма депонирования глюкозы в клетках животных. У растений эту же функцию выполняет крахмал. В структурном отношении гликоген, как и крахмал, представляет собой разветвленный полимер из глюкозы. Однако гликоген более разветвлен и компактен. Ветвление обеспечивает быстрое освобождение при распаде гликогена большого количества концевых мономеров.
Роль гликогена:
-является основной формой хранения глюкозы в животных клетках
-образует энергетический резерв, который может быть быстро мобилизован при необходимости восполнить внезапный недостаток глюкозы
Содержание гликогена в тканях:
-Откладывается в виде гранул в цитоплазме во многих типах клеток (главным образом печени и мышц)
-Только гликоген, запасённый в клетках печени, может быть переработан в глюкозу для питания всего организма. Общая масса гликогена в печени может достигать 100—120 граммов у взрослых
-Гликоген печени никогда не расщепляется полностью
-В мышцах гликоген перерабатывается в глюкозо-6-фосфат, исключительно для локального потребления. В мышцах гликогена накапливается не более 1 % от общей массы мышц
-Небольшое количество гликогена обнаружено в почках, и ещё меньшее — в глиальных клетках мозга и лейкоцитах
Синтез и распад гликогена не являются обращением друг в друга, эти процессы происходят разными путями.
 Молекула гликогена содержит до 1 млн. остатков глюкозы, следовательно, на синтез расходуется значительное количество энергии. Необходимость превращения глюкозы в гликоген связана с тем, что накопление значительного количества глюкозы в клетке привело бы к повышению осмотического давления, так как глюкоза хорошо растворимое вещество. Напротив, гликоген содержится в клетке в виде гранул, и мало растворим.
Молекула гликогена содержит до 1 млн. остатков глюкозы, следовательно, на синтез расходуется значительное количество энергии. Необходимость превращения глюкозы в гликоген связана с тем, что накопление значительного количества глюкозы в клетке привело бы к повышению осмотического давления, так как глюкоза хорошо растворимое вещество. Напротив, гликоген содержится в клетке в виде гранул, и мало растворим.
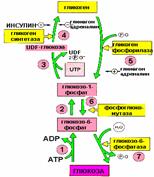
Синтез гликогена:
Гликоген синтезируется в период пищеварения (в течение 1-2 часов после приема углеводной пищи). Гликогенез особенно интенсивно протекает в печени и скелетных мышцах.
Для включения 1 остатка глюкозы в цепь гликогена тратится 1 АТФ и 1 УТФ
Основной активатор – гормон ИНСУЛИН
Распад гликогена:
Активизируется в промежутках между приемами пищи и при физической работе, когда снижается уровень глюкозы в крови (относительная гипогликемия)
Основные активаторы распада:
в печени – гормон ГЛЮКАГОН
в мышцах – гормон АДРЕНАЛИН
Упрощенная схема гидролиза крахмала и гликогена в животном организме.

3. Пентозофосфатный путь (пентозный цикл) - анаэробный путь прямого окисления глюкозы.
По этому пути идет не более 25-30% глюкозы поступившей в клетки
Итоговое уравнение пентозофосфатного пути:
6 молекул глюкозы + 12 НАДФ 5 молекул глюкозы + 6 СО2 + 12 НАДФН2
Биологическая роль пентозофосфатного пути у взрослого человека состоит в выполнении двух важных функций:
· он является поставщиком пентоз, которые необходимы для синтеза нуклеиновых кислот, коферментов, макроэргов для пластических целей.
· служит источником НАДФН2, который, в свою очередь, используется для:
1. восстановительных синтезов стероидных гормонов, жирных кислот
2. активно участвует в обезвреживании токсичных веществ в печени
4. Гликолиз — распад глюкозы. Первоначально под этим термином обозначали только анаэробное брожение, которое завершается образованием молочной кислоты (лактата) или этанола и углекислого газа. В настоящее время понятие «гликолиз» используется более широко для описания распада глюкозы, проходящего через образование глюкозо-6-фосфата, фруктозодифосфата и пирувата как в отсутствии, так и в присутствии кислорода. В последнем случае употребляется термин «аэробный гликолиз», в отличие от «анаэробного гликолиза», завершающегося образованием молочной кислоты или лактата.
ГЛИКОЛИЗ
Маленькая незаряженная молекула глюкозы способна путем диффузии покидать клетку. Чтобы глюкоза оставалась в клетке, ее надо перевести в заряженную форму (обычно глюкозо-6-фосфат). Эта реакция называется блокирующей, или запирающей.
Дальнейшие пути использования глюкозо-6-фосфата в клетках:
-Гликолиз и полное аэробное окисление глюкозы
-Пентозофосфатный цикл (частичное окисление глюкозы до пентоз)
-Синтез гликогена и т.д.
Гликолизпроисходит в цитоплазме клеток. Конечным продуктом этого этапа является пировиноградная кислота.
АНАЭРОБНЫЙ ГЛИКОЛИЗ – процесс расщепления глюкозы с образованием конечного продукта лактата через пируват. Он протекает без использования кислорода и поэтому не зависит от работы митохондриальной дыхательной цепи.
Протекает в мышцах при выполнении интенсивных нагрузок, в первые минуты мышечной работы, в эритроцитах (в которых отсутствуют митохондрии), а также в разных органах в условиях ограниченного снабжения их кислородом, в том числе в опухолевых клетках. Этот процесс служит показателем повышенной скорости деления клеток при недостаточной обеспеченности их системой кровеносных сосудов.
Стадии гликолиза.
1. Подготовительная стадия (протекает с затратой двух молекул АТФ)
Глюкоза+2АТФглюкозо-6-фосфатфруктозо-1,6-дифосфат
Ферменты: глюкокиназа; фосфофруктоизомераза;
2. Стадия образования триоз (расщепление глюкозы на 2 трехуглеродных фрагмента)
Фруктозо-1,6-дифосфат 2 глицероальдегид-3-фосфат
3. Окислительная стадия гликолиза (дает 4 моль АТФ на 1 моль глюкозы)
2 глицероальдегид-3-фосфата+2НАД+2 ПВК +2 АТФ
2 ПВК + 2 НАДН*Н+2 лактата + 2НАД+
2НАД дает 6 АТФ
Такой способ синтеза АТФ, осуществляющийся без участия тканевого дыхания и, следовательно, без потребления кислорода, обеспеченный запасом энергии субстрата, называется анаэробным, или субстратным, фосфорилированием.
Это самый быстрый путь получения АТФ. При этом следует учесть, что на первых стадиях расходуется две молекулы АТФ на активацию глюкозы и фруктозо-6-фосфата. В итоге превращение глюкозы в пируват сопровождается синтезом восьми молекул АТФ.
Общее уравнение гликолиза выглядит так:
Глюкоза + О2 + 8АДФ + 8Н3РО4 2 Пируват + 2Н2О + 8 АТФ,
Или

Значение гликолиза:
1. Гликолиз представляет собой независимый от митохондрий путь получения АТФ в цитоплазме (2 моль АТФ на 1 моль глюкозы). Основное физиологическое значение – использование энергии, которая освобождается в этом процессе для синтеза АТФ. Метаболиты гликолиза используются для синтеза новых соединений (нуклеозидов; аминокислот: серин, глицин, цистеин).
2. Если гликолиз протекает до лактата, то в процессе происходит «регенерация» НАД+ без участия тканевого дыхания
3. В клетках, не содержащих митохондрий (эритроциты, сперматозоиды), гликолиз является единственным способом синтеза АТФ
4. При отравлении митохондрий угарным газом и другими дыхательными ядами гликолиз позволяет выжить
Регуляция гликолиза:
1. Скорость гликолиза снижается, если в клетку не поступает глюкоза (регуляция количеством субстрата), однако вскоре начинается распад гликогена и скорость гликолиза восстанавливается
2. АМФ (сигнал недостатка энергии)
3. Регуляция гликолиза с помощью гормонов. Стимулируют гликолиз: Инсулин, Адреналин (стимулирует распад гликогена; в мышцах при этом образуется глюкозо-6 фосфат и происходит активация гликолиза субстратом). Ингибирует гликолиз: Глюкагон (репрессирует ген пируваткиназы; переводит пируваткиназу в неактивную форму)
Смысл анаэробного гликолиза кратко
- В условиях интенсивной мышечной работы, при гипоксии (например, интенсивный бег на 200м в течении 30 с) распад углеводов временно протекает в анаэробных условиях
- Молекулы НАДН не могут отдать свой водород, так как «не работают» дыхательная цепь в митохондриях
- Тогда в цитоплазме хорошим акцептором водорода является пируват- конечный продукт 1-го этапа
- В состоянии покоя, наступающего после интенсивной мышечной работы, в клетку начинает поступать кислород
- Это приводит к «запуску» дыхательной цепи
- В результате чего анаэробный гликолиз тормозится автоматически и переходит на аэробный, более энергетически выгодный
- Торможение анаэробного гликолиза поступившим в клетку кислородом называется ЭФФЕКТОМ ПАСТЕРА
ЭФФЕКТ ПАСТЕРА. Заключается в угнетении дыханием (О2) анаэробного гликолиза, т.е. происходит переключение с аэробного гликолиза на анаэробное окисление. Если ткани снабжены О2, то 2НАДН2, образовавшийся в процессе центральной реакции оксидоредукции, окислится в дыхательной цепи, поэтому ПВК не превращается в лактат, а в ацетил-КоА, который вовлекается в ЦТК.
Первый этап распада углеводов – анаэробный гликолиз - практически обратим. Из пирувата, а также из возникающего в анаэробных условиях лактата (молочная кислота), может синтезироваться глюкоза, а из неё гликоген.
Сходство анаэробного и аэробного гликолиза заключается в том, что до стадии образования ПВК эти процессы протекают одинаково при участии тех же ферментов.
ПОЛНОЕ АЭРОБНОЕ ОКИСЛЕНИЕ ГЛЮКОЗЫ (ПАОГ):
Благодаря активности митохондрий, можно полностью окислить глюкозу до углекислого газа и воды.
В этом случае гликолиз является первым этапом окислительного метаболизма глюкозы.
Перед включением митохондрий в ПАОГ следует превратить гликолитический лактат в ПВК.
Основные этапы ПАОГ:
1. Гликолиз с последующим превращением 2 моль лактата в 2 моль ПВК и транспортом протонов в митохондрию
2. Окислительное декарбоксилирование 2 моль пирувата в митохондриях с образованием 2 моль ацетилСоА
3.Сгорание ацетильного остатка в цикле Кребса (2 оборота цикла Кребса)
4. Тканевое дыхание и окислительное фосфорилирование: используются НАДН*Н+ и ФАДН2, генерированные в цикле Кребса, окислительном декарбоксилировании пирувата и перенесенные с помощью малатного челнока из цитоплазмы
Этапы катаболизма на примере ПАОГ:
-Гликолиз, транспорт протонов в митохондрию (I этап),
- окислительное декарбоксилирование пирувата (II этап)
-Цикл Кребса – III этап
-Тканевое дыхание и сопряженное с ним окислительное фосфорилирование – IV этап (митохондриальный синтез АТФ)
II. В ходе второго этапа от пировиноградной кислоты отщепляется углекислый газ и два атома водорода. Отщепленные атомы водорода по дыхательной цепи передаются на кислород с одновременным синтезом АТФ. Из пирувата же образуется уксусная кислота. Она присоединяется к особому веществу, коферменту А.
Это вещество является переносчиком остатков кислот. Результатом этого процесса является образование вещества ацетилкофермент А. Это вещество обладает высокой химической активностью.
Итоговое уравнение второго этапа:
СЗН4ОЗ+ 1/2О2+ HSKoA + 3 АДФ + 3 НзРО4 - СНз- С ~ SKoA + СО2+ Н2О + 3АТФ
Пируват Кофермент А Ацетил-КоА
Ацетилкофермент А подвергается дальнейшему окислению в цикле трикарбоновых кислот (цикл Кребса) и превращается в СО2 и Н2О.
III. Это и есть третий этап. За счёт выделяющейся энергии на этом этапе также осуществляется синтез АТФ.
Цикл трикарбоновых кислот (ЦТК) - это завершающий этап катаболизма не только углеводов, но и всех остальных классов органических соединений. Это обусловлено тем, что при распаде углеводов, жиров и аминокислот образуется общий промежуточный продукт - уксусная кислота, связанная со своим переносчиком - коферменгом А - в форме ацетилкофермента А.
Цикл Кребса протекает в митохондриях с обязательным потреблением кислорода и требует функционирования тканевого дыхания.
Первой реакцией цикла является взаимодействие ацетилкофермента А со щавелево-уксусной кислотой(ЩУК) с образованием лимонной кислоты.
Лимонная кислота содержит три карбоксильные группы, т. е. является трикарбоновой кислотой, что обусловило название этого цикла.
Поэтому эти реакции и называют циклом лимонной кислоты. Образуя ряд промежуточных трикарбоновых кислот, лимонная кислота вновь превращается в щавелево-уксусную и цикл повторяется. Результатом этих реакций является образование отщепленного водорода, которые, пройдя по дыхательной цепи, образует с кислородом воду. Перенос каждой пары атомов водорода на кислород сопровождается синтезом трех молекул АТФ. Всего при окислении одной молекулы ацетилкофермента А синтезируется 12 молекул АТФ.
Итоговое уравнение цикла Кребса (третьего этапа):
СНз- С ~ SKoA + 2О2+ Н2О + 12АДФ + 12 Н3РО НSKoA + 2 СО2 + Н2О + 12АТФ
Схематично цикл Кребса можно представить следующим образом:

В результате всех этих реакции образуется 36 молекул АТФ. В сумме гликолиз дает 38 молекул АТФ в пересчете на одну молекулу глюкозы.
Глюкоза + 6 О2 + 38 АДФ + 38 Н3 РО4 6СО2 + 6 Н2О +38 АТФ
Биологическая роль ЦТК
Цикл Кребса выполняет интеграционную, амфиболическую (т.е. катаболическую и анаболическую), энергетическую и водород-донорную роль.
1. Интеграционная роль состоит в том, что ЦТК представляет собой конечный общий путь окисления топливных молекул – углеводов, жирных кислот и аминокислот.
2. В ЦТК происходит окисление ацетил-КоА – это катаболическая роль.
3. Анаболическая роль цикла заключается в том, что он поставляет промежуточные продукты для биосинтетических процессов. Например, оксалоацетат используется для синтеза аспартата, a-кетоглутарат – для образования глутамата, сукцинил-КоА – для синтеза гема.
4. Одна молекула АТФ образуется в ЦТК на уровне субстратного фосфорилирования –это энергетическая роль.
5. Водород-донорная состоит в том, что ЦТК обеспечивает восстановленными коферментами НАДН (Н+) и ФАДН2дыхательную цепь, в которой происходит окисление водорода этих коферментов до воды, сопряженное с синтезом АТФ. При окислении одной молекулы ацетил-КоА в ЦТК образуются 3 НАДН(Н+) и 1 ФАДН2
IV этап. Тканевое дыхание и сопряженное с ним окислительное фосфорилирование (митохондриальный синтез АТФ)
Это перенос электронов от восстановленных нуклеотидов на кислород (через дыхательную цепь). Он сопровождается образованием конечного продукта - молекулы воды. Этот транспорт электронов сопряжен с синтезом АТФ в процессе окислительного фосфорилирования.

Окисление органических веществ в клетках, сопровождающееся потреблением кислорода и синтезом воды, называют тканевым дыханием, а цепь переноса электронов (ЦПЭ) – дыхательной цепью.
Особенности биологического окисления:
1.Протекает при температуре тела;
2.В присутствии Н2О;
3.Протекает постепенно через многочисленные стадии с участием ферментов-переносчиков, которые снижают энергию активации, происходит уменьшение свободной энергии, в результате чего энергия выделяется порциями. Поэтому окисление не сопровождается повышением температуры и не приводит к взрыву.
Электроны, поступающие в ЦПЭ, по мере их продвижения от одного переносчика к другому теряют свободную энергию. Значительная часть этой энергии запасается в АТФ, а часть рассеивается в виде тепла.
Перенос электронов от окисляемых субстратов к кислороду происходит в несколько этапов. В нем участвует большое количество промежуточных переносчиков, каждый из которых способен присоединять электроны от предыдущего переносчика и передавать следующему. Так возникает цепь окислительно-восстановительных реакций, в результате чего происходят восстановление О2 и синтез Н2О.
Транспорт электронов в дыхательной цепи сопряжён (связан) с образованием протонного градиента, необходимого для синтеза АТФ. Этот процесс называется окислительным фосфорилированием. Иными словами, окислительное фосфорилировние – это процесс, в котором энергия биологического окисления превращается в химическую энергию АТФ.
Функция дыхательной цепи – утилизация восстановленных дыхательных переносчиков, образующихся в реакциях метаболического окисления субстратов (главным образом в цикле трикарбоновых кислот). Каждая окислительная реакция в соответствии с величиной высвобождаемой энергии «обслуживается» соответствующим дыхательным переносчиком: НАДФ, НАД или ФАД. В дыхательной цепи происходит дискриминация протонов и электронов: в то время как протоны переносятся через мембрану, создавая рН, электроны движутся по цепи переносчиков от убихинона к цитохромоксидазе, генерируя разность электрических потенциалов, необходимую для образования АТФ протонной АТФ-синтазой. Таким образом, тканевое дыхание «заряжает» митохондриальную мембрану, а окислительное фосфорилирование «разряжает» ее.
ДЫХАТЕЛЬНЫЙ КОНТРОЛЬ
Перенос электронов по ЦПЭ и синтез АТФ тесно сопряжены, т.е. могут происходить только одновременно и синхронно.
При увеличении расхода АТФ в клетке увеличивается количество АДФ и его поступление в митохондрии. Повышение концентрации АДФ (субстрата АТФ-синтазы) увеличивает скорость синтеза АТФ. Таким образом, скорость синтеза АТФ точно соответствует потребности клетки в энергии. Ускорение тканевого дыхания и окислительного фосфорилирования при повышении концентрации AДФ называется дыхательным контролем.
В реакциях ЦПЭ часть энергии не превращается в энергию макроэргических связей АТФ, а рассеивается в виде теплоты.
Разность электрических потенциалов на митохондриальной мембране, создаваемая дыхательной цепью, которая выступает в качестве молекулярного проводника электронов, является движущей силой для образования АТФ и других видов полезной биологической энергии. Эта концепция превращения энергии в живых клетках была выдвинута П. Митчеллом в 1960 г. для объяснения молекулярного механизма сопряжения транспорта электронов и образования АТФ в дыхательной цепи и быстро получила международное признание. За развитие исследований в области биоэнергетики П. Митчеллу в 1978 г. была присуждена Нобелевская премия. В 1997 г. П. Бойеру и Дж. Уокеру была присуждена Нобелевская премия за выяснение молекулярных механизмов действия главного фермента биоэнергетики -протонной АТФ-синтазы.
Расчет энергетического выхода ПАОГ по этапам:
Гликолиз – 2 АТФ (субстратное фосфорилирование)
Перенос протонов в митохондрию – 2 НАДН*Н+=6 АТФ
Окислительное декарбоксилирование 2 моль ПВК – 2 НАДН*Н+=6 АТФ
Цикл Кребса (с учетом ТД и ОФ) – 12*2=24 моль АТФ при сгорании 2 ацетильных остатков
ИТОГО: 38 моль АТФ при полном сгорании 1 моль глюкозы
Значение гликолиза:
1) осуществляет связь между дыхательными субстратами и циклом Кребса;
2) поставляет на нужды клетки две молекулы АТФ и две молекулы НАДH при окислении каждой молекулы глюкозы (в условиях аноксии гликолиз, по-видимому, служит основным источником АТФ в клетке);
3) производит интермедиаты для синтетических процессов в клетке (например, фосфоенолпируват, необходимый для образования фенольных соединений и лигнина);
4) в хлоропластах обеспечивает прямой путь для синтеза АТФ, независимый от поставок НАДФH; кроме того, через гликолиз в хлоропластах запасенный крахмал метаболизируется в триозы, которые затем экспортируются из хлоропласта.
КПД гликолиза составляет 40%.
5. Взаимопревращение гексоз
6. Глюконеогенез — образование углеводов из неуглеводных продуктов (пирувата, лактата, глицерина, аминокислот, липидов, белков и т. д.).