Переваривание сложных глицидов в желудочно-кишечном тракте
Потребность в углеводах взрослого организма составляет 350-400 г в сутки, при этом целлюлозы и других пищевых волокон должно быть не менее 30-40 г. Клетчаткой богаты продукты растительного происхождения, и человеческими гликозидазами она не гидролизуется. Но сохранившиеся ее волокна не являются, как считали ранее, балластными соединениями. Касаясь стенок кишечника при продвижении, они раздражают последние, что стимулирует перистальтику, а также препятствует всасыванию различных токсичных веществ, избытка глюкозы, ХС (обеспечивая профилактику сахарного диабета, атеросклероза). Правда, из обогащенной клетчаткой пищи по тем же причинам будут плохо усваиваться и многие жизненно важные соединения: витамины, растительные гормоны, незаменимые аминокислоты. Кроме того этот полисахарид опосредованно активирует выработку пищеварительных (желудочного, панкреатического, кишечного) соков и жёлчи. В толстом кишечнике на целлюлозу действуют ферменты микрофлоры, и в результате образуются витамины (К, группы В).
Что касается биополимеров, мономером которых служит -глюкоза, то в разных отделах ЖКТ вырабатываются гидролазы, разрушающие гликозидные связи, образованные данным моносахаридом. Первой пищевые углеводы встречает -амилаза слюны, которая начинает распад крахмала и гликогена, действуя на -1,4-гликозидные связи (оптимум рН 7,1-7,2). Из-за кратковременного нахождения продуктов в ротовой полости эффективность данного фермента невелика, хотя при поступлении пищевого комка в желудок, находясь внутри его, данный катализатор продолжает работать, пока кислая среда этого органа не ингибирует его активность. Переваривание глицидов приостанавливается; когда же пища попадает в тонкий кишечник, то процесс возобновляется под действием поджелудочной -амилазы и олигогликозидазы (разрушающую -1,6-связи в точках ветвления гомополисахаридов). Укорочение цепей углеводов завершается в ворсинках тощей кишки (пристеночное пищеварение), где находятся сложные мультиэнзимные системы:
сахаразо-изомальтазный комплекс (рабочее название сахараза) гидролизует -1,2-, -1,4-, -1,6-гликозидные связи в сахарозе, мальтозе, мальтотриозе, изомальтозе;
гликоамилазныйкомплекс расщепляет -1,4-гликозидные связи в олигосахаридах;
-гликозидазный комплекс (рабочее название лактаза) – разрушает -1,4-гликозидные связи между галактозой и глюкозой (лактозу). У детей активность фермента очень высока уже до рождения и сохраняется на таком уровне до 5-7 лет, после чего снижается.
Процессы расщепления гетерополисахаридов до настоящего времени изучены недостаточно, но по-видимому, стенкой кишечника секретируются гликозидазы, способные гидролизовать связи, имеющиеся в этих полимерах.
Все высвобождающиеся из сложных углеводов пищи моносахариды всасываются ворсинками энтероцитов путем облегченной диффузии. Глюкоза и галактоза особенно важны для жизнедеятельности организма, поэтому их поступление в клетки продолжается за счет активного транспорта с помощью Na+, K+-зависимой АТФазы и транслоказ.
Из энтероцитов основная масса (более 90%) простых глицидов через vena porta (небольшая часть через лимфатические сосуды) доставляется в печень, которая служит для них диспетчером. В зависимости от количества имеющихся гранул гликогена, от уровня гликемии оказавшаяся в гепатоцитах глюкоза будет двигаться в следующих направлениях: в общий кровоток для нужд других тканей; использоваться гепатоцитами для собственных целей; избыток идти на синтез гликогена. Последний процесс ограничен из-за большой молекулярной массы накапливающегося продукта. Поэтому оставшиеся молекулы глюкозы будут преобразовываться в нейтральные жиры, обладающие низкой удельной плотностью.
Судьба глюкозы в клетке
Доставленный к клетке током крови моносахарид легко диффундирует в цитозоль. Для его проникновения в липо-, мио-, гепатоциты требуются специальные белки-переносчики – ГЛЮТ-4, которые активируются инсулином. По этой причине гипоинсулинизм в мышечной ткани вызывает энергетический голод, в адипоцитах тормозит синтез жиров, а в инсулиннезависимых органах избыток глюкозы оказывает токсическое действие.
У здорового человека данный моносахарид по мере поступления в цитозоль клеток активируется с помощью гексокиназы с образованием глюкозо-6-фосфата (рис. 1).

Рис. 1. Активация глюкозы
Его дальнейшая судьба в большинстве клеток однотипна (рис. 2). Большая часть подвергается распаду.

Рис. 2. Судьба глюкозы в клетке
Основной путь – гликолиз (греч. glucose – сладкий, lysis – распад) – распад глюкозо-6-фосфата, протекающий с высвобождением энергии. Этот процесс не зависит от наличия кислорода, но и количество образовавшихся в нем молекул АТФ при гипоксии – невелико. Причем конечным продуктом распада глюкозы в этих условиях является лактат, способный накапливаться, что проявляется местным ацидозом и болями в мышцах.
Этапы гликолиза
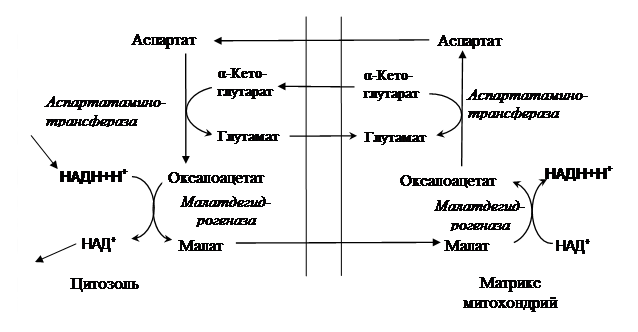
В гликолизе можно выделить два этапа: первый заключается в поляризации С–С-связи, что приводят после ее разрушения к образованию двух молекул триозофосфатов (ГА-3-Ф и ДГАФ) (Приложение, рис. 3). После изомеризации получившийся ГА-3-Ф подвергается дальнейшим преобразованиям: окислению и субстратному фосфорилированию. Если в митохондриях кислорода достаточно и скорость ЭТЦ адекватна, то НАДН, образовавшийся при окислении глицеральдегид-3-фосфата, отдает восстановительные эквиваленты в процесс биологического окисления. Для преодоления митохондриальных мембран в этом случае используется малат-аспартатный челночный механизм (рис. 3).
   | |||
|
Продукт окисления триозофосфата – ПВК – легко преодолевает мембрану и подвергается окислительному декарбоксилированию до НАДН, ацетил-КоА, СО2. Первое соединение конденсируется с оксалоацетатом, образованным при карбоксилировании ПВК, запуская цикл трикарбоновых кислот. ЦТК – основной поставщик восстановительных эквивалентов для биологического окисления и сопряженного с ним окислительного фосфорилирования. В результате полного окисления 1 молекулы глюкозы может образоваться 38 молекул АТФ:
С6Н12О6 + 6О2 + 38АДФ + 38Фн = 6СО2 + 44 Н2О + 38 АТФ
Гипоксия сказывается на работе малат-аспартатного челночного механизма, накапливается НАДН+Н+, тем самым возникает, во-первых, угроза развития ацидоза, во-вторых, постоянно уменьшается концентрация окисленного НАД+, приводя к торможению скорости гликолиза. Для предотвращения подобных неблагоприятных последствий осуществляется следующая реакция:

Дальнейшее преобразование лактата возможно только в условиях нормоксии и протекают в печени, куда названная кислота доставляется из мест образования током крови. Для эритроцитов, где отсутствуют митохондрии, характерен только анаэробный гликолиз. В других тканях этот процесс выходит на первое место как источник энергии при различных видах гипоксии (анемиях, легочно-сердечной недостаточности и т. д.). Поступившая в гепатоциты молочная кислота с участием ЛДГ окисляется до пирувата, судьба которой описано выше.
При избытке АТФ в митохондриях ингибируются ферменты ЦТК, что провоцирует накопление цитрата. Выйдя из митохондрий в цитозоль, это соединение под действием АТФ–цитратлиазы распадается на свои исходные компоненты, один из которых – ацетил-КоА может идти или на синтез высших жирных кислот (ВЖК), включающихся позднее в нейтральные жиры, или холестерола (ХС) (в основном, в клетках печени), или же участвовать в реакциях ацетилирования углеводов.