Ысаша теориялы млімет
Ауа газ оспасы болып, рамы азоттан (N2), оттегінен (O2), кмірышыл газынан (CO2), аргоннан (Ar), су буларынан мен бір атомды газдан трады. Бл газдарды ауадаы клемдік бліктеріне, тмендегі мндері сйкес келеді:
rО2 = 0,21; rСО2 = 0,0003; rАr = 0,0093.
Атмосфералы ысыма жаын ысымдар мен блме температурасында ауа млтіксіз (идеал) газды асиетіне ие. Идеал газды молекулаларыны арасында зара рекеттестік кштер болмайды. Осы молекулаларды клемін газды клемімен салыстыранда ескермеуге болады. Сондытан, барлы наты газдар жоары температура мен аз ысымда здеріні асиеттері бойынша іс жзінде идеал газды асиеттерінен айырмашылыы болмайды.
Осыан орай ауаа млтіксіз (идеал) газды асиеттерін жне кй тедеуін олдануа болады.
Тедеулі кйінде идеал газды негізгі кй параметрлеріні арасындаы зара байланысты (1кг идеал газ шін) Клапейрон тедеуімен анытауа болады:
P=RT немесе P=RT (1.1)
мндаы P,T - абсолюттік ысым,Па,жне температура,К;
=1/= m/V – газ тыыздыы, кг/м3;
= m/V - меншікті клем,м³/кг;
R - газ тратысы, 1кг газ шін, Дж/(кгК);
V,m - газды клемі, м3; массасы, кг.
Идеал газды кез келген массасы шін (m, кг) кй тедеуіні (1.1) екі жаын m-а кбейтіп алуа болады: мг
P··m = mRT немесе PV= mRT. (1.2)
Егер (1.1) тедеуіні екі жаын да газды молярлы массасына () кбейтсек, 1Кмоль газ шін кй тедеуін (Клапейрон-Менделеев) жаза аламыз.
P··= ·RT немесе P·V=·RT=R·T (1.3)
мндаы V=· – 1Кмоль газды клемі, алыпты физикалы жадайда (Pо=1,013·105Па, Tо=273,15К) барлы газдар шін V=22,41 м3/Кмоль; – газды молярлы массасы, кг/Кмоль;
R= мбебап газ тратысы, барлы газдар шін бірдей (R=·R8314,2 Дж/(Кмоль·К));
алыпты физикалы жадайы R-ді санды мнін (1.3) тедеуінен табуа болады
 Дж/(Кмоль·К) (1.4)
Дж/(Кмоль·К) (1.4)
(1.3) мбебап кй тедеуін 1Кмоль газ шін мынадай трінде жазуа болады:
P·V= 8314,2 (1.5)
Дербес газ тратысы R, бл 1кг идеал газды жмысы траты ысымдаы процесте жне оны температурасы бір градуса (оС немесе К) згергендегі. Егерде газ оспасыны і-и компоненті массалы блігімен gіберілсе, онда идеал газдарды (ауаны) оспасыны газ тратысы мына формуламен аныталады:
Rос.есеп= 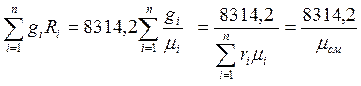 (1.6)
(1.6)
оспаны орта молярлы массасын оны і-и компоненттеріні молярлы массалары жне клемдік бліктермен крсетуге болады
осп= 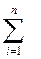 rіі =N2rN2 +О2rО2+СО2rСО2+АrrАr (1.7)
rіі =N2rN2 +О2rО2+СО2rСО2+АrrАr (1.7)
Авогадро заына байланысты идеал газ шін, газды молярлы блімі Хі і-и компонентіні клемдік блігіне rі –ге те.
Газдарды молярлы массалары А осымшасынан алынады. Егер ыдыстаы (ыдысты ішіндегі) абсолюттік ысым Рабс, барометрлік (атмосфералы) ысымынан Рб арты болса, онда Рабс мына формуламен аныталады:
Рабс = Рб+ Рарт. ман, (1.8)
Ал егер кем болса:
Рабс = Рб – Рвак. (1.9)
(1.8) жне (1.9) формулаларда Рарт (ман) жне Рвак – арты (манометрлік) жне вакуумды (сиретілген) ысымдар, Па. Олар манометр жне вакуумметрмен лшенеді.