Схема применения ГКС при терапии обострения ХОБЛ, применявшаяся в исследовании SCCOPE.
Таблица 1. Тяжесть течения ХОБЛ и рекомендуемое лечение.
| Тяжесть ХОБЛ | Клиническая характеристика | Рекомендуемое лечение | ||||
| Все больные | – | Отказ от курения Вакцинация от гриппа | ||||
| 0: группа риска | Факторы риска (курение) Хронический продуктивный кашель Нормальная спирометрия | – | ||||
| I: легкая | ОФВ1>80% от должного Индекс Тиффно < 70% Симптомы ХОБЛ(могут отсутствовать) | Б2АС короткого действия при необходимости | ||||
| II: умеренная | IIA: ОФВ1>80% от должного Индекс Тиффно < 70% Симптомы ХОБЛ (могут отсутствовать) |
| ИГКС (при наличии ответа на лечение – улучшение спирометрии или уменьшение симптомов) | |||
| IIB: 30%<ОФВ1<50% от должного Индекс Тиффно < 70% Симптомы ХОБЛ (могут отсутствовать) | ИГКС
| |||||
| III: тяжелая | 30%<ОФВ1 от должного Индекс Тиффно < 70% Симптомы дыхательной или сердечной недостаточности |
| ||||
Терапия больных в стабильном состоянии
Бронхолитики
Препараты с бронхолитическим действием занимают центральное место в симптоматической терапии ХОБЛ. Традиционно главным фармакодинамическим эффектом препаратов этой группы считается их способность снижать тонус гладких мышц бронхиальной стенки и, следовательно, увеличивать просвет бронхов, повышая объем воздушного потока. Однако по отношению к ХОБЛ эта особенность бронхолитиков, по-видимому, не имеет ведущего значения, так как у большинства больных после применения бронхолитиков отмечается лишь незначительная (<10%) степень увеличения объема форсированного выдоха за первую секунду (ОФВ1), т. е. необратимая бронхообструкция. С другой стороны, примерно 15–25 % больных демонстрируют более значительное увеличение бронхиальной проходимости после ингаляции бронхолитиков короткого действия3. Вероятно, основным фактором, вследствие которого у больных ХОБЛ снижается степень ответа на применение бронхолитиков, является развитие эмфиземы легких и ремоделирования бронхиальной стенки. Больные, у которых эти патологические процессы значительно выражены, как правило, плохо отвечают на лечение b2-адреностимуляторами (Б2АС) короткого действия, но могут сохранять чувствительность к препаратом длительного действия и/или М-холиноблокаторам (МХБ). В целом приблизительно у 40% больных применение бронхолитиков позволяет уменьшить выраженность одышки и других симптомов ХОБЛ, а также увеличивает толерантность к физической нагрузке. С другой стороны, регулярный прием бронхолитиков не предотвращает прогрессирование заболевания и не влияет на прогноз (уровень доказательности В). Таким образом, терапия бронхолитиками у больных ХОБЛ является прежде всего симптоматической (уровень доказательности А).
Вместе с тем у ряда бронхолитиков в ходе клинических исследований было выявлено непосредственное патогенетическое действие. В частности, a2-адреностимуляторы обладают противовоспалительным действием и способны улучшать мукоцилиарный клиренс, а ксантины положительно влияют на биомеханику дыхания у больных ХОБЛ.
Ингаляционные бронхолитики применяемые для терапии ХОБЛ
| Наименование | Доза, мг | |||||||||||||
| Тербуталина сульфат | 0,2 | |||||||||||||
| Сальбутамол | 0,1 | |||||||||||||
| Сальметерол | 0,02 | |||||||||||||
| Формотерол | 0,012 | |||||||||||||
| Ипратропиум бромид | 0,018 | |||||||||||||
| Ипратропиум бромид + сальбутамол | 0,09/0,018 | |||||||||||||
| Ипратропиум бромид + фенотерол. | 0,09/0,25 | |||||||||||||
Схема применения ГКС при терапии обострения ХОБЛ, применявшаяся в исследовании SCCOPE.
| Дни лечения | Дозы и путь введения |
| 1–3 | Метилпреднизолон внутривенно по 125 мг каждые 6 ч |
| 4–7 | Преднизолон внутрь по 60 мг в день |
| 8–11 | Преднизолон внутрь по 40 мг в день |
| 12–15 | Преднизолон внутрь по 20 мг в день |
На сегодняшний день не существует однозначных рекомендаций по выбору отдельных групп бронхолитиков для регулярной терапии больных ХОБЛ в стабильном состоянии. Эксперты, принимавшие участие в создании GOLD [1], считают, что выбор между Б2АС, МХБ и теофиллином должен проводится индивидуально, с учетом доступности этих ЛС, индивидуальных особенностей в ответе на лечение и риска нежелательных лекарственных реакций (НЛР). Проведение спирометрических проб с Б2АС и МХБ, теоретически может облегчить задачу подбора ЛС, однако не входит в число рекомендаций, эффективность которых у больных с ХОБЛ представляется доказанной. В целом для лечения ХОБЛ могут использоваться бронхолитики всех фармакологических групп (уровень доказательности А).
Для терапии ХОБЛ бронхорасширяющие ЛС могут назначаться как по потребности, так и регулярно (уровень доказательности А). Применение нескольких ЛС разных фармакологических групп в ряде случаев повышает эффективность лечения и снижает риск НЛР.
Во всем мире в качестве основного бронхолитика для симптоматической терапии ХОБЛ применяется сальбутамол. Этот препарат обладает быстрым началом действия (табл. 3). В одном из типичных исследований у больных с тяжелой ХОБЛ назначение сальбутамола уже спустя 30–60 мин приводило к увеличению величины ОФВ1 на 240 мл. Вместе с тем скорость начала действия и его продолжительность у больных ХОБЛ значимо меньше, чем у больных бронхиальной астмой. Тем не менее эффект Б2АС короткого действия продолжается 4–6 ч (уровень доказательности А), а продолжительность действия Б2АС длительного действия (например, сальметерол и формотерол) у больных с ХОБЛ без потери эффективности достигает 12 ч (уровень доказательности А), что позволяет рекомендовать последние для регулярного применения при терапии ХОБЛ. При лечении ХОБЛ эти препараты наиболее эффективны при приеме дважды в день (уровень доказательности B), что создает для больного дополнительные удобства по сравнению с более частым приемом препаратов короткого действия. Данных об оптимальных дозах и частоте приема Б2АС короткого действия, опирающихся на данные контролируемых клинических исследований, не существует. Прием этих ЛС внутрь снижает скорость возникновения эффекта и увеличивает риск НЛР (уровень доказательности А).
В целом ряде РКИ было показано, что эффект ипратропиума бромида практически не отличается от действия Б2АС (уровень доказательности А), но развивается несколько позднее (см. табл. 3) и продолжается значительно дольше, чем при использовании Б2АС короткого действия (уровень доказательности А). У пациентов со стабильным течение ХОБЛ комбинированное применение МХБ и Б2АС эффективнее, чем их использование по отдельности (уровень доказательности А), в то же время, при обострениях ХОБЛ это положение не доказано (уровень доказательности C) [4]. При длительном приеме ипратропиума бромида в комбинации с Б2АС не развивается тахифилаксия. Данные нескольких РКИ позволяют рекомендовать назначать ипратропиум бромид 4 раза в день (уровень доказательности В).
РКИ показали, что комбинированная терапия с применением теофиллина не дает дополнительных преимуществ при терапии ХОБЛ. Кроме того, применение теофиллина при ХОБЛ ограничивается риском НЛР. Во всех существующих РКИ, посвященных изучению эффективности этого ЛС, объектом исследования были пролонгированные формы теофиллина, что заставляет применять на практике только формы с замедленным высвобождением этого ЛС.
Действие всех бронхолитиков (по отношению к величине ОФВ1) у больных ХОБЛ имеет дозозависимый характер, однако у больных в стабильном состоянии увеличение дозы бронхолитиков связано с увеличением риска НЛР и, вероятно, не приносит дополнительного лечебного эффекта (уровень доказательности С). При применении Б2АС могут развиться тахикардия, аритмия, тремор и гипокалиемия. Тахикардия, нарушения сердечного ритма и диспепсия могут также появиться при приеме теофиллина, у которого дозы, обеспечивающие бронхолитическое действие, близки к токсическим (уровень доказательности А). Прием МХБ редко сопровождается НЛР. Риск НЛР применении бронхолитиков у больных ХОБЛ требует внимания врача и контроля за частотой сердечного ритма, уровня калия в сыворотке крови и анализа ЭКГ, однако стандартных процедур оценки безопасности этих ЛС в клинической практике – не существует.
Эксперты GOLD [1] рекомендуют применять бронхолитики при любой тяжести течения ХОБЛ:
- легкое течение ХОБЛ – бронхолитики короткого действия по потребности;
- умеренное и тяжелое течение ХОБЛ – постоянный прием бронхолитиков (одного или несколько ЛС).
Существуют различные альтернативные способы доставки бронхолитиков при терапии ХОБЛ: ингаляции (сальбутамол, фенотерол, формотерол, сальметерол, ипратропиум бромид), внутривенные (теофиллин, сальбутамол) и подкожные (адреналин) инъекции, прием препаратов внутрь (теофиллин, сальбутамол, тербуталин). Учитывая, что все бронхолитики способны вызывать клинически значимые НЛР, при их системном назначении, более предпочтительным является ингаляционный способ доставки (уровень доказательности А). В настоящее время на отечественном рынке имеются препараты в виде дозированного аэрозоля, порошковых ингаляторов, растворов для небулайзера. При выборе способа доставки ингаляционных бронхолитиков исходят в первую очередь из способности больного правильно пользоваться дозированным аэрозолем, в этом плане для пожилых больных или больных с нарушенным ментальным статусом более предпочтительным является применение дозированного аэрозоля со спейсером или небулайзера [4].
С другой стороны, определяющими факторами в выборе средств доставки является их доступность и стоимость. Применение небулайзеров для регулярного применения у больных ХОБЛ не рекомендуется в виду их высокой стоимости и необходимости в техническом обслуживании.
Каждый из известных способов ингаляционной терапии обладает своими преимуществами и недостатками. В настоящее время большинство больных с ХОБЛ во всем мире предпочитают дозированные аэрозольные ингаляторы (ДАИ). С момента создания ДАИ (Рис.1) в 1956 году в качестве пропеллента использовался фреон (хлорфторуглерод - ХФУ) – стабильный, химически инертный невоспламеняемый газ с низкой токсичностью, способный находится в парообразном состоянии под давлением. Низкая температура фреона (до -30С) и высокая скорость высвобождаемого ЛС и обусловливают ирритантное действие холодной струи фреонсодержащего аэрозоля (Cold Freon Effect) – рефлекторную остановку вдоха. Популярность ДАИ объясняется относительно низкой стоимостью, портативностью и гигиеничностью последних, быстрой техникой ингаляции и отсутствием необходимости заправки ЛС в процессе использования. В то же время, существенным недостатком ДАИ является сложная техника ингаляции, что приводит к трудностям при купировании тяжелого эпизода бронхообструкции и депозиции части ингалируемого препарата на слизистой оболочке ротоглотки.
Устройство ДАИ. А - канистра, В - клапан, С – мундштук
Избежать этих нежелательных явлений позволяет использование спейсера (уровень доказательности А). Спейсер представляет собой объемную пластмассовую или металлическую камеру, которая соединяет ДАИ и дыхательные пути больного. При использовании спейсера не требуется координации медленного вдоха и активации ДАИ, орофарингеальная депозиция препарата уменьшается в среднем на 80% и увеличивается объем респирабельной фракции, уменьшается ирритантное действие холодной струи аэрозоля . Недостатком большинства спейсеров является их относительная громоздкость, что делает невозможным использование их больными вне дома при необходимости ситуационной бронхолитической терапии.
Производство и потребление фреонсодержащих субстанций прекращено в развитых странах с 1 января 1996 г. с целью предотвращения разрушения озонового слоя атмосферы, однако предусматривалась отсрочка для «жизненно важных» (essential use) лекарственных препаратов.
Поиск нового пропеллента продолжался почти 10 лет. Результат поиска – гидрофторуглерод (ГФУ) – аналогичен по профилю безопасности ХФУ и не влияет на состояние озонового слоя атмосферы. Первый бесфреоновый ингалятор (сальбутамол-ГФУ) появился в 1995 году. Клинические испытания ДАИ-ГФУ показали, что температура ЛС остается достаточно высокой независимо от температуры окружающей среды, а при активации ингалятора вместо высокоскоростного потока образуется легкое облачко, что не вызывает ирритативных эффектов. ДАИ-ГФУ проще в использовании – не требуется тщательно встряхивать ингалятор и переворачивать его вверх дном, в ингаляторе не остаются не использованные дозы препарата, т. е. не происходит потери дозы (феномен tail-off). Переход от ДАИ-ХФУ к ДАИ-ГФУ возможен в эквивалентных дозах 1:1, кроме того, ряд исследователей отмечают возможность снижения дозы ЛС после перехода на бесфреоновый ингалятор.
Повысить качество ингаляционной терапии позволяет использование ДАИ-«Легкое Дыхание» (Рис. 3), в которых доза ЛС высвобождается автоматически в момент вдоха пациента и даже при низкой скорости вдоха обеспечивается доставка ингаляционной дозы в дыхательные пути. Респирабельная фракция ЛС в ДАИ-«Легкое Дыхание» не зависит от усилий больного и примерно вдвое выше, чем при использовании обычных ДАИ.
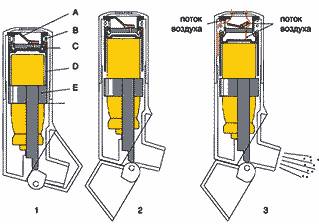
Устройство ДАИ «Легкое Дыхание»: А - клапан, В - пружина, С - диафрагма, D - пусковое устройство, E - держатель баллончика.
Дозированные пудросодержащие ингаляторы (ДПИ) обладают следующими преимуществами по сравнению с ДАИ – не требуется координации вдоха и активации ингалятора, отсутствует пропеллент, примерно вдвое увеличивается объем респирабельной фракции препарата. Однако существенным недостатком ДПИ является необходимость высокоскоростного инспираторного потока – более 30 л/мин. Использование ДПИ не исключает депозиции части препарата на слизистой ротоглотки, кроме того, ДПИ отличает высокая стоимость и необходимость обучения использованию различными типами устройств в следствие чрезвычайного многообразия последних (дискхалер, ротахалер, циклохалер, мультидиск и т. д.).
Одно из основных мест в современной ингаляционной терапии БА в последние годы занимает небулайзерная терапия. Небулайзер – это устройство для преобразования жидкости в аэрозоль (т. е. для ингаляции) с особо мелкодисперсными частицами, способными проникать преимущественно в периферические бронхи [1]. Использование небулайзеров позволяет эффективно доставлять ЛС (противовоспалительные, бронхолитические, муколитические, антибактериальные) непосредственно к «locus morbi». Кроме того, к преимуществам небулайзерной терапии можно отнести:
- возможность использования в любом возрасте, т. к. не требуется выполнение форсированного вдоха и синхронизация его с теми или иными действиями (например, нажатием на баллончик ингалятора);
- возможность проведения высокодозной терапии;
- небольшая орофарингиальная депозиция препаратов;
- отсутствие пропеллентов;
- сочетание с другими методами физиотерапии;
- возможность использования в сочетании с ингаляцией кислорода при
проведении искусственной вентиляции легких.
Присущие данному виду терапии недостатки – относительно высокая стоимость самого небулайзера, необходимость подготовки препарата для ингаляции и возможность контаминации аппаратуры – не делают его менее привлекательным и «комфортным» для пациента, т. к. использование небулайзера позволяет быстро добиваться клинического эффекта, избегая при этом таких неприятных процедур, как внутривенное введение эуфиллина, а во многих случаях – системных стероидов.
Глюкокортикостероиды
Многие руководства по лечению ХОБЛ рекомендуют проведение коротких (обычно 10–14 сут) курсов глюкокортикостероидов (ГКС) внутрь, так как считается, что увеличение ОФВ1 после проведения такого пробного курса лечения или появление у больных, получавших ГКС внутрь, обратимости при пробах с бронхолитиками является предиктором эффективности у таких больных ингаляционных глюкокортикостероидов (ИГКС). Однако проведенные в последние годы исследования показали, что терапевтический ответ на короткий курс ГКС имеет недостаточную прогностическую ценность в плане дальнейшего применения ИГКС [1].
Более длительное применение ГКС внутрь для терапии ХОБЛ являлось предметом двух ретроспективных исследований. Полученные в ходе этих исследований данные не позволяют рекомендовать больным ХОБЛ такое лечение из-за высокой частоты НЛР (уровень доказательности А).
Применение ИГКС также долгое время оставалось предметом дискуссии, так как многочисленные РКИ длительной терапии ГКС демонстрировали как значительное улучшение показателей спирометрии, так и полное отсутствие лечебного действия ГКС. Данные наиболее продолжительных РКИ свидетельствуют о том, что не все больные реагируют на применение ИГКС, кроме того, первоначальное улучшение состояния больного носит непродолжительный характер. Опираясь на анализ этих РКИ, эксперты GOLD [1] рекомендуют назначение ИГКС только при умеренном и тяжелом течении ХОБЛ у тех больных, которые отвечают на лечение увеличением ОФВ1 или уменьшением симптомов. Другим показанием к длительной терапии ИГКС являются частые обострения ХОБЛ (уровень доказательности В).
Комбинированная терапия (ИГКС + Б2АС длительного действия)
Комбинированные препараты, содержащие в своем составе ГКС и Б2АС длительного действия, были первоначально разработаны для терапии больных бронхиальной астмой. При РКИ этих ЛС удалось выявить дополнительные преимущества, связанные в первую очередь с тем, что ГКС препятствуют десенситизации4 b-адренорецепторов.
Первое крупное РКИ комбинации ГКС+Б2АС (серетид в дозе 500/50 мкг дважды в день) – TRISTAN [6] было завершено менее года назад. Это исследование показало, что применение серетида привело к значительно более выраженному улучшению бронхиальной проходимости (по сравнению с компонентами этого препарата, назначаемыми по отдельности (см. рисунок; уровень доказательности А). Кроме того, серетид имел преимущества по влиянию на самочувствие больных и выраженность симптомов (уровень доказательности А), а по способности предупреждать тяжелые обострения ХОБЛ серетид не отличался от флутиказона.
Можно полагать, что данные этого исследования со временем заставят существенно пересмотреть концепцию терапии ХОБЛ.
Другие ЛС .
Анализируя данные РКИ, можно утверждать, что ежегодная вакцинация всех больных ХОБЛ противогриппозной вакциной является обязательным компонентом фармакотерапии этого заболевания (уровень доказательности А), так как при этом удается снизить показатели смертности больных примерно на 50%. Для профилактики обострений ХОБЛ можно применять пневмококковую вакцину, хотя данных в пользу ее применения пока недостаточно (уровень доказательности В). С другой стороны, следует подчеркнуть недопустимость превентивного или профилактического применения антибиотиков у больных в стабильном состоянии (уровень доказательности А).
В нашей стране при лечении ХОБЛ традиционно широко используются муколитики, вместе с тем эффективность этих ЛС доказана только у больных с легким течением ХОБЛ (ОФВ1>50% от должного) в ряде коротких (2–6 мес) исследований. Широкое применение муколитиков у больных ХОБЛ следует относить к уровню доказательности D.
Из числа других ЛС, иногда рекомендуемых для лечения ХОБЛ, следует упомянуть антиоксиданты (N-ацетилцистиин), который можно применять у больных для профилактики частых обострений (уровень доказательности В). Наконец, для терапии ХОБЛ не следует использовать иммуномодуляторы, вазодилататоры, дыхательные аналептики, опиаты и специфические средства для терапии бронхиальной астмы (недокромил натрия, модификаторы лейкотриенов). В ходе клинических исследований не было получено данных, свидетельствующих об эффективности методов альтернативной медицины (акупунктура, фитотерапия, гомеопатия) для лечения больных ХОБЛ.
Список литературы:
1.Global Initiative for Chronic Obstructive Lung Disease. National Heart, Lung, and Blood Institute. Publication Number 2701. March 2001; 100 p.
2.Barnes PJ. Chronic obstructive pulmonary disease. N Engl J Med 2000; 343:269.
3.Barnes PJ. Bronchodilators: basic pharmacology. In Calverley P, Pride N, eds. Chronic obstructive pulmonary disease. London: Chapman and Hall, 1995; 391–417
4.Snow V, Lascher S, Mottur-Pilson C. Ann Intern Med 2001; 134: 595–9
5.Postma DS, Kerstjens HAM. Am J Respir Crit Care Med 1999;160:S66–S71.
6.TRISTAN COPD study. TRISTAN COPD Newsletter; 09.10.2001; p. 1–21.