Процессы метаболического превращения ксенобиотиков
Ряд гидрофильных ксенобиотиков выводится из организма человека в неизменном виде, но большая часть выделяется только после метаболических превращений.
Общая картина превращения ксенобиотиков в высших организмах представляется следующей:
диссимиляция синтез
ксенобиотик ¾¾¾¾¾¾¾® продукты окисления, ¾¾¾–® конъюгат
(реакции преконъю- восстановления и (реакция
гационные) (или) гидролиза конъюгации)
Окислительные, восстановительные и гидролитические процессы называют реакциями функциональными или преконъюгационными, а реакции синтеза – конъюгационными.
Общей тенденцией является превращение экзогенного вещества в более полярную форму и последующее связывание образовавшегося производного с высокополярным фрагментом, который облегчает выделение ненужных организму веществ посредством имеющихся у него соответствующих функций.
Растения не имеют системы выделения, сравнимой с системой выделения животных, но их защитный механизм может включать связывание посторонних веществ некоторыми молекулами углеводов и накопление их в местах, лишенных метаболической активности (например, в вакуолях). Микроорганизмы способны разлагать многие сложные органические соединения на диоксид углерода и воду.
Скорость реакции биотрансформации зависит не только от организма, но и обусловлена природой вещества. Это связано, в известной мере, с ограниченной доступностью активных мест на поверхности фермента и стереохимическими свойствами субстрата; изменения скоростей реакций, вероятно, объясняются различиями в структуре и физических параметрах молекул субстрата.
Наиболее широко в живых организмах представлены ферменты и ферментативные системы, катализирующие процессы окисления, восстановления, гидролиза ксенобиотиков и синтеза метаболитов, содержащих эндогенные соединения. Такие ферменты локализованы в различных органах и тканях организмов, отличаются субстратной специфичностью и зависят от физиологических и внешних факторов.
В клетках высших организмов наиболее активной системой в метаболических превращениях посторонних соединений являются микросомные фракции, содержащие микросомные ферменты. Их большей частью извлекали из печени высших организмов, хотя они имеются и в других тканях. Ферменты соединяются в мембранную систему, называемую гладким эндоплазматическим ретикулумом (ЭР). При разрушении клеток эта особая мембранная система распадается на более мелкие пузырьки, называемые микросомами; следовательно, это не истинно клеточный компонент, а артефакт препаративной процедуры.
Реакции, участвующие в путях биотрансформации чужеродных веществ, как правило, разделяют на 4 класса: 1) реакции окисления; 2) реакции восстановления; 3) реакции деградации (гидролиза); 4) реакции конъюгации.
Рассмотрим основные типы каждой из перечисленных выше реакций, обусловливающих процессы биотрансформации органических ксенобиотиков.
Реакции окисления. Среди ферментов, катализирующих окисление ксенобиотиков, особое место принадлежит микросомным монооксигеназам. На долю указанных ферментных систем приходится большая часть работы, направленной на детоксикацию от чужеродных веществ в организмах. Кроме того, оксигеназы катализируют наибольшее число биохимических превращений ксенобиотиков, связанных с внедрением в их молекулу активированного кислорода.
Оксигеназа (монооксигеназа) – это фермент, катализирующий реакцию элементарного кислорода с некоторым субстратом, в процессе которой один из атомов кислорода входит в состав субстрата, тогда как второй атом кислорода реагирует с другим акцептором, чаще всего водородом, образуя воду:
RН + НАДФН + Н+ + О2 ® RОН + НАДФ+ + Н2О.
НАДФН (никотинамидадениндинуклеотидфосфат, восстановленная форма) действует как донор водорода.
В качестве основного компонента монооксигеназные системы содержат терминальную оксидазу – цитохром Р-450, относящийся к гемопротеидам. Цитохром Р-450 впервые найден в микросомах печени крыс, затем в различных органах (легкие, почки и др.) животных. Позже было установлено, что цитохром Р-450 широко распространен в живой природе не только в эукариотных, но и в прокариотных организмах. Кроме млекопитающих и человека, эти цитохромы выделены из тканей беспозвоночных (насекомых, членистоногих и др.), птиц, микроорганизмов, растений.
Основная функция цитохрома Р-450 в организме – обезвреживание эндогенных субстратов в результате монооксигеназной реакции. В каталитических реакциях монооксигеназ цитохром Р-450 выполняет роль активного центра. Он взаимодействует с субстратом и молекулярным кислородом, а также принимает электроны от соответствующих доноров. Основной путь активирования кислорода заключается в переносе электрона от восстановленного пиридиннуклеотида к гемопротеиду. Цитохром Р-450 включен в цепь реакций, предохраняющих клетку от экзогенных веществ посредством окисления. Механизм регуляции цитохром Р-450–зависимой оксигеназы осуществляется на различных уровнях по-разному.
Различают микросомальную, митохондриальную и бактериальную монооксигеназные системы цитохрома Р-450.
Первая широко встречается у животных, растений, эукариотических микроорганизмов, включая дрожжи и плесени. Больше всего она изучена для микросом печени млекопитающих, в которых монооксигеназная система состоит из двух флавопротеинов, цитохрома b и множества других форм цитохрома Р-450. Реакция протекает на поверхности ЭР.
Вторая – митохондриальная монооксигеназа – менее изучена. Она принадлежит к числу мембрансвязанных и была обнаружена в организмах различных животных, в растениях и у эукариотических микроорганизмов. Митохондриальная система Р-450 в основном предназначена для регуляции эндогенных субстратов (стероидов), а не ксенобиотиков.
Впервые наличие цитохрома Р-450 бактериальной монооксигеназной системы установлено в бактериях Rhizobium bacteroids. В наибольшей степени она изучена на бактериях Pseudomonas putida.
Одной из особенностей окислительных ферментов является их различная избирательность (специфичность) к субстрату в зависимости от вида тканей, в которых они находятся.
Другая важная особенность этого комплекса ферментов, прежде всего в высших организмах, заключается в том, что их активность может вызываться самими веществами, на которые они воздействуют. Например, если ввести в корм крысе ПХБ или ДДТ, то можно наблюдать два первичных отклика: во-первых, пролиферацию (рост) мембранной поверхности, содержащей эти ферменты; во-вторых, повышение общей специфической активности фермента в препарате ткани. Это явление, названное индукционным процессом, приводит к повышению способности организма превращать ксенобиотик, что, вероятно, обусловлено увеличением как активности, так и количеством фермента.
Многие из реакций окисления были выявлены и изучены токсикологами и фармакологами, а также при исследовании микробиологической деградации поллютантов.
1. Окисление спиртов и альдегидов осуществляется сравнительно малоспецифической алкогольдегидрогеназой, более специфичными альдегидоксидазами и др. ферментами. Реакции окисления спиртов и альдегидов идут по следующим схемам:
Окисление спиртов в альдегиды или кетоны:
RCH2OH ® RCHO + Н2О,
R1CHOHR2 ® R1COOR2 +Н2О.
Окисление альдегидов в карбоновые кислоты:
[O]
RCHO ® RCOOH.
Ферменты дегидрогеназы удаляют водород; например, окисление спиртов до альдегидов, которые в свою очередь окисляются до карбоновых кислот. В такой последовательности реакций образуются все более полярные вещества, последнее из которых способно диссоциировать с образованием отрицательно заряженных ионов.
2. Окисление аминов (включая арил-замещенные алифатические амины). Один из примеров – реакция диэтиламина с нитритом в кислой среде желудка, в результате которой получается канцероген – диэтилнитрозамин.
 С2Н5 С2Н5
С2Н5 С2Н5
NH + NO2– ¾¾® N – NO + OH–
С2Н5 С2Н5
диэтиламин диэтилнитрозамин
Другим примером может служить реакция окисления симазина с образованием канцерогенного продукта:
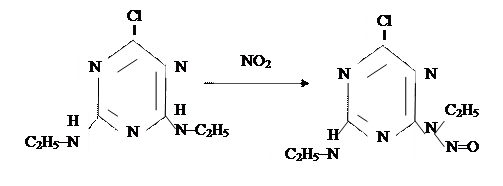
Вспомним, что нитрит натрия использовался ранее широко в качестве консервирующей добавки к пищевым продуктам.
Реакция с участием оксидазы отличается от реакции с участием оксигеназы, поскольку в оксигеназных реакциях оксиление связано с молекулярным кислородом, который выступает в качестве акцептора электрон; примером реакции может служить окисление моноамина:
Н2О
RCH2NH2 ® RCH=NH ® RCHO + NH3.
 3. Окисление ароматических аминов. Эти вещества подвергаются N-гидроксилированию с участием оксигеназ, что может вызывать появление канцерогенных продуктов.
3. Окисление ароматических аминов. Эти вещества подвергаются N-гидроксилированию с участием оксигеназ, что может вызывать появление канцерогенных продуктов.
4. Окисление ароматических алкил-замещенных соединений. Они обычно расщепляются между атомами С1 и С2 боковой цепи с образованием соответствующей ароматической кислоты.
Эти реакции происходят с участием микроорганизмов, а также в растениях. Способность же микроорганизмов атаковать ароматическое кольцо совершенно уникальна.
Для разрыва бензольных колец микроорганизмами необходимо, чтобы кольцо содержало по крайней мере два гидроксильных заместителя в орто- и параположениях. Эти заместители могут вводиться посредством реакций оксигеназы или двойного окисления, в результате которых в ароматические кольца входят оба атома элементарного кислорода. Разрыв кольца происходит также при участии фермента диоксигеназы, обеспечивающего в зависимости от вида конкретного фермента орто- или парарасщепление.
В различных видах микроорганизмов удалось установить многочисленные реакции разрыва кольца. Обычно обнаруживалось, что такие процессы весьма избирательны, поэтому универсальность почвенной экосистемы в превращениях различных классов соединений определяется разнообразием популяций в почве, а не универсальностью какого-либо одного вида микроорганизмов.
 5. Гидроксилирование кольцевых систем. Алициклические кольцевые структуры гидроксилируются легче, чем ароматические. Это одна из причин высокой токсичности бензола, поскольку он тяжело окисляется до фенола. Если в ароматическом кольце есть неуглеродный заместитель, то гидроксилирование обычно происходит в пара-положении. Однако если последнее занято, то гидроксилирование может идти и в ортоположении с образованием в некоторых случаях канцерогенных метаболитов (например, при окислении некоторых ароматических аминов). В реакциях гидроксилирования могут участвовать ферменты микросом. Катализируют реакции оксигеназы.
5. Гидроксилирование кольцевых систем. Алициклические кольцевые структуры гидроксилируются легче, чем ароматические. Это одна из причин высокой токсичности бензола, поскольку он тяжело окисляется до фенола. Если в ароматическом кольце есть неуглеродный заместитель, то гидроксилирование обычно происходит в пара-положении. Однако если последнее занято, то гидроксилирование может идти и в ортоположении с образованием в некоторых случаях канцерогенных метаболитов (например, при окислении некоторых ароматических аминов). В реакциях гидроксилирования могут участвовать ферменты микросом. Катализируют реакции оксигеназы.
Ароматическое гидроксилирование:
 |
Алифатическое гидроксилирование:
RCH3 ® RCH2OH.
6. Ароматизация алициклических соединений. Происходит в случае окисления некоторых циклогексанкарбоновых кислот (с четным числом СН2-групп в боковой цепи) с участием митохондрий. Конечный продукт – бензойная кислота.
7. При реакциях окисления с участием фермента эпоксидазы образуется эпоксидное кольцо (реакция эпоксидации):
 R1CH = CHR2 ® R1CH CHR2
R1CH = CHR2 ® R1CH CHR2
Например, в результате микросомального или микробиологического окисления (эпоксидации) пестицида альдрина получится токсический эпоксид – диэльдрин.

О
ал
(Реакция происходит в организме позвоночных, а также осуществляется многими почвенными организмами.)
Эпоксиды высокотоксичны и обладают мутагенными и канцерогенными свойствами. Эпоксидации подвергаются многие ароматические соединения.
8. Окисление или окислительное замещение органической серы. Гетероциклическая сера обычно окисляется в сульфоксиды или дисульфоны. Сера в алифатических комбинациях или ароматических боковых цепях иногда замещается кислородом. Например, инсектицид паратион (тиофос) метаболизируется микросомальными ферментами (а также в почве) в параоксон, который также обладает инсектицидными свойствами и является почти вдвое более токсичным для млекопитающих, чем паратион.
(RO)3P = S ® (RO)3P = O.
паратион параоксон
(тиофос)
Превращение связи P=S в связь P=O приводит к повышению токсичности продуктов.
9. Окислительное дезалкилирование О- и N-атомов. Эти реакции требуют молекулярного кислорода и осуществляются монооксигеназами. Наиболее часто дезалкилированию подвергаются ксенобиотики следующих классов: динитроанилины (гербициды трифлурамин, динитрамин и др.), фенилмочевины (гербициды хлороксурон, диурон, монурон, флуометурон, линурон и др.), симметричные триазины, фосфорорганические соединения, алкиламины и др. ксенобиотики. Эти реакции осуществляются оксигеназами микроорганизмов, а также клетками печени.
 О-дезалкилирование ароматических эфиров
О-дезалкилирование ароматических эфиров
N-дезалкилирование вторичных аминов
 |
Необходимо подчеркнуть, что при окислительной биотрансформации ксенобиотиков нередко получаются более токсичные или канцерогенные соединения. Кроме отмеченных выше случаев, это может иметь место при окислении 1, 2, 5, 6-дибензантрацена в организме грызунов (образуются канцерогены) или при деградации некоторых азотсодержащих пестицидов, которые легко превращаются в высокомутагенные и канцерогенные соединения: так, гербицид симазин окисляется в опасный канцероген.
Биологическое окисление, катализируемое системами микросомальных ферментов, включает широкий круг реакций, но все они могут быть сведены к одному общему механизму, а именно к гидроксилированию:
[O]
Ароматическое гидроксилирование: С6Н5Х ® HOC6H4X.
[O]
Ациклическое (алифатическое) окисление: RСН3 ® RCH2OH.
[O]
О-дезалкилирование: ROСН3 ® ROCH2OH ® ROH +HCHO.
[O]
N-дезалкилирование: RNHCH3 ® RNHCH2OH ® RNH2 + HCHO.
 |
[O]
Дезаминирование: CHNH3 ® C(OH)NH2 ® C СO + NH3.
[O]
Сульфоокисление: RSR' ® [RS + (OH)R'] ® RSOR' + H+.
Для всех этих реакций требуется восстановленный кофермент НАДФН2 или НАДН и кислород. Кислород гидроксильной группы, введенный в чужеродное соединение, извлекается из молекулярного кислорода, а не из воды. Поэтому микросомальное окисление чужеродного соединения пропорционально окислению НАДФН2 и его могут конкурентно ингибировать другие чужеродные соединения.
Реакции восстановления. Они менее обычны, чем реакции окисления. Однако если восстановленная форма соединения лучше экскретируется из организма, то закон действия масс может сдвигать редокс-реакции в сторону восстановления. Наряду с окислительными ферментативными системами в ЭР содержатся ферменты, которые восстанавливают ксенобиотики.
1. Некоторые из альдегидов и кетонов могут восстанавливаться в спирты под действием алкогольдегидрогеназ. Однако ацетон может прямо входить в цикл аэробного метаболизма через ацетоацетат и ацетил-КоА. Реакция восстановления кетонов до спиртов имеет вид:
R1CO2 ®RCHOHR2.
Существуют редуктазы, восстанавливающие карбонильные группы в молекулах кетонов и альдегидов. Некоторые из них по химической природе являются оксиредуктазами, которые окисляют спирты. Подбирая соответствующие субстраты и коферменты, можно показать, что реакция между спиртом и кетоном обратима, например:

2. Восстановление нитро- и азогрупп. Целый ряд ароматических нитросоединений, например нитробензол, паранитробензойная кислота и хлорамфеникол, восстанавливаются в соответствующие амины нитроредуктазой (нитроредуктазами), находящейся в микросомальной и растворимой фракциях печени и почек:

Возможно образование продуктов, содержащих также гидроксиамино- или нитрозогруппы. Образование нитрозосоединений представляет большую опасность для биосферы, так как может появляться вещество, которое обладает сильным мутагенным и/или канцерогенным действием.
Например, при биотрансформации гербицида трифлуралина происходит образование нитрозосоединения, обладающего канцерогенным действием.

Процесс восстановления ароматических нитросоединений до соответствующих аминов, как уже отмечалось, катализируется нитроредуктазами, локализованными в микросомной и растворимой фракциях клетки. Активность ферментов зависит от наличия в среде инкубации НАДН и НАДФН, но ингибируется кислородом. Нитроредуктазы малоспецифичны к субстратам и восстанавливают нитрогруппы практически у всех ароматических нитросоединений.
Восстановление субстратов ферментами может протекать, во-первых, через такие промежуточные соединения, как нитрозосоединения и гидроксиламин
C6H5 –NO2 ® C6H5–N=O ® C6H5NHOH ® C6H5NH2.
Во-вторых, через анионные радикалы. Последний путь характерен для микросомных нитроредуктаз, т. к. в реакции участвует наряду с флавопротеидом цитохром Р-450. Он вступает в процесс на более поздних этапах и, следовательно, передает электроны промежуточным соединениям, образующимся вслед за анионными радикалами.
Ароматические нитросоединения восстанавливаются также ферментами слизистой оболочки кишечника и его микрофлорой. Нитроредуктазы микроорганизмов, в частности E.coli, отличаются от тканевых тем, что ингибируются не кислородом, а хлортетрациклином. Цистеин и Mn2+ индуцируют фермент.
Азосоединения в организме животного подвергаются восстановлению в гидроазосоединения, а затем подвергаются восстановительному расщеплению, образуя две молекулы ароматических аминов, причем оба процесса катализируются одним и тем же ферментом:
 |
 |
Восстановление азосоединений катализируется азоредуктазами. В одном случае в процессе принимают участие НАДФН-цитохром с редуктазой, в другом – цитохром Р-450. НАДФН-цитохром с редуктазой передает электроны на субстрат через флавины, которые полностью или частично восстановлены цитохромом с. Скорость окисления азосоединений флавинами пропорциональна потенциалу восстановления, что свидетельствует о простом переносе электронов в ходе реакции.
Восстановление азосоединений с участием цитохрома Р-450 включает также образование свободных радикалов. Вследствие быстрого переокисления азоанионного радикала реакция ингибируется кислородом.
R – N = N – R’ ® [R – N – N – R’]-,
[R – N – N – R’]- + O2 ® R – N = N – R’ + O2-.
Микросомальная азоредуктаза, в отличие от нитроредуктазы, сохраняет большую часть своей активности при аэробных условиях.
3. Восстановление N-оксидов. Процесс катализируется N-окси-редуктазами, которые обнаружены в микросомной и растворимой фракциях клеток, а также в митохондриях. Активность микросомной N-оксиредуктазы ингибируется монооксидом углерода, октиламином и кислородом. При внесении в инкубационную среду субстрата восстановления (N-оксиды тирамида) его связывание происходит с восстановленной формой цитохрома Р-450.
Ксантиоксидаза также восстанавливает оксиды. Реакция ингибируется цианидом и частично кислородом.
4. Немикросомное метаболическое восстановление:
а) восстановление дисульфидов (R – S – S – R). Они расщепляются с образованием тиолов;
б) восстановление двойных связей. Двойные связи некоторых алифатических или алициклических соединений могут становиться насыщенными (например, у циклогексена). Простейшие алкены и алкины часто экскретируются без изменений их структуры;
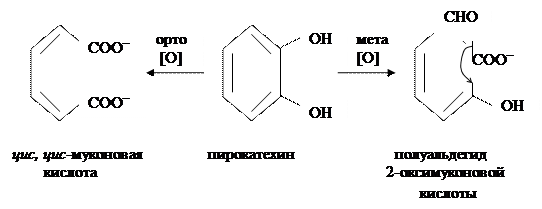
в) дегидроксилирование. Реакция гидроксилирования, упомянутая в предыдущем разделе, может обращаться. Пример – восстановление замещенных катехолов с двумя ОН-группами до соответствующих замещенных монофенолов под действием гидроксилаз печени или бактерий;
г) ароматические циклы могут восстанавливаться анаэробными микроорганизмами.
Гидролиз. Сложные чужеродные вещества могут гидролизоваться рядом гидролитических ферментов (гидролаз), находящихся в печени и плазме крови. Установлено, что некоторые из них находятся в микросомальной фракции печени.
В зависимости от субстратной специфичности ферменты, катализирующие данные процессы, относятся к различным группам.
Рассмотрим некоторые примеры реакций гиролиза.
1. Гидролиз эфиров карбоновых кислот. Наиболее распространены в живых организмах ферменты, катализирующие гидролиз эфиров карбоновых кислот (эстеразы). Их классифицируют по группам веществ, на которые они воздействуют, и по их отношению к ингибиторам:
а) арилэстеразы гидролизуют ароматические эфиры;
б) карбоксилэстеразы гидролизуют преимущественно алифатические эфиры; участвуют в метаболизме многочисленных фосфорорганических инсектицидов;
в) холинэстергидролазы действуют наиболее эффективно на эфиры холина;
г) ацетилэстеразы подобны ферментам, указанным в первой группе, однако они по-другому реагируют на воздействие ингибиторов.
Эфиры карбоновых кислот гидролизуются в организме как животных, так и человека. Гидролиз эфирной связи – начальный этап микробиологической деградации многих пестицидов.

 |
2. Гидролиз амидов, гидразидов и нитрилов. Эти реакции происходят в дополнение к другим реакциям биотрансформации.
Гидролиз амидной связи описан при изучении микробиологической деградации фениламидных пестицидов и происходит с участием амидаз. Многие из изученных амидаз являются внеклеточными гидролазами.
 |
Гидролиз амидов происходит с меньшей скоростью, чем эфиров карбоновых кислот. Иногда на этом эффекте основано действие лекарственных препаратов, имеющих большой период разложения.
3. Фосфорорганические вещества гидролизуются с помощью ферментов, атакующих эфирные связи или действующих на ангидриды кислот. К первым из изученных ферментов, расщепляющих связь с фтором, относятся фторгидролаза (обнаружена в различных органах и тканях высших животных). Реакция гидролиза эфира фосфорной кислоты проходит по схеме:

Фермент, гидролизующий связь углерод–кислород в оксирановом кольце, называется эпоксидгидратазой; локализован фермент в ЭР клеток печени, почках, легких и кишечника.
Среди гидролитических ферментов, участвующих в метаболизме ксенобиотиков, особое место занимают b-глюкуронидаза и сульфатаза. b-глюкуронидаза катализирует расщепление эфирных и сложноэфирных связей в глюкуронидах и в незначительной степени – эфирные связи серной кислоты. Обнаружен фермент в микросомах и лизосомах печени, почках, селезенке, пищеварительном тракте и половых железах животных.
Сульфатаза, гидролизирующая эфирсульфат, находится в микросомах печени человека и животных.
Реакции конъюгации. К конъюгационным относятся процессы биосинтеза, в результате которых из ксенобиотиков или их метаболитов и эндогенных продуктов (глюкуроновой кислоты, ацетилсульфата, глицина и др.) образуются сложные вещества.
Схематически реакцию конъюгации можно представить в следующем виде:
фермент
RX + эндогенное соединение (донорное в-во) ¾¾¾® конъюгат.
Как и большинство биосинтетических реакций, это энергозависимые процессы, подразделяющиеся на две группы. В основу классификации положена природа активных промежуточных продуктов реакций. Первую группу составляют процессы, в результате которых образуются активированные конъюгирующие агенты:
энергия субстрат
конъюгирующий ¾¾¾¾® активированный ¾¾¾¾® продукт
агент конъюгирующий агент конъюгации.
Для второй группы характерно образование активированного субстрата:
энергия конъюгирующий агент
субстрат ¾¾¾¾® активированный ¾¾–––––¾¾® продукт
субстрат конъюгации.
К первому типу относятся реакции метелирования, ацетилирования, образование глюкуронидов, гликозидов и сульфатов, к второму – аминокислотная конъюгация.
Реакции конъюгации катализируются ферментами трансферазами, переносящими заместитель в другое соединение.
В определенных ситуациях реакции конъюгации считаются высокоэффективными путями снижения токсичности некоторых ксенобиотиков. Наиболее изучены реакции конъюгации, в которых участвуют следующие молекулы.
1. Ацетат конъюгируется при участии ацетил-КоА с некоторыми ароматическими аминами и сульфонамидами. Ацетилирование катализируется соответствующими ацетил-трансферазами.

2. Глицин. Его конъюгация с бензойной кислотой, описанная Келлером в 1842 г. – одна из первых изученных реакций биотрансформации. Глицин служит также конъюгирующим агентом при метаболизме никотиновой кислоты.
 |
Глицин служит также конъюгирующим агентом при метаболизме никотиновой кислоты.

3. Глутатионовая конъюгация. Трипептид глутатион – эффективный конъюгирующий агент для конденсирования кольцевых систем – нафталина, антрацена, фенантрена.
Многие ксенобиотики выделяются в мочу в виде меркаптуровых кислот. Такие конъюгаты образуются в результате взаимодействия ксенобиотиков с глутатионом. Катализирует реакции глутатион-S-трансфераза.
 C4H9Br + Glu ¾¾® C4H9 – S – Glu ¾¾® C4H9S – Cys – Glu
C4H9Br + Glu ¾¾® C4H9 – S – Glu ¾¾® C4H9S – Cys – Glu
 бромбутан глутатион ¯
бромбутан глутатион ¯
глутаминовая
кислота
|
¯
C4H9 – S – CH2CHOOH ¾¾ C4H9 – S – CH2CHCOOH
NHCOCH3 NH2
меркаптуровая кислота цистеин
Меркаптуровые кислоты образуются в довольно сложной последовательности. На первой стадии экзогенное соединение или его метаболит реагирует с глутатионом, являющимся компонентом многих клеток. Последующий гидролиз двух аминокислотных групп приводит к образованию серосодержащей аминокислоты – цистеина, который затем ацетилируется с образованием меркаптуровой кислоты.
Глутатион принимает участие в реакциях биотрансформации таких устойчивых ксенобиотиков, как нафталин.
Наиболее изучены реакции конъюгации, в которых участвуют следующие молекулы.

4. Алкилирование с участием метионина и этионина. Таким образом метилируется пиридин, пирогаллол; сульфиты, селениты, теллуриты подвергаются биологическому метилированию и превращаются в летучие диметильные производные.
5. Орнитин используется при детоксикации бензойной кислоты в организме рептилий и птиц, а аргинин – в организме членистоногих.
6. Глутамин у приматов используется для конъюгации фенилуксусной кислоты и некоторых ее гетероциклических аналогов.
7. Рибоза и глюкоза. Оба соединения часто используются для конъюгации; конъюгаты глюкозы особенно широко представлены в растениях, у моллюсков и насекомых. Способность растений гликолизировать ксенобиотики была открыта в 1938 г. Д. Миллером, который установил превращение этиленхлоргидрина в 2-хлор-этил--D-глюкозид в клубнелуковицах гладиолуса:
 |
Гликозирование является основным путем детоксикации растениями чужеродных фенолов, при этом образуются довольно сложные соединения. Примером может служить продукт конъюгации пентахлорфенола с глюкозой.
Среди млекопитающих глюкозидная конъюгация встречается в организмах кролика, мышей, крыс и человека. Реакция происходит в две стадии и катализируется УДФ-глюкозопирофосфорилазой и УДФ-глюкозилтрансферазой.

8. Конъюгация ксенобиотиков с глюкуроновой кислотой (образование глюкуронидов) – наиболее важный механизм детоксикации ксенобиотиков. В реакции участвует активная форма глюкуроновой кислоты – УДФГ. Катализирует процесс уридиндифосфатглюкуронозилтрансфераза (УДФГТ), локализованная в мембранах ЭР гепатоцитов, легких, кожи, кишечника, почек.
Глюкуроновая кислота – это 6-карбоксильное производное глюкозы – используется для конъюгации с ксенобиотиками у большинства позвоночных и всех млекопитающих. Она имеет преимущество перед глюкозой как детоксицирующий агент, поскольку содержит ионизируемую группу. Конъюгации подвергаются спирты, фенолы, карбокислоты, амины, гидроксиламины, карбамиды, сульфонамиды и тиолы.
При переносе глюкуроновой кислоты из донорной молекулы – уридиндифосфоглюкуроновой кислоты (УДФГ) – в акцепторное вещество путем ферментативной реакции образуются глюкурониды.
Образование b-D-глюкуронидов:

9. Лигнин. В последнее время в растениях удалось обнаружить новый тип конъюгата – нерастворимые конъюгаты с лигнином. С ним могут ковалентно связываться молекулы пестицидов 2,4-Д (дихлорфеноксиуксусная кислота), пентахлорфенола, а также 3,4-ди-хлоранилина.
10. Сульфатная конъюгация (сульфатирование) – эволюционно один из древних видов биотрансформации. В нее вступают фенолы, спирты, ароматические амины, гидроксиламины, некоторые стероиды. Происходит с участием сульфат-аденилтрансферазы, аденил-сульфаткиназы, возможно, и других ферментов группы сульфотрансфераз, локализованных в цитоплазме гепатоцитов и других клеток. В этом случае донорной молекулой является 3’-фосфоадено-5’-фосфосульфат (ФАФС).

В некоторых случаях сульфатная конъюгация приводит к появлению канцерогенного вещества, взаимодействующего с нуклеиновыми кислотами.
Описаны также и другие виды конъюгации (например, фосфатная конъюгация, а также реакция ксенобиотиков с глицинтаурином и формилом). Некоторые из видов конъюгации встречаются редко и мало исследованы, что подчеркивает недостаточную степень изученности реакций биотрансформации.
Необходимо подчеркнуть, что конъюгирование является обезвреживанием вещества лишь для данного организма.
Дегалогенирование. Формально реакции дегалогенирования хлорсодержащих ксенобиотиков могут относиться к описанным выше преконъюгационным классам реакций, но экологическая важность этих процессов требует к себе более внимательного отношения.
К хлорсодержащим ксенобиотикам относятся многие персистентные поллютанты, в том числе пестициды, а также ряд природных метаболитов низших растений.
Проблемы дегалогенирования освещены на примерах ДДТ, 2,4-Д, 2,4-Т, 2,3,7,8-тетрахлордибензо-n-диоксина и т. д.
Можно выделить следующие виды реакций дегалогенирования: 1) гидролитические, 2) восстановительные, 3) окислительные.
1. Гидролитическое дегалогенирование изучено у хлорированных алифатических кислот. Наблюдается также при деградации ароматических пестицидов после расщепления их кольца. Например, гербицид 2,4-Д деградируется почвенными бактериями с участием реакции этого типа.
2. Восстановительное дегалогенирование. Это реакция замещения атома галоида на водород. Многие бактерии, грибы, водоросли таким образом трансформируют ДДТ в ДДД. Возможно, таким же образом микроорганизмы могут отщеплять хлор и от алициклических молекул, например от линдана (g-гексахлорциклогексана). При восстановительном дегалогенировании могут образоваться интермедиаты, токсичные для клеток.
3. Окислительное дегалогенирование. Реакции этого типа подразделяются на ряд классов: а) дегидрогалогенирование; б) окислительное дегалогенирование с образованием двойной связи; в) дегалогенирование – гидроксилирование с участием молекулярного кислорода.
Дегидрогалогенирование (а) изучено, например, при метаболизме ДДТ. Одним из продуктов его деградации является ДДЕ. Фермент, осуществляющий эту реакцию, назван ДДТ-дегидрохлориназой. Эту же реакцию (ДДТ®ДДЕ) осуществляют и микроорганизмы.
Окислительное дегалогенирование (б) с образованием двойной связи описано при разложении почвенными микроорганизмами этилендибромида, который превращается в этилен, а также при биотрансформации линдана.
Дегалогенирование – гидроксилирование с участием молекулярного кислорода (в) – происходит при участии моно- и диоксигеназ.
Монооксигеназы, как показано, могут участвовать в деградации многими микроорганизмами хлорированных феноксиалкановых кислот. Бактериальная монооксигеназа может отщеплять от ароматического кольца фтор в процессе гидроксилирования.
Диоксигеназы могут участвовать в метаболизме, например фторзамещенных ароматических соединений и гербицида пиклорама.
Итак, метаболические превращения ксенобиотиков можно дополнительно классифицировать с учетом природы ферментов, участвующих в реакциях:
Окисление микросомальными ферментами: гидроксилирование ациклических, ароматических и алициклических соединений, эпоксидирование, дезалкилирование, дезаминирование и сульфирование.
Восстановление микросомальными ферментами: восстановление нитро- и азосоединений.
Немикросомное окисление: дезаминирование, окисление спиртов и альдегидов, ароматизация алициклических соединений.
Немикросомное восстановление: восстановление альдегидов и кетонов.
Гидролиз: гидролиз сложных эфиров и амидов с участием микросомальных и немикросомальных ферментов.
Прочие реакции: сюда относятся дегидроксилирование катехолов и гидроксамовых кислот, дегалогенирование, разрыв кольца, образование кольца, восстановление ненасыщенных соединений, восстановление дисульфидов в тиолы, окислительное расщепление мышьяковистых соединений в арсеноксиды и т. д.
Основная тенденция метаболических процессов в организмах высших животных заключается в снижении сложности молекулы, введении в нее при необходимости полярных заместителей и в дальнейшем повышении растворимости в воде посредством сопряжения (конъюгирования) еще до вывода из организма с последующей секрецией.
Совместное функционирование обоих стадий метаболизма ксенобиотиков весьма эффективно. В подавляющем большинстве случаев оно обеспечивает обезвреживание десятков тысяч ксенобиотиков из самых разных классов: токсических веществ, мутагенов, канцерогенов и т. д.
Функционирование всех ферментов второй стадии ограничивается тем, что они метаболизируют только имеющие функциональные группы вещества. Именно поэтому эти ферменты чаще включаются после образования или высвобождения функциональных групп ферментами первой стадии, т.е. во второй стадии метаболизма. Однако трансферазы обладают важными достоинствами:
- они имеются во всех клетках;
- функционируют при любых путях поступления ксенобиотиков в организм;
- осуществляют или завершают детоксикацию, а иногда исправляют ошибки стадии диссимиляции. Так, они обезвреживают токсичные метаболиты ПАУ (канцерогены), хлороформа (фосген), парацетомола и др.
Правда, теперь обнаружено, что и эти ферменты могут токсифицировать некоторые ксенобиотики, но это встречается реже, чем для систем цитохрома Р-450.
Метаболизм ксенобиотиков происходит в разных частях клетки, но наиболее активные системы находятся ЭР и гиалоплазме. Это обеспечивает метаболизм или связывание ксенобиотиков на подступах к наиболее жизненно важным частям клетки – ядру, митохондриям, а в случае растений и хлоропластам. В результате увеличивается устойчивость клеток и организма к неблагоприятным факторам внешней среды.
Следует также сказать об индукции защитных систем организма. Еще в древности Митридат систематически принимал небольшие дозы яда, чтобы избежать отравления. «Эффект Митридата» основан на индукции соответствующих защитных систем на действие определенных веществ (табл.)
Таблица 8.1
Индукция систем защиты от ксенобиотиков
| Наименование системы | Фенобар-битал | Дибунол, бутилгидр- оксианизол | Металлы | Противораковые лекарства, другие гидрофобные вещества |
| Система цитохрома Р-450 | + | |||
| Эпоксидгидролазы | + | |||
| Глутатион- и УДФ-глюкоронилтрансферазы | + | + | ||
| Синтез GSH | + | + | + | |
| Металлотионинны | + | |||
| Р-гликопротеин | + |
Данные таблицы говорят о том, что фенобарбитал индуцирует систему цитохрома Р-450, глутатион- и УДФ-глюкоронилтрансферазы и эпоксидгидролазы; дибунол (бутилокситолуол) и бутилоксианизол – эти же трансферазы и ферменты синтеза глутатиона; противораковые лекарства – Р-гликопротеин и синтез глутатиона; металлы вызывают накопление обоих видов связывающих их SH-веществ. В результате возрастает устойчивость клеток и организма к ядам и лекарствам. Так, снотворное действие фенобарбитала постепенно все больше снижается. Курсовое введение фенобарбитала у новорожденных увеличивает связывание и, следовательно, обезвреживание свободного билирубина при наследственном дефекте этой системы или гемолитической желтухе. При химиотерапии злокачественных процессов начальная эффективность лекарства часто постепенно падает, более того, развивается множественная лекарственная устойчивость не только к этому средству, но и целому ряду других. Вещества, ингибирующие Р-гликопротеин или его индукцию и ферменты синтеза глутатиона, перспективны для повышения эффективности химиотерапии.