Вопрос № 2. Твердое топливо. Переработка угля
МЕТОДИЧЕСКАЯ РАЗРАБОТКА
Для проведения лекционного занятия
по дисциплине «Химия»
для курсантов 1 курса по специальности 280705.65 –
«Пожарная безопасность»
РАЗДЕЛ IV
ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА ОРГАНИЧЕСКИХ ВЕЩЕСТВ
ТЕМА 4.15
ОРГАНИЧЕСКОЕ ТОПЛИВО И ЕГО ПЕРЕРАБОТКА
ЗАНЯТИЕ № 4.15.1
ОРГАНИЧЕСКОЕ ТОПЛИВО И ЕГО ПЕРЕРАБОТКА
Обсуждена на заседании ПМК
протокол №__ от «___»________2014г.
Владивосток
2014 г
I. Цели занятия
Учебная: познакомить с природными источниками получения органических веществ, пожарной опасностью различных видов топлив и особенностями их переработки; Воспитательная: воспитывать у обучаемых чувство ответственности за подготовку к дальнейшей практической деятельности.
II. Расчет учебного времени
| Содержание и порядок проведения занятия | Время, мин | Примечание |
| ВВОДНАЯ ЧАСТЬ | ||
| ОСНОВНАЯ ЧАСТЬ | ||
| Учебные вопросы | ||
| 1. Классификация топлива и его основные характеристики | ||
| 2. Твердое топливо. Переработка угля | ||
| 3. Жидкое топливо. Первичная и вторичная переработка нефти | ||
| 4. Газовое топливо и его переработка | ||
| ЗАКЛЮЧИТЕЛЬНАЯ ЧАСТЬ |
III. Литература
Основная
1. Глинка Н.Л. Общая химия: Учебное пособие для вузов/ Под ред. А.И. Ермакова. – изд. 30-е, исправленное-М.: Интеграл-Пресс, 2007.-728 с.
2.Е.Г. Коробейникова, А.П. Чуприян, В.Р. Малинин, Г.К. Ивахнюк, Н.Ю. Кожевникова. Химия. Курс лекций Учебное пособие по спец. 280104.65 – Пожарная безопасность. /Под ред. Проф. В.С.Артамонова /СПб.: Санкт-Петербургский университет ГПС МЧС России, 2008 г. – 425 с.
Нормативно-правовые документы
1. ГОСТ 12.1.004 – 89 . Пожаровзрывоопасность веществ и материалов. Номенклатура показателей и методы их определения.
IV. Учебно-материальное обеспечение
1. Технические средства обучения: телевизор, видеомагнитофон, DVD-проигрыватель, компьютерная техника, интерактивная доска.
2. Периодическая система элементов Д.И. Менделеева, демонстрационные плакаты, схемы.
Тема 15. ОРГАНИЧЕСКОЕ ТОПЛИВО И ЕГО ПЕРЕРАБОТКА
В настоящее время основным источником энергии на Земле
является химическая энергия топлива.
Вопрос № 1. Классификация топлива и его основные
Характеристики.
1. По агрегатному соотоянию топливо подразделяется на твердое (каменный и бурый угли, горючие сланцы, торф, древесина ), жидкое ( нефть и продукты переработки топлива: бензин, керосин, мазут и т.п.), газообразное или газовое(природный газ и продукты переработки жидкого и твердого топлива).
2. По способу получения различают топливо естественное(например, уголь, нефть) и искусственное(например, керосин, генераторный газ).
Основные характеристики топлива
Важнейшей характеристикой топлива является его энтальпия (теплота сгорания). Из курса химической термодинамики Вы помните, что стандартной энтальпией сгорания DН0сгор. вещества называют тепловой эффект реакции окисления 1 моля вещества кислородом с образованием высших оксидов. Энтальпию (теплоту) сгорания обычно относят к стандартным условиям (Т = 298 К, р = 101,3 кПа). Расчет этой величины проводят в соответствии с законом Гесса, используя табличные значения стандартных энтальпий образования DН0обр. веществ, участвующих в реакции горения.
Например, энтальпию сгорания метана
СН4 + 2О2 = СО2 + 2Н2О(г)
можно подсчитать по уравнению
DН0сгор. (СН4) = DН0 (СО2) + 2DН0 (Н2О) - DН0 (СН4), кДж/моль.
Подставляя значения энтальпий образования продуктов горения и самого метана и принимая DН0 (О2) = 0, получаем
DН0сгор. (СН4) = (-393,5 - 2 × 241,8) - (- 74,5) = - 802,4 кДж/моль.
В энергетике свойства топлива обычно характеризуют его удельной теплотой сгорания, которая равна количеству теплоты, выделяющемуся при сгорании 1 кг жидкого или твердого топлива или 1 м3 газообразного топлива до образования высших оксидов. Чем выше теплота сгорания топлива, тем больше ценность этого топлива. Удельная теплота сгорания топлива Q т может быть рассчитана двумя способами.
1. По известному значению энтальпии сгорания
Q т = - DН0сгор × 1000 / М, кДж/кг, где
М - молярная масса, г/моль.
Для нашего примера удельная теплота сгорания метана составит
Q т = 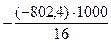 = 50142 кДж/кг.
= 50142 кДж/кг.
2. Значения низшей теплоты сгорания(удельной теплоты сгорания) материалов также могут быть рассчитаны по формуле Д.И.Менделеева
QН = 339,4 [C] + 1257 [H] - 108,9 { ([O] + [N]) - [S] } - 25,1 (9 [H] + [W]),
кДж/кг, где
[C], [H], [O], [N], [S], [W] - содержание (в процентах) углерода, водорода, кислорода, азота, серы и влаги в горючем веществе.
Следует отметить, что ввиду сложности состава природного топлива расчет удельной теплоты его сгорания затруднен, поэтому обычно ее определяют экспериментально.
Вопрос № 2. Твердое топливо. Переработка угля
В твердом топливе можно условно выделить его горючую и негорючую части. Горючая часть в основном состоит из пяти элементов: углерода, водорода, серы, кислорода и азота. К негорючей части топлива относятся неорганические вещества, переходящие после сжигания топлива в золу и влагу. Влага снижает теплоту сгорания топлива, т.к. на ее испарение расходуется теплота. На нагревание золы также расходуется теплота.
Удельная теплота сгорания различных видов твердого топлива колеблется в широких пределах:
каменный уголь 30 - 60 МДж/кг
бурый уголь 23 - 31 МДж/кг
торф 20 - 24 МДж/кг
горючие сланцы 14 -17 МДж/кг
древесина 13 - 18 МДж/кг
Для извлечения ценных компонентов и придания более удобного для использования вида твердое топливо подвергают химической обработке. Используются в основном три способа обработки твердого топлива:
пиролиз (сухая перегонка);
частичное окисление (конверсия);
гидрогенизация.
Мы рассмотрим процессы переработки наиболее распространенного вида твердого топлива – каменного угля.
Сухая перегонка угля (пиролиз)
"Один сумасшедший предлагает осветить Лондон, и чем бы, вы думали? Представьте себе - дымом!" Великий романист Вальтер Скотт, это его слова, ошибся. Оказалось, что в предложении одного из английских ученых У. Мурдока освещать улицы городов газом, образующимся при сухой перегонке каменного угля, нет ничего утопического. Сначала в Англии, а с 1863 года и в Петербурге задымили трубы газовых заводов. Яркие язычки газовых рожков осветили Невский проспект. Так началась история химической переработки каменного угля.
Каменный уголь, как и другое органическое топливо, состоит в основном из углерода и водорода, но углерода в каменном угле в пять-десять раз больше, чем в нефти. Чем старше каменный уголь, тем больше углерода в нем содержится. Наиболее богат им антрацит.
Пиролиз (от греч. "огонь" + "разложение, распад") - разложение и другие химические превращения химических соединений при нагревании без доступа воздуха.
Пиролиз каменного угля или коксование - это переработка каменного угля при 900 - 11000 С без доступа воздуха с целью получения каменноугольного кокса, коксового газа, каменноугольной смолы и других продуктов. На коксование отправляется в среднем 1/4 мировой добычи угля.
Основные виды коксохимической продукции (в % по массе): каменноугольный кокс 76 -78, коксовый газ 14 - 15, различные химические продукты 5 - 6.
Предварительно обогащенные (отделенные от минеральных примесей), измельченные до зерен размером менее 3 мм и тщательно перемешанные угли (шихту) нагревают до высокой температуры без доступа воздуха. Происходит разрыв некоторых химических связей и соответственно распад макромолекул, в результате чего образуется твердый остаток - кокс, жидкие и газообразные продукты.
Коксованию можно подвергать лишь некоторые типы каменных углей, так называемых коксующихся. Многие виды ископаемых углей, в том числе бурые, не коксуются, не образуют прочного кокса, нужного металлургии. Их обрабатывают методом полукоксования, отличающимся более низкой температурой нагрева (500-6000 С).
Первая и наиболее легкая фракция, образующаяся при коксовании – летучие продукты – представляют собой коксовый газ. Основными компонентами коксового газа являются (в объемных %):
водород Н2 58 - 62;
метан СН4 24,5 - 26,5;
оксид углерода (II) СО 5 - 6,7;
оксид уклерода (IV) СО2 1,6 - 3,0;
азот N2 2,0 - 3,5;
кислород О2 0,4 - 0,8;
прочие 2 - 2,5.
Из 1 тонны сухой угольной шихты получают 140-150 кг или 340-350 м3 газа. Поскольку в состав кокосового газа входит значительное количество горючих компонентов, он газ взрывоопасен (КПР от 6 до 30 %), а, кроме того, и токсичен.
Полученные газообразные продукты в дальнейшем используются как топливо для промышленных печей, и как источник ценных продуктов химической промышленности (водорода для получения аммиака, синтез-газа, метана и др.).
Часть летучих продуктов, образующихся при коксовании угля, при охлаждении превращаются в жидкую фракцию. Жидкая фракция состоит из двух основных частей – водной и органической.
Водная часть, помимо самой воды, включает в себя значительное количество аммиака. До внедрения в промышленность метода получения аммиака по Габеру из водорода и азота, переработка угля была основным источником получения аммиака.
Органическая часть жидкой фракции представляет собой каменноугольную смолу или каменноугольный деготь. Долгое время его считали нежелательным отбросом. Но в середине прошлого века точка зрения на каменноугольный деготь резко изменилась.
В 1825 году М. Фарадей открыл в каменноугольном дегте бензол. Позднее немецкий химик Митчерлих синтезировал нитробензол C6H5NO2 из бензола, а вслед за этим выдающийся русский химик Зинин осуществил восстановление нитробензола в анилин C6H5NH2 . Анилин – основной продукт для получения многих красителей. Открытие Зинина оказало решающее влияние на судьбу каменноугольного дегтя – единственного тогда источника бензола.
Выход каменноугольной смолы составляет 3,5 % от массы угольной шихты. В состав смолы, которая представляет собой вязкую черную жидкость с характерным фенольным запахом, входит около 10 тысяч соединений, из которых выделено и идентифицировано более 450 (50 % от общей массы). Наиболее важными компонентами являются бензол, толуол, нафталин, антрацен, фенол, пиридин и другие ценные вещества.
Тяжелые фракции каменноугольной смолы представляют собой каменноугольные масла. Это вязкие жидкости от светло-желтого до темно-коричневого цвета с характерным фенольным запахом. Выход их примерно 30 % от массы каменноугольной смолы. Каменноугольные масла используют для дальнейшей химической переработки с целью получения различных веществ (фенола, нафталина, лаков и др.). Кроме этого на основе этих масел получают так называемые технические каменноугольные масла: для производства технического углерода (сажи) и дорожных покрытий; обмасливания углей (для предотвращения их смерзания); для консервирования древесины (масла - антисептики, например, креозотовое, применяются при пропитке шпал ); для приготовления технического мыла (применяются в дезинсекции, дезинфекции и в ветеринарной практике).
Каменноугольный кокс – твердый пористый продукт серого цвета, состоит на 85-98 % из углерода С, остальное приходится на золу. Кокс необходим в металлургии, с его помощью в доменных печах железная руда превращаетсяв чугун.
Газификация угля
Газификация твердых топлив - превращение углей, торфа, сланцев в горючий газ, состоящий главным образом из СО и Н2, при высокой температуре в присутствии окислителя (газифицирующего агента). Процесс проводится в газогенераторах, поэтому получаемые газы называются генераторными.
Газификацию твердых топлив можно рассматривать как неполное окисление углерода. Наиболее часто окислителями служат кислород, углекислый газ и водяной пар:
С + 0,5 О2® СО
С + СО2 ® 2СО
С + Н2О ® СО + Н2
Наряду с основными реакциями осуществляются следующие:
С + О2 ® СО2
СО + Н2О ® СО2 + Н2
С + 2Н2 ® СН4
СО + 3Н2 ® СН4 + Н2О
СО + Н2 ® 0,5СН4 + 0,5 СО2 .
Таким образом, прямой продукт газификации (так называемый сырой газ) помимо основных компонентов СО и Н2 всегда содержит некоторые количества СО2, СН4 и Н2О, а при использовании воздуха - еще и N2.
Газ, который получают по реакции С + Н2О ® СО + Н2,
называют также водяным газом. Водяной газ применяется в производстве углеводородов, метанола и др. (в этих случаях он называется синтез-газом или сигазом). Теплота сгорания водяного газа достаточно высока - до 12 МДж/м3.
В 1888 году Д.И. Менделеевым была предложена идея подземной газификации угля. "...Настанет, вероятно, со временем даже такая эпоха, что угля из земли вынимать не будут, а там в земле его сумеют превращать в горючие газы", - писал Менделеев. Позднее, в 1912 году эту идею высказал и У. Рамзай.
Подземная газификация твердых топлив - это превращение угля, сланцев, торфа непосредственно на месте их залегания в недрах земной коры в горючий газ, который выводят на поверхность через буровые скважины. Разработано несколько методов подземной газификации угля, однако по ряду экономических и других причин широкой практической реализации они пока не получили.
Гидрогенизация угля
Пригидрогенизации (каталитическом гидрировании ) измельченное твердое топливо реагирует с водородом в присутствии катализаторов при температуре около 5000 С и высоком давлении. В результате реакции образуются жидкие и газообразные продукты: бензин, минеральные масла, метан и др.
Научные основы процесса были разработаны в начале 20 века В.Н. Ипатьевым, Н.Д.Зелинским, Ф. Бергиусом, Ф. Фишером и др.
Сравнение химического состава угля и нефти показывает, что нефть содержит гораздо больше связанного водорода, чем уголь. Зато в угле имеются связанный кислород, сера и углекислый газ, которые представляют собой "нежелательные примеси". Их особенно много в буром угле. Если нужно превратить такое сырье в бензин, дизельное топливо и т.п., от этих примесей избавляются путем гидрирования под давлением. При этом примеси восстанавливаются, переходят в летучие водородные соединения и отгоняются.
S + H2 ® H2S
0,5O2 + H2 ® H2O
Для такого процесса необходимо значительное количество водорода, который вместе с оставшимся углеродом образует углеводородные смеси, подобные нефтяным фракциям.
В 30-х годах в некоторых странах, в частности в Германии и Великобритании, были построены первые промышленные предприятия для получения из угля бензина, дизельного топлива, фенолов, смазочных масел. Гидрогенизация угля в промышленном масштабе в нашей стране была освоена в 50-х годах. В это же время, в 50-х годах, производство синтетического жидкого топлива во всем мире практически прекратилось. Это было связано с открытием в этот время богатых нефтяных месторождений и СССР, на Ближнем востоке и других районах. Цена синтетического топлива была в 5-7 раз выше моторного топлива, получаемого из нефти.
Однако в 70-х годах цена на нефть резко повысилась. Кроме того, стало очевидным, что при существующих масштабах потребления нефти (~ 3 млрд. т/год) запасы ее, пригодные для добычи экономичными методами, будут истощены в начале 21 века. Запасы же угля по расчетам будут истощены только к 27 веку. Проблема вовлечения твердого топлива, главным образом угля, в переработку для получения жидких продуктов - заменителей нефти стала вновь актуальной.
В общем виде процесс получения синтетического жидкого топлива можно представить в следующем виде:
nCO + 2nH2 = (CH2)n + nH2O
2nCO + nH2 = (CH2)n + nCO2
В свою очередь смесь водорода и окиси углерода получают методом газификации угля.
Первичным продуктом синтеза является смесь насыщенных углеводородов и алкенов с различной длиной цепи атомов углерода. При разгонке получают газы типа пропана и бутана, а также бензин, дизельное масло. Однако качество такого бензина из-за низкого октанового числа невелико и в дальнейшем его подвергают дополнительной обработке.