Вопрос № 1. Скорость химической реакции. . Факторы, влияющие на скорость реакции. Закон действующих масс (25 мин.)
МЕТОДИЧЕСКАЯ РАЗРАБОТКА
Для проведения лекционного занятия
по дисциплине «Химия»
для курсантов 1 курса по специальности 280705.65 –
«Пожарная безопасность»
РАЗДЕЛ II
ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ПРОТЕКАНИЯ
ХИМИЧЕСКИХ ПРОЦЕССОВ
ТЕМА 2.9
ЭЛЕМЕНТЫ ХИМИЧЕСКОЙ КИНЕТИКИ
ЗАНЯТИЕ № 2.9.1
ВВЕДЕНИЕ В ХИМИЧЕСКУЮ КИНЕТИКУ.
СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ
Обсуждена на заседании ПМК
протокол №__ от «___»________2014г.
Владивосток
2014 г.
I. Цели занятия
Учебные: Введение в химическую кинетику; изучить влияние температуры, давления, концентрации реагирующих веществ на скорость реакций. Управление скоростями химических реакций.
Воспитательная: воспитывать у обучаемых ответственность за подготовку к практической деятельности.
II. Расчет учебного времени
| Содержание и порядок проведения занятия | Время, мин |
| ВВОДНАЯ ЧАСТЬ | |
| ОСНОВНАЯ ЧАСТЬ | |
| Учебные вопросы | |
| 1. Скорость химической реакции. Основные термины Факторы, влияющие на скорость реакции. Закон действующих масс | |
| 2. Правило Вант-Гоффа, уравнение Аррениуса. Энергия активации | |
| 3. Катализ. Управление скоростями химических реакций. | |
| 4. Химическое равновесие | |
| ЗАКЛЮЧИТЕЛЬНАЯ ЧАСТЬ |
III. Литература
Основная
1. Глинка Н.Л. Общая химия: Учебное пособие для вузов/ Под ред. А.И. Ермакова. – изд. 30-е, исправленное-М.: Интеграл-Пресс, 2007.-728 с.
2.Е.Г. Коробейникова, А.П. Чуприян, В.Р. Малинин, Г.К. Ивахнюк, Н.Ю. Кожевникова. Химия. Курс лекций Учебное пособие по спец. 280104.65 – Пожарная безопасность. /Под ред. Проф. В.С.Артамонова /СПб.: Санкт-Петербургский университет ГПС МЧС России, 2008 г. – 425 с.
3. Некрасов Б.В. Основы общей химии. – 4-е изд.,- СПб: Изд-во «Лань», 2003. - 656 с.
Дополнительная
1. Суворов А.В., Никольский А.Б. Вопросы и задачи по общей химии., - СПб: Химиздат, 2002.- 304 с.
Нормативно-правовые документы
1. СП 13130.2009.. Определение категорий помещений, зданий и наружных установок по взрывопожарной и пожарной опасности.
IV. Учебно-материальное обеспечение
1.Технические средства обучения: компьютерная техника ( РМП, П), интерактивная доска.
2. Периодическая система элементов Д.И. Менделеева, демонстрационные плакаты, схемы.
Текст лекции
Тема 9. ХИМИЧЕСКАЯ КИНЕТИКА И РАВНОВЕСИЕ
ВВОДНАЯ ЧАСТЬ (3 мин.)
Преподаватель проверяет наличие слушателей (курсантов), объявляет тему, учебные цели и вопросы занятия.
ОСНОВНАЯ ЧАСТЬ ( 85 мин)
Расчет термодинамических функций состояния дает ответ на вопрос о принципиальной возможности протекания той или иной реакции и некоторых условиях ее проведения. Однако термодинамика не дает ответа на вопрос, как быстро пойдет данная реакция, пойдет ли она за месяц, год или век.
Рассмотрим реакцию С + О2 ® СО2. Термодинамический расчет показывает, что реакция возможна. Но кусок угля годами может лежать на воздухе, не претерпевая никаких изменений. Однако изменение условий проведения процесса (например, нагрев) изменит и скорость протекания этой реакции.
Химическая кинетика занимается исследованием течения реакций во времени. Другими словами, химическая кинетика – учение о скоростях и механизмах химических реакций.
Химические реакции могут протекать с различной скоростью. Одни реакции идут быстро. К ним относятся, например, реакции горения, реакции с ионами (нейтрализация, образование осадков труднорастворимых веществ).
Существуют и медленные процессы. Это – коррозия, молекулярные реакции, переваривание пищи, процессы брожения и т.д.
Скорость одной и той же реакции зависит и от условий проведения процесса. Окисление глюкозы – показательный пример. В организме окисление глюкозы идет медленно. На воздухе при обычных условиях чистая глюкоза с кислородом не взаимодействует. А в жидком кислороде и в присутствии некоторых катализаторов она взрывается.
Вопрос № 1. Скорость химической реакции. . Факторы, влияющие на скорость реакции. Закон действующих масс (25 мин.)
Понятие “системы” было введено при изучении темы 6. При изучении законов химической кинетики различают системы гомогенные и гетерогенные. И определение скорости химической реакции для каждой их этих систем имеет свои особенности.
| Система | |
| гомогенная | Гетерогенная |
| система, состоящая из одной фазы | система, состоящая из нескольких фаз |
| Если реакция протекает в гомогенной системе, то она идет во всем объеме этой системы. Например, ионные реакции FeCl3 + 3KCNS ® Fe(CNS)3 + 3KCl | Если реакция протекает в гетерогенной системе, то она идет только на границе раздела фаз, образующих систему. Например, Zn + 2HCl ® ZnCl2 + H2 |
Скоростью гомогенной реакции называется изменение числа моль исходных или образующихся веществ (Dn) в единице объема (V) за единицу времени (Dt)
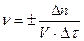 Отношение n/V = c (моль/л) называется молярной концентрацией. Следовательно, скорость реакции – это изменение концентрации в единицу времени
Отношение n/V = c (моль/л) называется молярной концентрацией. Следовательно, скорость реакции – это изменение концентрации в единицу времени
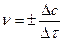 , моль/л×с. , моль/л×с.
| Скоростью гетерогенной реакции называется изменение числа моль исходных или образующихся веществ (Dn) в единицу времени (Dt) на единице площади поверхности (DS)
 Скорость гетерогенной реакции может определяться аналогично скорости гомогенной реакции, т.е.
Скорость гетерогенной реакции может определяться аналогично скорости гомогенной реакции, т.е.
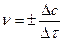 , моль/л×с. , моль/л×с.
|
| Если измеряют концентрацию убывающих исходных веществ, то выражение для скорости реакции будет иметь знак “-”, а если регистрируют возрастание концентрации продуктов реакции, то “+”. | |
В ходе реакции концентрация меняется непрерывно, поэтому правильно пользоваться истинными, т.е. мгновенными значениями скоростей в виде производной концентрации по времени:

|
(Все определения, формулы, графики и уравнения реакций даются под запись.)
Скорость химической реакции зависит от большого числа факторов: концентрация реагентов, их физическое состояние (агрегатное состояние, природа растворителя), степень измельчения твердой фазы, температура, наличие катализатора.
Но основными параметрами, которые приходится учитывать во всех процессах, являются концентрация реагентов, температура, действие катализатора.