Лабораторная работа 1. Биуретовая реакция
А.В. Анкудинова, В.Г. Шмелева,
Е.И. Помешалкин
Лабораторный практикум
По химии белка
Методические указания
Санкт-Петербург
УДК 577.112
Анкудинова А.В. Лабораторный практикум по химии белка [текст]: методические указания / А.В. Анкудинова, В.Г. Шмелева, Е.И. Помешалкин. – СПб.: СПбГТИ(ТУ), 2010. – 42 с.
В методических указаниях представлены основные лабораторные работы необходимые для практического изучения биохимических процессов в клетке.
Методические указания предназначены для студентов 3 курса факультета тонкого органического и микробиологического синтеза и соответствуют рабочей программе по дисциплине «Биологическая химия».
Табл. 6. Ил. 1. Библиогр. 4 назв.
Рецензент:
Д.О. Виноходов, д-р биол. наук, профессор кафедры молекулярной биотехнологии СПбГТИ(ТУ)
Утверждены на заседании учебно-методической комиссии факультета тонкого органического и микробиологического синтеза 21.09 .2010
Рекомендованы к изданию РИСо СПбГТИ (ТУ)
ВВЕДЕНИЕ
Биологическая химия является одной из наиболее важных теоретических дисциплин в системе биологического образования инженеров-технологов микробиологических производств.
Настоящие методические указания включают цикл лабораторных работ по разделу «Химия белка». Описанию каждой работы предшествует краткий теоретический материал с описанием механизмов протекания реакций. В конце даны контрольные вопросы, которые могут использоваться студентами для подготовки к контрольным работам, а также для самостоятельной работы.
ХИМИЧЕСКАЯ ПРИРОДА БЕЛКА
Среди органических соединений, встречающихся в клетке, первое место занимают белки – на их долю приходится не менее 50% сухого веса клетки. По химической природе белки представляют собой высокомолекулярные соединения, построенные из сотен или тысяч аминокислотных остатков. В белковых молекулах аминокислоты располагаются таким образом, что карбоксильная группа одной аминокислоты связана с -аминогруппой другой пептидной связью.
У аминокислот, имеющих две аминогруппы (лизин, аргинин) или две карбоксильные группы (аспарагиновая, глютаминовая), в реакцию образования пептидов вступают только те карбоксильные и аминогруппы, которые стоят у -углеродного атома.
Молекула белка состоит из одной или нескольких полипептидных цепей, соединенных между собой главным образом водородными связями. Кроме водородных связей в молекуле белка между полипептидными цепочками возникают и другие связи (например, эфирные, дисульфидные и др.), образованные за счет фенольных (тирозин), спиртовых (серин), сульфгидрильных (цистеин) и других групп, имеющихся в полипептидных цепочках.
Каждый тип белка обладает особым, свойственным только ему химическим составом, определенным молекулярным весом и специфической последовательностью аминокислотных остатков. Это и определяет разнообразие существующих в природе белков (табл. 1).
Присутствие белка в биологических объектах или растворах можно обнаружить с помощью цветных реакций, которые обусловлены наличием аминокислот в белке, их специфическими группами или пептидными связями.
Ряд химических веществ дает окраску продуктов реакции при взаимодействии с белками. Эти реакции применяются для качественного и количественного определения белка и присутствующих в нем аминокислот.
Таблица 1 – Аминокислоты, встречающиеся в белках
| Аминокислота | Формула | Сокра- щенное обозначение | |
| I Алифатические аминокислоты 1 Моноаминомонокарбоновые кислоты | |||
| Глицин (-аминоуксусная кислота) | 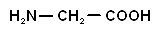
| гли | |
| Аланин (-аминопропионовая кислота) | 
| ала | |
| Валин (-аминоизовалериановая кислота) | 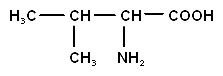
| вал | |
| Лейцин (-аминоизокапроновая кислота) | 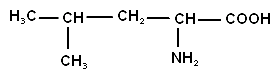
| лей | |
| Изолейцин (-амино--метил-валериановая кислота) | 
| илей | |
| Серин (-амино--окси-пропионовая кислота) | 
| сер | |
| Треонин (-амино--оксимасляная кислота) | 
| тре | |
| 2 Диаминомонокарбоновые кислоты | |||
| Лизин (,-диаминокапрновая кислота) | 
| лиз | |
| Аргинин (-амино--гуанидин-валериановая кислота) | 
| арг | |
| Продолжение табл.1 | |||
| 3 Моноаминодикарбоновые кислоты | |||
| Аспарагиновая (аминоянтарная кислота) | 
| асп | |
| Аспарагин (амид аспарагиновой кислоты) | 
| асн | |
| Глутаминовая (-аминоглутаровая кислота) | 
| глу | |
| Глутамин (амид глутаминовой кислоты) | 
| глн | |
| 4 Серосодержащие аминокислоты | |||
| Цистеин (-амино--тио-пропионовая кислота) | 
| цис | |
| Метионин (-амино--метил-тиомасляная кислота) | 
| мет | |
| II Ароматические аминокислоты | |||
| Фенилаланин (-амино--фенил-пропионовая кислота) | 
| фен | |
| Тирозин (-амино--гидрокси-фенилпропионовая кислота) | 
| тир | |
| Продолжение табл.1 | |||
| III Гетероциклические аминокислоты | |||
| Пролин (пирролидин--карбоновая кислота) | 
| про | |
| Триптофан (-амино--индолил-пропионовая кислота) | 
| три | |
| Гистидин (-амино--имидазолил-пропионовая кислота) | 
| гис | |
Существуют универсальные цветные реакции, которые дают все белки (биуретовая и нингидриновая). Кроме того, имеются специфические реакции, которые обусловлены наличием только определенных аминокислот в молекуле белка (ксантопротеиновая, Миллона, Фоля и др.); многие из них весьма чувствительны и высокоспецифичны, что позволяет открывать ничтожные количества той или иной индивидуальной аминокислоты в составе сложных смесей, биологических жидкостях, гидролизатах белков и т.п. На основании некоторых цветных реакций разработаны методы количественного определения белков и аминокислот.
Лабораторная работа 1. Биуретовая реакция
Биуретовая реакция получила свое название от производного мочевины – биурета, образующегося при нагревании мочевины с отщеплением от нее аммиака:

Биуретовая реакция открывает в белке пептидную связь

(она имеется и в биурете). Однако эту реакцию способны давать вещества, содержащие не менее двух пептидных связей.
При добавлении к сильно щелочному раствору белка или продукту его неполного гидролиза сульфата меди, образуются комплексные соединения меди, окрашенные в красно-фиолетовый или сине-фиолетовый цвет. Интенсивность окраски зависит от длины пептида.
Биуретовую реакцию дают аспарагин (амид аспарагиновой кислоты) и аминокислоты гистидин, треонин и серии.
Группа, образующая пептидную связь в щелочной среде, присутствует в своей таутомерной енольной форме:

При избытке щелочи происходит диссоциация ОН-группы, появляется отрицательный заряд, с помощью которого кислород взаимодействует с медью; кроме того, медь образует дополнительные координационные связи с атомами азота, участвующими в пептидной связи, путем использования их неподеленных электронных пар. Возникающий таким образом комплекс очень стабилен.
1 Цель работы - провести биуретовую реакцию, которая обнаруживает пептидные связи в белке
Приборы и материалы
Белок 1 %
Едкий натр 10 %
Сернокислая медь 1 %
Описание работы
К пяти каплям 1 % раствора белка прибавляют три капли 10 % раствора едкого натра, одну каплю 1 % раствора сернокислой меди и перемешивают. Содержимое пробирки приобретает сине-фиолетовый цвет.
Нельзя добавлять избыток сернокислой меди, поскольку синий осадок меди маскирует характерное фиолетовое окрашивание биуретового комплекса белка.
Контрольные вопросы
1. Наличие какой связи в молекуле белка обеспечивает протекание данной цветной реакции?
2. Все ли белки дают данную цветную реакцию
3. От чего зависит интенсивность окраски в биуретовом методе?
1.2 Лабораторная работа 2. Нингидриновая реакция на -аминокислоты
Растворы белка, пептидов и аминокислот дают синее или фиолетовое окрашивание с нингидрином при нагревании. Все аминокислоты можно рассматривать как С-замещенные производные аминоуксусной кислоты. При окислении они расщепляются:

В качестве окислителей можно применить органическое соединение - нингидрин (трикетогидринденгидрат):

Трикетогидринден Нингидрин
Сначала нингидрин восстанавливается аминокислотой до ендиола:
 1. Декарбоксилирование
1. Декарбоксилирование
2. Дезаминирование
3. Окисление
1. 




Ендиол
Затем конденсируется с аммиаком и второй молекулой нингидрина, образуя краситель типа мурексида (пурпурный Руэмана), который в нейтральных и слабощелочных растворах существует в виде окрашенного иона (аниона). Окраска обусловлена наличием всине-фиолетовом Руэмана цепи конъюгации с ионными зарядами по концам цепи:



В настоящее время нингидриновая реакция исключительно широко используется как для открытия отдельных аминокислот, так и для их количественного определения.
Сине-фиолетовый Руэмана на хроматограмме довольно быстро (в течение нескольких дней) разрушается. Чтобы избежать обесцвечивания пятен на хроматограмме, ее протаскивают через насыщенный раствор азотнокислой меди в 90 % ацетоне. При этом сине-фиолетовый Руэмана превращается в комплексную медную соль красного цвета. В таком виде, хроматограмма может храниться несколько месяцев.
1 Цель работы- провести качественную реакцию с нингидриновым реактивом на -аминокислоты
Приборы и материалы
Водяная баня
Электроплитка
Белок 1 %
Гидролизат белка
Аминокислота 2 %
Нингидрин 0,1 %
Описание работы
В 1-ю пробирку наливают пять капель 1 % раствора белка, во 2-ю – пять капель гидролизата белка, в 3-ю – 2 мл 2 % раствора аминокислоты. Во все три пробирки наливают пять капель 0,1 % водного раствора нингидрина и кипятят 1 – 2 мин. Наблюдают появление розово-фиолетового или сине-фиолетового окрашивания. Затем раствор синеет.
Контрольные вопросы
1.Что выявляет нингидриновая реакция?
2.В чем принцип метода?