ФАРМАЦЕВТИЧЕСКАЯ ТЕХНОЛОГИЯ
1. Государственная регламентация производства лекарственных препаратов и контроля их качества проводится по направлениям
· установления права на фармацевтическую деятельность
· нормирования состава прописей лекарственных препаратов
· установления норм качества лекарственных и вспомогательных веществ
· нормирования условий изготовления и технологического процесса
ü всем перечисленным
2. Сборником обязательных общегосударственных стандартов и положений, нормирующих качество лекарственных средств, является
· справочник фармацевта
· приказ МЗ по контролю качества лекарственных средств
· ГОСТ
ü ГФ
· GMP
3. Воздух помещений аптеки обеззараживают
· радиационной стерилизацией
· установкой приточно-вытяжной вентиляции
ü ультрафиолетовой радиацией
· обработкой дезинфицирующими средствами
· установкой приточной вентиляции
4. Биофармация как наука изучает биологическое действие лекарственных препаратов в зависимости
ü от физико-химических свойств лекарственных и вспомогательных веществ, лекарственной формы, технологии изготовления
· от функциональных групп
· от воздействия факторов окружающей среды
· только от технологии изготовления
· от технологического оборудования
5. В аптеку доставили посуду из инфекционного отделения больницы. Предстерилизационная обработка посуды, изделий и объектов в соответствии с действующей инструкцией по санитарному режиму будет включать виды деятельности
· удаление белковых веществ
· удаление жировых веществ
· удаление механических включений
· моюще-дезинфицирующую обработку
ü все вышеперечисленное
6. Утверждение, что «GMP (Good manufacturing practices) - это единая система требований по организации производства и контролю качества от начала переработки сырья до получения готового лекарственного препарата»
ü верно
· ошибочно
· требует уточнения
· находится в стадии разработки
· входит в содержание ФЗ РФ «О лекарственных средств»
7. Класс чистоты помещения устанавливают по предельно допустимому содержанию в 1 м3 воздуха
· аэрозольных частиц
· микроорганизмов
ü аэрозольных частиц определенного размера и микроорганизмов
· микроорганизмов и дрожжевых грибов
· углерода диоксида
8. Стерилизация любого объекта, в обязательном порядке, заключается в
· умерщвлении патогенных видов микроорганизмов на изделии
· умерщвлении патогенных микроорганизмов на поверхности
ü удалении из объекта микроорганизмов всех видов и находящихся на всех стадиях развития
· умерщвлении вирусов
· удалении из объекта дрожжевых грибов
9. Эффективность стерилизации сухим горячим воздухом зависит от
· температуры
· времени стерилизации
· степени теплопроводности стерилизуемых объектов
· правильности расположения объекта внутри стерилизационной камеры
ü всех вышеперечисленных факторов
10. Химическая стерилизация растворами применяется для стерилизации
· ваты
· пергамента
ü полимерных материалов
· фильтровальной бумаги
· марли
11. На флаконах со следующими растворами при оформлении к стерилизации, делают пометку о времени изготовления с учетом того, что интервал времени от изготовления этих растворов до начала стерилизации регламентируется
· с антибиотиками
· для офтальмологии
ü для инъекций
· для новорожденных
· для детей до 1 года
12. Интервал времени от начала изготовления инъекционных и инфузионных растворов до начала стерилизации не должен превышать (часов)
· 1,5
· 2
ü 3
· 6
· 12
13. Простерилизованные вата, марля, пергаментная бумага, фильтры до вскрытия биксов хранятся в аптеке (часов)
· 6
· 12
· 24
· 48
ü 72
14. К лекарственным веществам, разлагающимся с образованием летучих продуктов, относятся
· йодоформ
· водорода пероксид
· хлорамин Б
· натрий гидрокарбонат
ü все перечисленные
15. При обеспечении условий хранения и изготовления лекарственных препаратов необходимо учитывать, что углерода диоксид воздуха способен снижать качество растворов
· рибофлавина
ü эуфиллина
· кислоты борной
· анестезина
· магния сульфата
16. Высокой гигроскопичностью, которую учитывают при изготовлении любых лекарственных форм, обладает
· магний оксид
· калий перманганат
· теофиллин
ü кальций хлорид
· терпингидрат
17. Вспомогательное вещество нипагин выполняет в лекарственных формах роль
· пролонгатора
ü консерванта
· антиоксиданта
· регулятора рН
· изотонирующего компонента
18. Ронгалит, натрий метабисульфит, натрий сульфит применяют в качестве
· консерванта
ü антиоксиданта
· пролонгатора
· изотонирующего компонента
· корригента
19. Если врач в рецепте превысил разовую или суточную дозу ядовитого или сильнодействующего вещества, не оформив превышение соответствующим образом, провизор-технолог
· уменьшит количество лекарственного вещества в соответствии со средней терапевтической дозой
· вещество введет в состав лекарственного препарата в дозе, указанной в ГФ как высшая
· лекарственный препарат не изготовит
ü вещество в состав лекарственного препарата введет в половине дозы, указанной в ГФ как высшая
· вещество введет в половине дозы, выписанной в рецепте
20. Проводя перед изготовлением лекарственных препаратов фармацевтическую экспертизу прописей рецепта, технолог отметит, что к списку А относятся
· камфора
ü атропина сульфат
· кодеина фосфат
· висмута нитрат основной
· эфедрина гидрохлорид
21. Сделайте вывод о соответствии определения лекарственной формы «Порошки» определению ГФ ХI издания: «Порошки – это лекарственная форма для внутреннего и наружного применения, состоящая из одного или нескольких веществ и обладающая свойством дисперсности»
· соответствует
ü не соответствует
· следует добавить фразу «для парентерального применения»
· не соответствует, т.к. «Порошки – это сложная лекарственная форма…»
· следует добавить фразу «обладающая свойством однородности»
22. При разделительном способе выписывания порошков, пилюль, суппозиториев, масса вещества на одну дозу
· указана в рецепте
ü рассчитывается путем деления выписанной массы на число доз
· рассчитывается путем деления выписанной массы на число приемов
· рассчитывается путем умножения на число доз
· рассчитывается путем умножения на число приемов
23. При распределительном способе выписывания дозированных лекарственных форм масса вещества на одну дозу
ü указана в прописи
· является частным от деления выписанной массы на число доз
· является частным от деления общей массы на число приемов
· является результатом умножения выписанной в рецепте дозы на число доз
· является результатом умножения выписанной в рецепте дозы на число приемов
24. Измельчение и смешивание порошков начинают, затирая поры ступки веществом
· мелкокристаллическим
· аморфным
· жидким
ü относительно более индифферентным
· с малой насыпной массой
25. Первыми при изготовлении порошковой массы измельчают лекарственные вещества
· красящие
· выписанные в меньшей массе
· имеющие малое значение насыпной массы
ü трудноизмельчаемые
· теряющие кристаллизационную воду
26. Определяя массу 1 см3 порошка в условиях свободной насыпки и суховоздушном состоянии, устанавливают
· плотность
ü объемную (насыпную) массу
· фактор замещения
· расходный коэффициент
· обратный заместительный коэффициент
27. Легко распыляется при диспергировании
· тимол
· цинк сульфат
ü магний оксид
· магний сульфат
· резорцин
28. К лекарственным веществам с установленным НД нижним пределом влагосодержания относятся вещества
· кристаллические
· аморфные
· летучие
· липофильные
ü кристаллогидраты
29. В качестве наполнителя при изготовлении тритураций используют
· глюкозу
· крахмально-сахарную смесь
ü лактозу
· сахарозу
· фруктозу
30. При изготовлении 10 порошков по прописи, в которой выписан скополамина гидробромид распределительным способом в дозе 0,0003, следует взять тритурации
· 1:10-0,03г
· 1:10-0,3г
· 1:10-0,003г
ü 1:100-0,3г
· 1:100-0,03г
31. При изготовлении 10 порошков по прописи, в которой вещества выписаны распределительным способом в дозах: атропина сульфата 0,0003 и сахара 0,25, сахара на все дозы следует взять
· 2,5 г
· 2,45 г
· 2,30 г
ü 2,20 г
· 2,47 г
32. Выписанный в прописи рецепта экстракт белладонны соответствует
ü густому экстракту
· раствору густого экстракта
· жидкому экстракту
· раствору жидкого экстракта
· сухому экстракту
33. При изготовлении порошков по прописи, в которой выписано 0,24 экстракта белладонны разделительным способом на 12 доз, сухого экстракта взвесили
· 0,24 г
· 2,88 г
ü 0,48 г
· 0,12 г
· 5,76 г
34. При изготовлении 10 доз порошков по прописи, в которой выписано 0,015 экстракта белладонны распределительным способом сухого экстракта взвесили
· 0,15 г
ü 0,30 г
· 0,03 г
· 0,015 г
· 0,60 г
35. При изготовлении 10 доз порошков с использованием сухого экстракта по прописи, содержащей экстракта белладонны 0,15 и финилсалицилата 3,0 на все дозы, развеска порошка составила
· 0,31 г
· 0,30 г
· 0,32 г
ü 0,33 г
· 0,35 г
36. Заканчивают измельчение и смешивание порошков, добавляя вещества
ü имеющие малую насыпную массу
· трудноизмельчаемые
· с малыми значениями относительной потери при диспергировании
· аморфные
· с большой насыпной массой
37. Порошки упаковывают в пергаментные капсулы, если они содержат вещества
· сильнодействующие или ядовитые
· ядовитые и наркотические
ü летучие и пахучие
· гигроскопичные
· выветривающиеся (теряющие кристаллизационную воду)
38. В вощеные капсулы упаковывают порошки с веществами
· пахучими
· летучими
ü гигроскопичными
· только трудноизмельчаемыми
· имеющими неприятный вкус
39. В массо-объемной концентрации изготавливают растворы
ü этаноловые
· стандартных жидкостей, выписанных в прописи рецепта под условным названием
· этанола различной концентрации
· крахмала 2% концентрации
· глицериновые
40. Изменение объема и тепловой эффект растворения свидетельствуют о
· превышении предела растворимости
· механическом характере процесса
ü физико-химическом взаимодействии молекул растворителя и растворяемого вещества
· несовместимости и невозможности изготовления препарата
· необходимости предварительного нагревания и диспергирования
41. Для учета изменения объема, возникающего при растворении вещества, при расчетах следует использовать коэффициент
· обратный заместительный
· водопоглощения
ü увеличения объема
· расходный
· преломления
42. Процесс образования растворимой соли применяют при изготовлении растворов
· фурацилина
· этакридина лактата
ü осарсола
· йода
· свинца ацетата
43. При необходимости уменьшить размер частиц калия перманганата при изготовлении растворов его диспергируют
· С глицерином
· С эфиром
· С этанолом
ü без добавления вспомогательной жидкости
· со спирто-глицерино-водным раствором
44. Нагревание и тщательное перемешивание приведет к снижению качества раствора при растворении
· кофеина
· кислоты борной
ü натрия гидрокарбоната
· кальция глюконата
· кальция глицерофосфата
45. Концентрация йода в растворе Люголя для внутреннего применения составляет
ü 5%
· 3%
· 1%
· 0,5%
· внутрь не применяют
46. Если в прописи рецепта не указана концентрация раствора, изготавливают и выдают больному раствор
ü кислоты хлористоводородной (8,3%)
· водорода пероксида (30%)
· кислоты хлористоводородной (0,83%)
· формальдегида (30%)
· кислоты уксусной (10%)
47. Жидкость Бурова представляет собой раствор
· калия ацетата
· свинца ацетата
ü основного алюминия ацетата
· меди сульфата
· квасцов
48. Объем жидкости Бурова (мл), который необходимо взять для изготовления 200 мл 8% раствора жидкости Бурова равен
· 200мл
· 100мл
· 125мл
ü 16 мл
· 5 мл
49. Для изготовления 200мл 5% раствора формалина следует взять стандартного раствора (37%) и воды очищенной
ü 10 и 190 мл
· 10,8 и 189,2 мл
· 27 и 173 мл
· 10 и 200 мл
· 30 и 170 мл
50. Для изготовления 200 мл 5% раствора формальдегида стандартного (37%) раствора следует взять
· 10 мл
· 10,8 мл
ü 27 мл
· 29,4 мл
· 200 мл
51. Для изготовления 500 мл 3% раствора водорода пероксида пергидроль дозируют
· 50 мл
· 15 мл
ü 50,0 г
· 15,0 г
· 500 мл
52. Для повышения растворимости и ускорения процесса растворения при изготовлении водных растворов применяют
ü процесс образования растворимых солей
· прием дробного фракционирования
· предварительное диспергирование
· настаивание
· гомогенизацию
53. Натрия гидрокарбонат добавляют при изготовлении раствора
· фенола
· формалина
ü осарсола
· серебра нитрата
· фурацилина
54. При отсутствии в рецепте или другой НД указаний о концентрации спирта этилового применяют этанол
· 95 об.%
ü 90 об.%
· 80 об.%
· 70 об.%
· 40 об.%
55. Изготовление концентрированных растворов для глазных лекарственных форм и микстур детям в возрасте до 1 месяца отличается от изготовления концентратов для бюреточной установки стадией
· создания асептических условий изготовления
· стерилизации вспомогательных материалов и посуды
ü стерилизации раствора после изготовления в соответствии с НД
· фильтрования
· стандартизации
56. Объем воды очищенной, необходимый для изготовления 1 л концентрированного 50% раствора магния сульфата (КУО=0,5мл/г), составил
· 949 мл
ü 750 мл
· 922 мл
· 934 мл
· 500 мл
57. Объем воды очищенной, необходимый для изготовления 1л концентрированного 10% раствора кофеина натрия бензоата (плотность раствора= 1,0341 г/мл), составил
· 949 мл
· 750 мл
· 922 мл
ü 934 мл
· 900 мл
58. Для изготовления 1л раствора натрия гидрокарбоната 5% концентрации (КУО=0,30 мл/г) воды очищенной следует отмерить
· 1000 мл
· 995 мл
ü 985 мл
· 970 мл
· 950 мл
59. Для изготовления 500 мл 5% раствора натрия гидрокарбоната (плотность=1,0331 г/мл) воды очищенной отмеряют
· 516,5 мл
· 500 мл
· 495 мл
ü 491,5 мл
· 475 мл
60. При введении в состав микстуры 5,0 кальция хлорида отмеряют 10мл концентрированного раствора концентрации
· 20 %
· 1:5
· 10 %
ü 50 %
· 1:10
61. Изготавливая 200 мл раствора, содержащего 3,0 натрия бензоата (КУО=0,6 мл/г) и 4,0 натрия гидрокарбоната (КУО=0,3 мл/г), отмеряют воды очищенной
· 196,5 мл
ü 197 мл
· 198,2 мл
· 198,5 мл
· 202 мл
62. Объем воды очищенной, необходимый для изготовления 200мл 1% раствора натрия гидрокарбоната с использованием концентрированного раствора 5% концентрации, равен
· 180 мл
ü 160 мл
· 100 мл
· 200 мл
· 150 мл
63. Общий объем микстуры, изготовленной по прописи:
Analgini 7,0
Natrii bromidi 3,0 Tincturae Leonuri
Sirupi simplicis ana 5ml
Aquae purificatae 200ml
составляет
· 220 мл
· 217 мл
ü 210 мл
· 200 мл
· 205 мл
64. Число приемов микстуры с общим объемом 180 мл, дозируемой столовыми ложками, равно
· 9
ü 12
· 18
· 20
· 36
65. Разовая и суточная дозы кодеина, содержание которого 0,2 в 120 мл раствора, дозируемого столовыми ложками для приема 3 раза в день, составляют
· 0,05 и 0,2 г
ü 0,025 и 0,075 г
· 0,01 и 0,03 г
· 0,015 и 0,045 г
· 0,02 и 0,06 г
66. В первую очередь при изготовлении микстур дозируют
· концентрированные растворы
· вещества списка А
ü воду очищенную
· вещества списка Б
· вещества, находящиеся на предметно-количественном учете
67. Вещества списка А и наркотические вещества должны быть добавлены
· в первую очередь
ü после отмеривания воды очищенной
· после растворения в части воды очищенной и добавления в последнюю очередь
· до изготовления водного извлечения, одновременно с экстрагентом
· в воду очищенную, предназначенную для получения первичной эмульсии
68. Жидкости, содержащие этанол, добавляют к микстуре
· первыми
· после растворения ядовитых и наркотических веществ (до концентратов)
ü последними в порядке возрастания концентрации этанола
· последними в порядке уменьшения концентрации этанола
· в порядке выписывания в прописи рецепта
69. Раньше других жидкостей при изготовлении микстур добавляют
· пахучие
· летучие
· вязкие
· содержащие этанол
ü водные непахучие и нелетучие
70. Вода ароматная, выписанная в прописи рецепта в качестве дисперсионной среды, при изготовлении микстур добавляется
ü в первую очередь
· после концентрированных растворов
· до добавления жидкостей, содержащих этанол
· в последнюю очередь, т.к. содержит эфирное масло
· после растворения твердых лекарственных веществ
71. Для изготовления 30 мл изотонического раствора магния сульфата (изотонический эквивалент по натрию хлориду = 0,14) лекарственного вещества следует взять
· 4,2 г
· 6,4 г
ü 1,92 г
· 0,04 г
· 0,27 г
72. Для изготовления 10мл 1% раствора пилокарпина гидрохлорида следует взять натрия хлорида (изотонический эквивалент по натрию хлориду=0,22)
· 0,022 г
· 0,090 г
· 0,220 г
ü 0,068 г
· 0,680 г
73. Капли глазные, содержащие 0,2 пилокарпина гидрохлорида в 10мл воды очищенной (изотонический эквивалент по натрию хлориду = 0,22) слёзной жидкости
· изотоничны
ü гипотоничны
· гипертоничны
· изоосмотичны
· гиперосмотичны
74. Глазные капли – 10% раствор натрия тетрабората 10мл (изотонический эквивалент по натрию хлориду = 0,34) слёзной жидкости
· изотоничны
· гипотоничны
ü гипертоничны
· изоосмотичны
· гипоосмотичны
75. Вам предстоит изготовить глазные капли состава: Sol.Riboflavini 0.02% - 10ml
Acidi borici 0.2
Выберите оптимальный вариант изготовления
· растворение твердых веществ
· использование однокомпонентных концентрированных растворов
· использование комбинированных концентрированных растворов
· растворение твердых веществ и использование однокомпонентных стерильных концентрированных растворов
ü использование растворов стерильных комбинированного и однокомпонентного
76. При изготовлении глазных капель добавляют стабилизатор
· рибофлавина
· пилокарпина гидрохлорида
ü натрия сульфацила
· колларгола
· атропина сульфата
77. Стерилизуют термическим методом глазные капли, содержащие
· бензилпенициллин
· резорцин
· колларгол
ü левомицетин
· трипсин
78. Важное дополнительное требование к качеству воды для инъекций, в сравнении с водой очищенной
· слабокислые значения рН
· отсутствие хлоридов, сульфатов, ионов кальция и тяжелых металлов
· сухой остаток не более 0,001%
ü отсутствие пирогенных веществ
· содержание аммиака не более 0,00002%
79. Применение спирта этилового в составе комплексного растворителя для изготовления инъекционных растворов
ü регламентировано ГФ ХI
· не регламентировано
· регламентировано приказом № 214
· запрещено
· регламентировано приказом № 308
80. Применение бензилбензоата в составе комплексного растворителя для изготовления инъекционных растворов
· не регламентировано
ü регламентировано ГФ XI
· регламентировано приказом № 214
· запрещено
· регламентировано приказом № 308
81. Применение полиэтиленоксида (ПЭГ-400) в составе комплексного растворителя для изготовления инъекционных растворов
ü регламентировано ГФ XI
· не регламентировано
· регламентировано приказом № 214
· запрещено
· регламентировано приказом № 308
82. Для депирогенизации натрия хлорида перед изготовлением инъекционных растворов его предварительно
· стерилизуют насыщенным паром 120оС 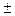 2оС 15минут
2оС 15минут
· обрабатывают углем активированным
ü подвергают термической стерилизации при 180оС в течение 2 часов
· стерилизуют насыщенным паром при 120оС 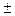 2оС 30 минут
2оС 30 минут
· используют воздушный метод стерилизации при 180оС в течение 1 часа
83. Особенностями депирогенизации натрия хлорида являются
· нагревание в открытой стеклянной или фарфоровой посуде
· нагревание при 180оС в течение 2 часов
· толщина слоя порошка не более 6-7см
· срок использования – в течение 24 часов
ü все вышеперечисленные
84. 40 % раствор гексаметилентетрамина для инъекций отличается от инъекционных растворов кофеина натрия бензоата, натрия тиосульфата, дибазола тем, что его
· изготавливают в асептических условиях
· подвергают стерилизации термическим методом без добавления стабилизатора
ü стерилизуют фильтрованием
· стабилизируют
· консервируют 0,05% раствором фенола
85. Натрий сульфит используют для стабилизации инъекционного раствора
· глюкозы 40%
ü натрия парааминосалицилата 3%
· кофеина натрия бензоата 10%
· новокаина 1%
· дибазола 0,5%
86. Вспомогательное вещество динатриевая соль этилендиаминтетрауксусной кислоты относится к группе
· пролонгаторов
· консервантов
ü антиоксидантов
· изотонирующих
· регуляторов осмотических свойств растворов
87. Для изготовления 500мл 25% раствора глюкозы следует взять водной глюкозы с влажностью 10%
· 250,0 г
· 200,0 г
· 150,0 г
ü 138,0 г
· 100,0 г
88. Для изготовления 400мл изотонического раствора натрия хлорида его следует взять
· 36,0 г
· 20,0 г
· 40,0 г
ü 3,6 г
· 2,0 г
89. В аптеках изготавливают инфузионные растворы
· гемодинамические
ü регуляторы водно-электролитного баланса и кислотно-основного равновесия
· переносчики кислорода
· дезинтоксикационные
· полифункциональные
90. При изготовлении микстур, содержащих пепсин, кислоту хлористоводородную и сироп сахарный, пепсин добавляют
· к кислоте хлористоводородной
· к сиропу сахарному
· к воде очищенной
ü к воде очищенной, после смешивания её с 0,83% раствором кислоты хлористоводородной
· после предварительного измельчения в ступке
91. При изготовлении растворов учитывается, что стадия набухания перейдет в стадию собственно растворения только при изменении условий растворения ВМВ, относящихся к группе
ü набухающих ограниченно
· набухающих неограниченно
· образующих студни
· образующих гели
· умеренно набухающих
92. Переход стадии набухания в стадию собственно растворения не требует изменения условий растворения при изготовлении растворов
· крахмала
· желатина
· ПВС
ü пепсина
· МЦ
93. Образование структуры геля при изготовлении растворов крахмала обусловлено, главным образом, содержанием
· амилозы
ü амилопектина
· декстрана
· амфолитов
· амилазы
94. Метилцеллюлоза, в отличие от таких вспомогательных веществ как натрий метабисульфит, нипазол, натрия сульфат, в глазных каплях выполняет роль
· антиоксиданта
· консерванта
ü пролонгатора
· стабилизатора химических процессов
· регулятора осмотических свойств растворов
95. Предупредительной надписью «Перед употреблением подогреть» снабжают растворы
· крахмала
· камедей
ü желатина
· желатозы
· метилцеллюлозы
96. Насыпают на поверхность воды при изготовлении растворов, не взбалтывая,
· колларгол
· пепсин
· крахмал
ü протаргол
· желатин
97. Набухание при комнатной температуре, а затем растворение при нагревании происходит при изготовлении растворов
· колларгола
· пепсина
· этакридина лактата
ü желатина
· протаргола
98. При изготовлении растворов диспергируют с водой или глицерином
ü колларгол
· пепсин
· протаргол
· желатин
· лидазу
99. Растворяют при нагревании
· пепсин
ü фурацилин
· колларгол
· висмут нитрат основной
· магния сульфат
100. Приливают к горячей воде в виде суспензии, затем растворяют при кипячении
· протаргол
· панкреатин
ü крахмал
· желатозу
· поливиниловый спирт
101. Колларгол при изготовлении раствора
· растворяют в горячей воде
ü растирают с водой до растворения
· насыпают на поверхность воды для набухания и последующего растворения
· растворяют при нагревании на водяной бане
· растворяют в изотоническом растворе натрия хлорида
102. Протаргол при изготовлении раствора
· Растирают с водой до растворения
· Растворяют в горячей воде
· Растворяют при нагревании
· Растворяют при интенсивном перемешивании
ü Насыпают на поверхность воды и оставляют для растворения
103. Смесь сульфидов, сульфатов и сульфонатов, полученных при сухой перегонке битуминозных сланцев, содержит
· колларгол
ü протаргол
· ихтиол
· сера
· нефть нафталанская
104. Правило оптимального диспергирования предполагает добавление вспомогательной жидкости к массе измельчаемого вещества в соотношении
· 1:1
ü 1:2
· 1:5
· 1:10
· 1:20
105. Без введения стабилизатора в аптеке могут быть изготовлены водные суспензии веществ
· дифильных
ü гидрофильных, не растворимых в воде
· гидрофильных
· с нерезко гидрофобными свойствами
· с резко гидрофобными свойствами
106. Суспензию серы стабилизирует с одновременным обеспечением оптимального фармакологического действия
· желатоза
· эмульгатор Т-2
ü мыло медицинское
· раствор крахмала
· гель МЦ
107. При изготовлении водных суспензий следует учитывать, что нерезко гидрофобными свойствами обладают
· ментол
· цинк сульфат
ü фенилсалицилат
· тимол
· цинка оксид
108. Седиментационная устойчивость дисперсной фазы в лекарственных формах, представляющих собой микрогетерогенные системы, прямо пропорциональна
· размеру частиц
· величине ускорения свободного падения
· разности значений плотности фазы и среды
ü вязкости дисперсионной среды
· времени хранения препарата
109. Скорость оседания частиц в суспензиях обратно пропорциональна
· радиусу частиц
· разности плотностей фазы и среды
ü вязкости среды
· величине ускорения свободного падения
· скорости диспергирования
110. Применение приема дробного фракционирования при изготовлении суспензий гидрофильных веществ основано на законе
ü Стокса
· Гиббса
· Фика-Щукарева
· Рауля
· Вант-Гоффа
111. Качество суспензий контролируют, определяя
· объем и отклонение от объема
ü ресуспендируемость
· время диспергирования
· вязкость среды
· значение рН
112. Эмульсии – это лекарственная форма, состоящая из
· диспергированной фазы в жидкой дисперсионной среде
ü тонко диспергированных, несмешивающихся жидкостей
· макромолекул и макроионов, распределённых в жидкости
· мицелл в жидкой дисперсионной среде
· нескольких жидкостей
113. Тип эмульсии обусловлен, главным образом
· массой масла
· массой воды очищенной
ü природой и свойствами эмульгатора
· природой вводимых лекарственных веществ
· размером частиц дисперсной фазы
114. При отсутствии указаний о концентрации в соответствии с ГФ XI для изготовления 100,0 эмульсии берут масла
· 50,0 г
· 5,0 г
ü 10,0 г
· 20,0 г
· 25,0 г
115. В случае выписывания в рецепте ароматной воды в качестве основной дисперсионной среды, концентрированные растворы лекарственных веществ, входящих в состав прописи
· используют
ü не используют
· используют, если концентрация лекарственных веществ до 3%
· не используют, если концентрация лекарственных веществ свыше 3%
· используют с уменьшением объема основного растворителя
116. При изготовлении эмульсий главной технологической операцией является
· предварительное измельчение лекарственных веществ
· гидрофилизация эмульгатора
ü изготовление первичной эмульсии
· разбавление первичной эмульсии
· введение водорастворимых веществ
117. Растворяют в воде очищенной, предназначенной для разведения первичной эмульсии
· сульфамонометоксин
· эфирные масла
ü новокаин
· фенилсалицилат
· ментол
118. Воду для образования первичной эмульсии используют
· для растворения водорастворимых веществ
· для измельчения веществ, вводимых по типу суспензии
ü для измельчения, гидрофилизации или растворения ПАВ
· для солюбилизации лекарственных веществ
· в качестве дисперсной фазы эмульсий для внутреннего применения
119. Водорастворимые вещества вводят в эмульсии
· растворяя в воде, используемой при получении первичной эмульсии
ü растворяя в воде, предназначенной для разведения первичной эмульсии
· растирая с готовой эмульсией
· растирая с маслом
· растворяя в эмульсии
120. Дополнительно введения стабилизатора при изготовлении эмульсий требуют
ü фенилсалицилат
· кофеин натрий бензоат
· висмут нитрат основной
· гексаметилентетрамин
· магния оксид
121. Эмульсии в аптеке изготавливают и контролируют
· По объему
· По объему с учетом плотности
ü По массе
· По массе или объему в зависимости от массы масла
· По массе или объему в зависимости от количества воды
122. Если принять обозначения: V- объем воды очищенной, взятый для экстракции
Vо- объем водного извлечения, указанный в рецепте
М – масса сырья
Кв- коэффициент водопоглащения, то
· V=Vо - (М 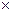 Кв)
Кв)
· V=Vо 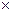 (М
(М  Кв)
Кв)
ü V=Vо + (М 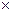 Кв)
Кв)
· V=Vо - (М  Кв)
Кв)
· V=Vо 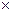 Кв + М
Кв + М 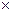 Кв
Кв
123. Определяя объем воды очищенной, удерживаемый 1,0 лекарственного растительного сырья после отжатия его в перфорированном стакане инфундирки, рассчитывают
· расходный коэффициент
ü коэффициент водопоглощения
· фактор замещения
· коэффициент увеличения объема
· обратный заместительный коэффициент
124. В аптеку поступил рецепт, содержащий пропись настоя травы горицвета весеннего без указания его концентрации. Вы изготовите настой в соотношении
· 1:400
ü 1:30
· 1:20
· 1:10
· 1:5
125. Общим для водных извлечений из корневищ с корнями валерианы, травы горицвета, корней истода является
· изготовление настоя
· изготовление отвара
· обязательный учет валора сырья
ü изготовление в соотношении 1:30
· немедленное процеживание после настаивания на водяной бане
126. Всегда изготавливают настои из лекарственного растительного сырья
· содержащего термостабильные вещества
ü содержащего термолабильные вещества
· мягкой гистологической структуры
· листьев
· семян
127. Настаивание при комнатной температуре в течение 30 минут, процеживание без отжатия соответствует получению водного извлечения из
· корневищ лапчатки
· плодов фенхеля
· корней истода
ü корней алтея
· листьев сенны
128. Полнота экстракции будет выше, если добавить натрия гидрокарбонат при получении водного извлечения из сырья, содержащего
· алкалоиды
ü сапонины
· дубильные вещества
· полисахариды слизистой природы
· эфирные масла
129. Изготавливать водные извлечения из лекарственного растительного сырья в одном инфундирном стакане
· нельзя
· можно
ü можно, если физико-химические свойства действующих веществ требуют одинакового режима экстракции
· можно, если гистологическая структура одинакова
· можно при условии одинакового измельчения
130. При изготовлении настоя травы термопсиса из 0,5-200 мг нестандартного сырья, содержащего 1,8% алкалоидов (при стандарте-1,5%), необходимо взять
· 0,25 г
ü 0,42 г
· 0,60 г
· 1,0 г
· 0,5 г
131. При получении аптекой нестандартного растительного сырья с более высокой активностью
· при изготовлении водных извлечений навеску сырья увеличивают
ü при изготовлении водных извлечений навеску сырья уменьшают
· сырье не используют, возвращая поставщику
· проводят стандартизацию сырья в аптеке
· сырье отправляют в контрольно-аналитическую лабораторию
132. При получении аптекой нестандартного растительного сырья с более низкой активностью
· при изготовлении водных извлечений навеску сырья увеличивают
· при изготовлении водных извлечений навеску сырья уменьшают
ü сырье не используют
· проводят стандартизацию сырья в аптеке
· сырье отправляют в контрольно-аналитическую лабораторию
133. Время нагревания настоев с пометкой «Cito» при искусственном охлаждении
· 10 минут
· 15 минут
ü 25 минут
· 30 минут
· 20 минут
134. С целью увеличения выхода алкалоидов при экстракции
ü экстрагент подкисляют
· экстрагент подщелачивают
· используют экстрагент нейтральной реакции
· производят насыщение углекислотой
· вводят солюбилизатор
135. Для изготовления 200 мл настоя корней алтея (Красх..=1,3) необходимо взять сырья и воды очищенной
· 6,5 г и 230 мл
ü 13,0 г и 260 мл
· 12,0 г и 224 мл
· 10,0 г и 200 мл
· 15,0 г и 250 мл
136. Для изготовления 150 мл настоя травы пустырника (Кв=2мл/г) следует взять воды очищенной
· 150 мл
· 160 мл
· 170 мл
ü 180 мл
· 190 мл
137. При изготовлении микстуры, содержащей настой травы пустырника, натрия бромид, натрия барбитал и настойку ландыша, натрия барбитал добавляют
ü к изготовленному настою в первую очередь
· после предварительного растворения в настойке ландыша
· после растворения в настое натрия бромида
· в последнюю очередь
· к рассчитанному объему экстрагента
138. Всегда изготавливают отвары из лекарственного растительного сырья
· грубой гистологической структуры
ü содержащего термостабильные вещества
· содержащие нелетучие вещества
· из корневищ и корней
· содержащего термолабильные вещества
139. При выборе оптимального процесса изготовления отвара из коры дуба учитывают особенность фильтрования, обусловленную физико-химическими свойствами действующих веществ. Отвар
· фильтруют после охлаждения в течение 10минут
· не фильтруют
· готовят, не отжимая сырье перед фильтрованием
· фильтруют после полного освобождения от смолистых веществ
ü фильтруют после экстракции на водяной бане
140. Особенностью технологии изготовления водных извлечений, содержащих дубильные вещества, является
ü отжатие и фильтрование без предварительного охлаждения
· добавление в экстрагент натрия гидрокарбоната
· добавление кислоты хлористоводородной для обеспечения полноты экстракции
· фильтрование без отжатия
· экстракция до полного охлаждения после экстракции на водяной бане
141. При изготовлении водных извлечений с применением жидких экстрактов- концентратов их добавляют в микстуру с учетом концентрации и свойств использованного экстрагента
· в первую очередь
· последними
ü до жидкостей с большой концентрацией этанола
· после жидкостей с большой концентрацией этанола
· до растворения твердых лекарственных веществ
142. При изготовлении водных извлечений из лекарственного растительного сырья концентрированные растворы лекарственных веществ
· используются
ü не используются
· ускоряют процесс экстракции
· обеспечивают стандартность препарата
· используются в соответствии с приказом № 214
143. Для изготовления 180 мл настоя травы пустырника с использованием экстракта-концентрата жидкого (1:2) следует взять воды очищенной
· 180 мл
· 162 мл
ü 144 мл
· 168 мл
· 174 мл
144. Для изготовления 120 мл настоя корней алтея с использованием экстракта-концентрата следует взять воды очищенной (КУО=0,61 мл/г)
ü 116 мл
· 110 мл
· 120 мл
· 114 мл
· 105,5 мл
145. Соли, эфирные масла и другие лекарственные вещества в состав растительных сборов
ü включают
· не включают
· включают только соли
· включают некоторые эфирные масла
· включают хлористоводородную кислоту
146. Если в рецепте выписана официнальная мазь, по нестандартной концентрации, в качестве основы используют
· вазелин
· сплав вазелина с ланолином
· консистентную эмульсию «вода-вазелин»
ü официнальную основу с пересчетом компонентов
· сплав вазелина с ланолином безводным
147. При изготовлении глазных мазей и мазей с антибиотиками, учитывая область применения, свойства лекарственных и вспомогательных веществ, отдают предпочтение основам
· липофильным
· гидрофильным
· адсорбционным
ü абсорбционным
· эмульсионным
148. ПАВ являются обязательным компонентом основ
· липофильных
· гидрофильных
ü абсорбционных
· гидрофобных
· липофобных
149. В качестве активатора высвобождения и всасывания лекарственных веществ из мазей применяют
· кислоту сорбиновую
· эсилон-5
ü димексид
· нипазол
· оксил
150. При изготовлении аммиачного линимента 10% раствор аммиака добавляют
· в первую очередь
· к маслу подсолнечному
ü после растворения олеиновой кислоты в масле
· к маслу подсолнечному при слабом нагревании
· к олеиновой кислоте до растворения в масле
151. Наиболее сложные многокомпонентные мази, содержащие несколько лекарственных веществ с различными физико-химическими свойствами – это
· растворы
· эмульсионные типа м/в
· гели
· суспензионные
ü комбинированные
152. По типу дисперсной системы мазь, содержащая камфору, вазелин, ланолин безводный, является
ü гомогенной (мазь-раствор)
· гомогенной (мазь-сплав)
· суспензионной
· эмульсионной
· комбинированной
153. По типу дисперсной системы мазь, содержащая эфедрин гидрохлорид, сульфадимезин, норсульфазол, ментол, ланолин, вазелин, является
· гомогенной (мазь-сплав)
· суспензионной
· эмульсионной
ü комбинированной
· гомогенной (мазь-раствор)
154. По типу дисперсной системы мазь, содержащая стрептоцид, кислоту салициловую, вазелин, является
· гомогенной (мазь-раствор)
ü суспензионной
· эмульсионной
· комбинированной
· гомогенной (экстракционной)
155. Фармакологическое действие мазей определяется
· физико-химическими свойствами лекарственных веществ
· концентрацией действующих веществ
· природой и концентрацией вспомогательных веществ
· характером технологического процесса
ü всем комплексом фармацевтических факторов
156. Персиковое, подсолнечное, оливковое масла могут быть использованы для предварительного диспергирования веществ, вводимых по типу суспензии в основы
ü жировые
· углеводородные
· гидрофильные
· эсилон-аэросильные
· гели ПЭО
157. Вазелиновое масло рекомендуется использовать для предварительного диспергирования веществ, вводимых по типу суспензии в основы
· жировые
ü углеводородные
· гели производных акриловой кислоты
· желатин-глицериновые
· гели ПЭО
158. Глицерин может быть использован для предварительного диспергирования веществ, вводимых по типу суспензии в основы
· липофильные
ü гидрофильные
· углеводородные
· полиэтиленовые
· силиконовые
159. Растительные экстракты (сухие и густые) при введении в состав мазей предпочтительно растирать
· с растительным маслом
· с минеральным маслом
ü со спирто-водно-глицериновой смесью
· с расплавленной основой
· с этанолом 90%
160. При введении лекарственных веществ по принципу образования суспензионных систем (суспензий водных и масляных, мазей) технолог учитывает, что к лекарственным веществам гидрофильного характера относятся
· тимол, тальк, глина белая
· камфора, фенилсалицилат, бентонит
· цинк оксид, крахмал, сера
ü магний оксид, глина белая
· сульфодиметоксин, ментол, висмута нитрат основной
161. Протаргол при изготовлении эмульсионной мази для носа, содержащей раствор адреналина гидрохлорида
· растворяют в растворе адреналина гидрохлорида
ü нельзя растворять в растворе электролитов
· вводят по типу суспензии
· образуют гомогенную мазь
· исключают из прописи
162. Какое вспомогательное вещество используется для стабилизации линимента Вишневского
· Бентонит
· МЦ
ü Оксил
· Na- КМЦ
· ПЭО
163. Эмульсионную мазь на абсорбционной основе образует
· ксероформ
· дерматол
ü новокаин
· висмута нитрат основной
· стрептоцид
164. При изготовлении дерматологической мази цинка сульфата на дифильной основе его
· растворяют в воде с учетом растворимости
ü вводят по типу суспензии
· растворяют в основе
· предварительно измельчают с основой
· измельчают с глицерином
165. При изготовлении мази серной следует взять основу
· вазелин, очищенный от восстанавливающих веществ
· вазелин-ланолин поровну
· гель ПЭО
ü консистентную эмульсию «вода-вазелин»
· гель МЦ
166. Для изготовления мазей с антибиотиками рекомендована основа
· консистентная эмульсия «вода-вазелин»
· вазелин-ланолин 1:1
· вазелин-ланолин безводный 9:1
ü ланолин безводный - вазелин 4:6
· вазелин - ланолин - масло оливковое 1:1:1
167. Лекарственные вещества в мази-пасты вводят
· С образованием различных дисперсных систем
· По типу эмульсии
ü По типу суспензии
· Путем растворения в расплавленной основе
· Путем измельчения в расплавленной основе
168. К типу дифильных основ для суппозиториев относится
· твердый жир, тип А
· масло какао
ü витепсол
· полиэтиленгликолевая основа
· жировая основа
169. При изготовлении суппозиториев методом ручного формирования применяют основу
· витепсол
· ланолевую
ü масло какао
· сплавы ПЭГ
· лазупол
170. При введении в состав суппозиторной массы раствора адреналина гидрохлорида в количестве, превышающем водопоглощающую способность основы
ü Его эмульгируют
· Его упаривают до минимального объема
· Его уменьшают по количеству
· Его исключают из состава препарата
· Препарат не изготавливают
171. К процессу изготовления только суппозиториев методом ручного формования относится
· Получение пластичной массы
· Взвешивание массы
· Формование цилиндра
ü Формование параллелепипеда
· Дозирование и формирование как единый процесс
172. Лазупол и витепсол широко применяются
· При изготовлении мазей
· При изготовлении суппозиториев методом ручного формирования
· При изготовлении болюсов
ü При изготовлении суппозиториев методом выливания в формы
· как консерванты
173. Используя формулу Х=3,14 х r2 х p x n x L можно сделать предварительные расчеты массы основы для изготовления
· свечей
· шариков
· глобулей
ü палочек
· пессариев
174. При изготовлении детских суппозиториев методом выливания в формы в аптеках рекомендована основа
ü твердый жир, тип А
· сплавы ПЭГ
· ланолевая
· глицериновая
· желатино-глицериновая
175. В соответствии с ГФ ХI визуально однородность суппозиториев определяют
· сделав поперечный срез
· рассмотрев предварительно деформированную массу
ü сделав продольный срез
· изучив поверхность суппозитория
· только до стадии дозирования
176. При изготовлении пилюль, содержащих алкалоиды и их соли, в качестве вспомогательных веществ применяют
· экстракт корней солодки
· алюминия оксид
· бентонит
ü крахмально-сахарную смесь
· ланолин безводный
177. Время растворения определяют для
· пилюль
ü суппозиториев на гидрофильной основе
· болюсов
· суппозиториев на липофильных и дифильных основах
· гранул (гомеопатических крупинок)
178. Под фармакокинетической несовместимостью понимают
· отсутствие терапевтического эффекта в результате разнонаправленного действия лекарственных веществ на рецептор
· нежелательные изменения физико-химических свойств лекарственных веществ и препарата в целом в процессе изготовления и хранения
ü изменение всасывания, распределения, метаболизма и выведения одного лекарственного вещества под влиянием другого
· изменение скорости высвобождения лекарственных веществ
· изменение динамики фармакологического эффекта
179. К группе химической несовместимости следует отнести сочетание ингредиентов, при котором имеет место
· антагонизм антимикробных средств
ü гидролиз сердечных гликозидов
· коагуляция в коллоидных растворах
· превышение предела смешиваемости
· необратимая сорбция лекарственных веществ
180. Проведите фармацевтическую экспертизу прописи глазных капель состава:
Solutionis Protargoli 2%-10ml
Zinci sulfatis 0,05
· в прописи выписано ядовитое вещество
· вещества в прописи совместимы
· превышен предел растворимости одного из компонентов
· имеет место химическая несовместимость
ü имеет место физико-химическая несовместимость
181. При изготовлении комбинированных мазей колларгол совместно с димедролом и новокаином
· растворяют
ü эмульгируют отдельно
· растворяют в ступке для получения эмульсионной части мази
· измельчают в ступке с маслом вазелиновым
· измельчают в ступке с этанолом
182. Укажите характер сочетания алкалоидов с дубильными веществами
ü имеет место химическая несовместимость
· совместимы
· в прописи рецептов не встречаются
· подвергаются гидролизу
· окисляются
183. Причиной фармацевтической несовместимости при сочетании эуфиллина с кислотой аскорбиновой в порошках является
ü сорбция водяных паров
· снижение температуры плавления смеси
· адсорбция
· образование эвтектической смеси
· сорбция диоксида углерода
184. Причиной фармацевтической несовместимости при сочетании гексаметилентетрамина с кислотой ацетилсалициловой в порошках является
ü повышенная сорбция водяных паров
· снижение температуры плавления смеси
· адсорбция на поверхности аппаратуры
· твердофазные взаимодействия
· образование эвтектической смеси
185. Образование осадка как результат физико-химического и химического процессов имеет место при
ü осаждении веществ под влиянием кислот
· превышении предела растворимости
· влиянии сильных электролитов с одноименными ионами
· смене растворителя
· несмешиваемости ингредиентов
186. Соли алкалоидов пуриновой группы и соли органических кислот с лекарственными средствами, имеющими кислый характер среды
· совместимы с солями органических оснований
ü не совместимы с лекарственным средством, имеющим кислую реакцию среды
· совместимы с солями щелочноземельных металлов
· в рецептах не выписываются
· разлагаются в щелочной среде
187. В микстуре, содержащей пепсин, панкреатин, кислоту хлористоводородную, кислоту аскорбиновую, происходит
ü полная инактивация пепсина и панкреатина
· инактивация только панкреатина
· инактивация только пепсина
· инактивация кислоты аскорбиновой
· выделение водорода хлорида
188. В результате сочетания протаргола и димедрола в растворе происходит
· сорбция водяных паров
· адсорбция
· комплексообразование
ü коагуляция
· коалесценция
189. Несмешиваемость компонентов является причиной фармацевтической несовместимости при сочетании
· димедрола с раствором протаргола
· масла какао и хлоралгидрата
ü вазелина и 30% масла касторового
· протаргола с раствором новокаина
· резорцина с раствором натрия гидрокарбоната
190. При изготовлении мазей учтывается, что в концентрации  25% с вазелином не смешивается масло
25% с вазелином не смешивается масло
· вазелиновое
· оливковое
ü касторовое
· подсолнечное
· миндальное
191. Образование эвтектики не зависит от
· размера частиц
ü влажности воздуха
· соотношения ингредиентов
· температуры
· физико-химических свойств ингредиентов
192. При проведении фармацевтической экспертизы прописи капель для носа состава: Solutionis Natrii sulfacili 10%-10ml Novocaini 0.2
установлено, что
· следует проверить дозы сильнодействующего вещества
· ингредиенты совместимы
· имеет место физико-химическая несовместимость
ü имеет место химическая несовместимость
· в случае изготовления произойдет коагуляция
193. Путь предотвращения несовместимости
ü замена лекарственных веществ на фармакологические аналоги по согласованию с врачом
· замена на фармакологический аналог
· замена на вещество с другими химическими свойствами
· исключение из прописи
· выделение из прописи и отпуск отдельно
194. Основателем гомеопатии является
· Аристотель
· Гиппократ
· Авиценна
ü Ганеман
· Гален
195. Обозначению в прописи гомеопатического препарата «D3» соответствует концентрация лекарственного вещества
· 1 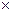 10-2
10-2
ü 1 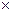 10-3
10-3
· 1 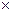 10-4
10-4
· 1 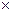 100-3
100-3
· 1 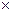 10-6
10-6
196. Гомеопатические гранулы на распадаемость (каждая серия) в соответствии с требованиями действующих нормативных документов
ü проверяют
· не проверяют
· проверяют только пилюли
· проверяют только таблетки
· проверяют только суппозитории
197. Концентрация и объем (масса) изотонирующих, стабилизирующих добавок и других вспомогательных веществ в ППК
ü указывается
· не указывается
· указывается только в случае изготовления стерильных растворов
· указывается только при изготовлении препаратов для новорожденных
· указывается при превышении нормы допустимого отклонения
198. При расчетах в ППК указываются формулы
ü все примененные при расчетах
· только включенные в приказы
· только включенные в общие фармакопейные статьи
· включенные в частные статьи
· включенные в ФСП
199. Изготовление лекарственных препаратов по индивидуальным рецептам считается законченным только после
· выписывания ППК
ü оценки качества изготовления и оформления к отпуску
· регистрации в журнале
· оформления этикетки
· опросного контроля фармацевта
Технология готовых лекарственных средств
(1) Промышленное производство лекарственных препаратов нормируются документами
· требованиями ВОЗ
ü технологическим регламентом
· рецептом
· инструкцией
· лицензией
2) Накопление статического заряда на сите зависит от
· формы и размера отверстий сетки
· толщины слоя материала на сетке
ü влажности материала
· скорости движения материала на сетке
· характера движения и длины пути материала
3) Возможные причины терапевтической неэквивалентности одинаковых по дозе и лекарственной форме лекарственных средств, выпущенных разными заводами
ü технология
· дозировка лекарственного вещества
· пол и возраст больного
· пути введения
· лекарственная форма
4) Вспомогательные вещества в производстве таблеток, ответственные за распадаемость
· наполнители
ü разрыхлители
· скользящие
· антиоксиданты
· загустители
5) Стадия технологического процесса производства таблеток, идущая после гранулирования
· прессование
· маркировка
ü опудривание
· нанесение оболочек
· смешивание
6) Правила GMP не регламентируют
· фармацевтическую терминологию
ü требования к биологической доступности препарата
· требования к зданиям и помещениям фармпроизводства
· требования к персоналу
· необходимость валидации
7) Количество высвободившегося из таблеток лекарственного вещества по тесту «Растворение» должно составлять
· 30 % за 45 минут
· 40 % за 15 минут
· 100 % за 60 минут
ü 75 % за 45 минут
· 50 % за 30 минут
8) Капельный способ получения желатиновых капсул основан на
· погружении форм в желатиновую массу
ü экструзии лекарственного вещества через желатиновую пленку
· штамповке капсул из желатиновой ленты
· явлении коацервации
· формировании капсул из желатиновой ленты
9) При производстве сборов после измельчения следует технологическая стадия
· маркировки
· смешивания
ü просеивания
· измельчения
· дозирования
10) В состав галеновых препаратов входят
· только индивидуальное действующее вещество
ü сумма действующих веществ
· загустители
· корригенты запаха
· подсластители
11) Скорость молекулярной диффузии не зависит от
· температуры
· радиуса диффундирующих молекул
· разности концентраций на границе фаз
· площади межфазной поверхности
ü атмосферного давления
12) Для очистки извлечений при получении экстрактов используют
· перекристаллизацию
ü отстаивание и фильтрование
· ионный обмен
· хроматографирование
· перегонку
13) Экстрагирование методом мацерации ускоряют
ü делением экстрагента на части
· предварительным намачиванием сырья
· делением сырья на части
· увеличением времени настаивания
· повышением давления
14) Масляные экстракты получают
· реперколяцией
· барботированием
ü мацерацией с нагреванием
· циркуляционной экстракцией
· перколяцией
15) Растворители для инъекционных растворов не должны обладать
· высокой растворяющей способностью
· химической чистотой
· устойчивостью при хранении
· фармакологической индифферентностью
ü низкой температурой кипения
16) Укажите основные требования, предъявляемые ГФ ХI к инъекционным лекарственным формам, в указанной там последовательности
ü апирогенность, стабильность, отсутствие механических включений, стерильность
· стабильность, апирогенность, низкая вязкость, стерильность