Водородные соединения и их свойства.
ВОПРОС №29
В табличке собраны некоторые простейшие водородные соединения (гидриды) неметаллов:
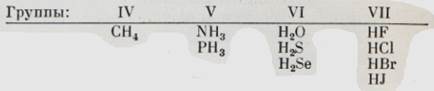
Физические свойства гидридов в целом изменяются закономерно в пределах каждой группы: чем ниже стоит неметалл, тем выше температура кипения его гидрида и тем легче можно превратить газообразный гидрид в жидкость.
Однако поведение аммиака, воды и фтористого водорода нарушает общую логику: температура кипения и плавления этих соединений аномально высока.
Дело в том, что их молекулы ассоциированы и не отвечают их простейшей формуле. Так, даже в кипящем фтористом водороде (+20°) средний состав его отвечает формуле (HF)4 и лишь при 90° пары состоят из молекул HF. Аналогично, хотя и в меньшей степени, ассоциированы молекулы жидкого аммиака. Вода в обычных условиях, кроме простейших молекул Н2О, содержит молекулы (Н2O)2, (Н2O)3...
Связь между молекулами воды в таких «двойных» и «тройных» молекулярных агрегатах из-за ее относительной прочности нельзя объяснить лишь обычной ориентацией диполей.
Как происходит такая ассоциация молекул?
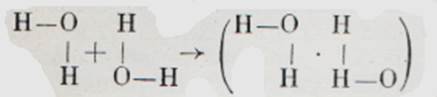
Чтобы это было ясно, вспомним, что каждая валентная черточка символизирует общую пару электронов ковалентно связанных атомов. Кроме того, атом кислорода имеет и «свободную», только ему принадлежащую пару электронов. Поэтому атом водорода имеет возможность связаться не только со «своим» атомом кислорода, но и с «чужим». Правда, такая связь менее прочна, чем обычная ковалентная связь. Называют ее водородной связью.

Таким же образом происходит ассоциация молекул фтористого водорода:

В этом случае водородная связь оказывается особенно прочной, так что в растворах фтористоводородной кислоты, кроме привычных нам ионов:

Водородная связь похожа на уже знакомую нам координационную связь, образованную за счет «чужой» пары электронов. Такая связь образуется не обязательно между одинаковыми молекулами. Вот что происходит, например, при растворении аммиака в воде:

В свойствах гидридов отчетливо проявляется периодичность. Возьмем, к примеру, гидриды неметаллов второго периода. Метан — вещество совершенно нейтральногохарактера, своеобразный «инертный» газ. Далее следует аммиак, способный присоединять ионы водорода и потому обладающий основнымисвойствами. Фтористый водород, как известно, кислота, авода, стоящая в нашей таблице между аммиаком и фтористым водородом, в определенном смысле является амфотерным электролитом.В самом деле, в реакции с аммиаком вода ведет себя как кислота (отдаетпротон):

При взаимодействии же с фтористым водородом она связываетпротон, т. е. ведет себя как основание:

Чем ниже стоит гидрид в нашей таблице, тем слабее становятся его основные свойства, если измерять их способностью реагировать с кислотами. Действительно, широко известны соли аммония, образующиеся из аммиака и кислот. А гидрид фосфора РН3, который в принципе тоже способен присоединять протон, давая ион фосфония РН4+, образует лишь несколько устойчивых солей с самыми сильными кислотами, например (PH4)+ClO4-.
Кислотные же свойства гидридов, наоборот, увеличиваются сверху вниз. Так, кислотные свойства у сероводорода выше, чем у воды, а из галогеноводородных кислот самая слабая фтористоводородная. На примере гидридов неметаллов можно проследить действие важнейшего закона природы: между самыми противоположными свойствами нет непроходимой границы, во всяком явлении борются противоположные тенденции, причем в зависимости от условий либо побеждает одна из них, либо происходит их синтез, совмещение, переход одной противоположности в другую. Этот закон поможет нам понять некоторые интересные явления, быть может несколько неожиданные и необычные.