Понятие биологической ценности белков, аминокислотный скор
Биологическая ценность белков определяется сбалансированностью аминокислотного состава и атакуемостью белков ферментами пищеварительного тракта.
В организме человека синтезируется только часть аминокислот (заменимые), другие должны доставляться с пищей (незаменимые). Заменимые аминокислоты способны заменять одна другую в рационе, так как они превращаются друг в друга или синтезируются из промежуточных продуктов углеводного или липидного обмена. Незаменимые аминокислоты не синтезируются в организме и должны поступать с пищей. К ним относятся 8 аминокислот: валин, изолейцин, лейцин, лизин, метионин+цистин, треонин, триптофан, фенилаланин+тирозин. К частично заменимым относятся аргинин и гистидин, так как в организме они синтезируются довольно медленно.
При дефиците хотя бы одной из названных аминокислот в пище, возникает отрицательный азотистый баланс, происходит нарушение обмена веществ, нарушение деятельности центральной нервной системы, остановка роста и тяжелые клинические последствия типа авитаминоза. Поэтому белок пищи должен быть сбалансирован по составу незаменимых аминокислот, а также по их соотношению с заменимыми аминокислотами, в противном случае часть незаменимых аминокислот будет расходоваться не по назначению. К настоящему времени разработано большое число методов определения биологической ценности белков, включающих биологические (в том числе и микробиологические) исследования и химический анализ.
Под биологической ценностью понимают степень задержки азота в теле растущего организма или эффективность его утилизации для поддержания азотистого равновесия у взрослых, которая зависит от аминокислотного состава белка и его структурных особенностей.
В настоящее время все исследователи пришли к единому мнению о том, что биологическую ценность белков, независимо от использованного варианта проведения эксперимента или метода ее расчета, необходимо выражать не в абсолютных, а в относительных величинах (в процентах), т.е. в сравнении с аналогичными показателями, полученными с применением стандартных белков, в качестве которых приняты белок цельного куриного яйца или белки коровьего молока. В связи с этим наиболее широко используется метод Х. Митчелла и Р. Блока (Mitchel, Block, 1946), в соответствии с которым рассчитывается показатель аминокислотного скора, позволяющий выявить так называемые лимитирующие незаменимые аминокислоты.
Скор выражают в процентах или безразмерной величиной, представляющей собой отношение содержания незаменимой аминокислоты в исследуемом белке к ее количеству в эталонном белке. Расчет аминокислотного скора (А.С., %) производят по формуле
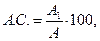 (9)
(9)
где А1 – содержание аминокислот в 1 г исследуемого белка, мг;
А – содержание аминокислот в 1 г эталонного белка, мг.
Аминокислотный состав эталонного белка сбалансирован и идеально соответствует потребностям организма человека в каждой незаменимой аминокислоте, поэтому его еще называют «идеальным». В 1973 г. в докладе ФАО/ВОЗ* опубликованы данные по содержанию каждой аминокислоты в эталонном белке. В 1985 г они были уточнены в связи с накоплением новых знаний об оптимальном рационе человека.
Рекомендуемые составы и суточная потребность человека в незаменимых аминокислотах представлена в таблице 1.
Все аминокислоты, скор которых составляет менее 100%, считаются лимитирующими, а аминокислота с наименьшим скором является главной лимитирующей аминокислотой. Следующими по степени дефицита будут вторая, третья, четвертая (и т.д.) лимитирующие аминокислоты.
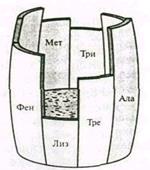
Наглядно показатель биологической ценности можно изобразить в виде самой низкой доски бочки Либиха на примере белков пшеницы (рис. 1). Полная емкость бочки соответствует «идеальному» белку, а высота доски лизина – биологической ценности пшеничного белка.
При сравнении величин биологической ценности белков, определенных методом аминокислотного скора, качество белков выявляется недостаточно, поскольку этот метод не учитывает степень доступности аминокислот для организма. Для выявления степени доступности для организма аминокислот, особенно после воздействия различного вида технологических процессов обработки пищевых продуктов, предложены биологические методы с использованием микроорганизмов и животных.
Биологическая ценность белков определяется также степенью их усвоения после переваривания. Тепловая обработка, разваривание, протирание и измельчение ускоряет переваривание белка, тогда как длительный нагрев при высоких температурах затрудняет его. Кроме того, животные белки имеют более высокую усвояемость (более 90%), чем растительные (60-80%).
Таким образом, анализируя литературные данные можно заключить следующее:
– в большинстве производств при соблюдении технологических режимов деструкции аминокислот практически не происходит;
– биологическая ценность белков, особенно растительного происхождения, при умеренном нагревании в некоторых случаях повышается, но всегда снижается при интенсивной термической обработке;
– термическое повреждение белка может биологически не выявляться, если аминокислота в недоступной форме не является лимитирующей;
– наличие редуцирующих сахаров и самоокисленного жира, а также активных альдегидов (госсипола, формальдегида) повышает степень термического повреждения белка;
– высокое содержание воды снижает тепловое повреждение;
– степень термического повреждения прямо пропорциональна времени воздействия.
При составлении сбалансированных рационов питания необходимо учитывать биологическую ценность белков и принцип взаимного дополнения лимитирующих аминокислот (сочетание белков растительного происхождения с животными белками).
4. Физико-химические изменения белков, протекающие при технологических процессах производства кулинарной продукции: гидратация, дегидратация
Глубина физико-химических изменений белков определяется их природными свойствами и наиболее значительные изменения белков связаны с их гидратацией, дегидратацией, денатурацией и деструкцией.
Гидратация – способность белков связывать влагу, при этом происходит адсорбция полярных молекул воды на поверхности белковой молекулы. Поскольку на поверхности белковой молекулы находятся полярные (гидрофобные) группы и молекулы воды также обладают полярностью, то происходит их адсорбция на поверхности белковой молекулы, а вода, связываемая белками, является адсорбционной. Адсорбция может быть ионной и молекулярной. Ионная адсорбция – связывание воды свободным полярными группами белка (аминогруппами, карбоксильными группами и др.). Молекулярная адсорбция – присоединение воды связанными полярными группами (пептидными, гидроксильными, сульфгидрильными и др.). величина молекулярной адсорбции является постоянной для каждого вида белка, а величина ионной адсорбции изменяется с изменением реакции среды.
В изоэлектрической точке белка (ИЭТ), где число положительных и отрицательных зарядов в молекуле белка одинаково (при определенном рН среды) белки обладают наименьшей способностью связывать воду, происходит разрушение их гидратной оболочки вокруг белковой молекулы, поэтому они соединяются, образуя крупные агрегаты и выпадают в осадок. Адсорбционная вода удерживается за счет водородных связей (между атомом водорода одной молекулы и атомом кислорода другой). За счет значительного количества водородных связей адсорбционная вода является достаточно прочно связанной.
Гидратация белков может быть полная – при избыточном количестве воды, например, в молоке, жидком тесте и др. Гидратация может быть дополнительной – при добавлении к яичной массе воды или молока, при добавлении к измельченному мясу воды, что повышает, липкость массы, улучшает формование и сочность готового изделия. Примером гидратации также является приготовление теста и образование клейковины. От степени гидратации зависит такой важнейший показатель как сочность изделия. Следует учесть, что в пищевых продуктах наряду с адсорбционной водой содержится большее или меньшее количество капиллярно-связанной воды, которая также влияет на качество готовой продукции.
Дегидратация – потеря белками воды при сушке, замораживании, размораживании мяса, при тепловой обработке изделий.
Иллюстрации:
Таблица 1 «Рекомендуемые составы и суточная потребность человека в незаменимых аминокислотах (мг/г белка)»
| Незаменимые аминокислоты | ФАО/ВОЗ* (1985 г.) | ФАО/ВОЗ (1973 г.) взрослые | мг/кг массы тела | ||
| дети 2…5 лет | дети 10…12 лет | подростки | |||
| Изолейцин | |||||
| Лейцин | |||||
| Лизин | |||||
| Метионин+цистин | |||||
| Фенилалнин+тирозин | |||||
| Треонин | |||||
| Триптофан | 3,5 | ||||
| Валин |
Рисунок 1 «Бочка Либиха»
Контрольные вопросы:
1. В чем заключается значение белков и аминокислот в питании?
2. Назовите основные функции белков.
3. Дайте определение понятию «аминокислоты».
4. Каким образом классифицируются белки?
5. Что понимают под термином «биологическая ценность» белков?
6. Что такое «аминокислотный скор», и при помощи, какой математической формулы происходит его вычисление?
7. Процесс гидратации белков и его влияние на технологические процессы.
8. Назовите виды адсорбции.
9. Что означает процесс дегидратации?
Литература:
- Технология продукции общественного питания: учебно-методическое пособие для студентов специальности 260501 «Технология продукции общественного питания»/Сост. К.т.н. О.В. Пасько – Омск: Изд. Омского экономического института, 2005. – 120 с.
- Химический состав пищевых продуктов. Справочные таблицы содержания аминокислот, жирных кислот, витаминов, макро-и микроэлементов, органических кислот и углеводов / Под. ред. М.Ф. Нестерина, И.М. Скурихина. – М., 1979. – 247 с.
- Технология продукции общественного питания. В 2-хт. Т.1.Физико-химические процессы, протекающие в пищевых продуктах при их кулинарной обработке / А.С. Ратушный, В.И. Хлебников, Б.А. Баранов и др.; Под ред. д-ра техн.наук, проф. А.С. Ратушного. – М.:Мир, 2004. – 351с.:ил.(Учебники и учеб.пособия для студентов высших учебных заведений).