ИЗГОТОВЛЕНИЕ ГИСТОЛОГИЧЕСКИХ ПРЕПАРАТОВ
Изготовление срезов осуществляется путём резки блоков, залитых в парафиновые среды. Изготовление срезов методом заморозки производится исключительно при необходимости проведения окрасок, используемых только на замороженных срезах. Целлоидиновый метод заливки является предпочтительным только при исследовании костной ткани и миокарда.
Современные методики проводки позволяют получать препараты уже через несколько часов после завершения фиксации материала.
Например, ускоренную спирто - хлороформную проводку производят по следующей схеме:
Все компоненты батареи для проводки должны находиться в термостате при +60°С.
- Вырезанный материал, находящийся в растворе формалина, без промывки помещают в 1-й спирт 50° и выдерживают в термостате 20 мин.
- Материал переносят во 2-й спирт 70° и выдерживают в термостате 20мин.
- Материал переносят в 3-й спирт 80° и выдерживают в термостате 20мин.
- Материал тщательно промокают и переносят в 4-й спирт 96° и выдерживают в термостате 20мин.
- Материал переносят в смесь спирт 96° - хлороформ в соотношении 1:1 и выдерживают в термостате 20мин.
- Отжав кусочки, материал переносят в хлороформ и выдерживают в термостате 20мин.
- Материал переносят в «парафиновую кашу» (смесь парафина с хлороформом) и выдерживают в термостате 20мин.
- Материал переносят в парафин 1 и выдерживают в термостате 20мин.
- Материал переносят в парафин 2 и выдерживают в термостате 20мин.
- Материал переносят в парафин 3 и выдерживают в термостате 20мин.
- Заливка в блоки, после чего препараты изготовляют обычным способом.
Ускоренная проводка требует точного соблюдения срока переноса образцов из одного раствора в другой. Для его обеспечения целесообразно использовать автоматический процессор обработки (проводки) тканей для гистологии. Достоинством современных аппаратов являются также системы контроля вредных испарений.
Толщина парафиновых срезов не должна превышать 5-7 мк, что требует использования современных микротомов.
Авторы сайта продемонстрируют чёткую картину в тонких срезах; стёртость, размытость картины в толстых срезах, что значительно влияет на качество микрофотографии.
| 
|
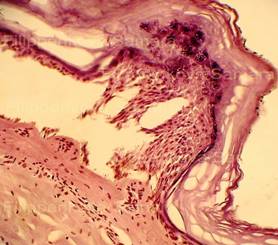
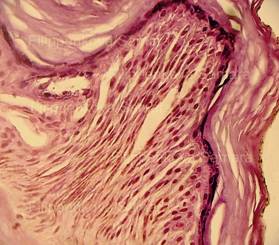
| Рис. 1, 2. Кожа с тонким эпидермисом при типичной электрометке. Сотоподобные дефекты в роговом слое. Выраженное (вплоть до нитевидного) вытягивание в длину ядер клеток базального слоя эпидермиса, вертикальная и косо-вертикальная их ориентация. Очаговые расщепления, разрывы эпидермиса. Тонкие срезы равномерной толщины. Окраска: гематоксилин и эозин. Увеличение х100 и х250. | |
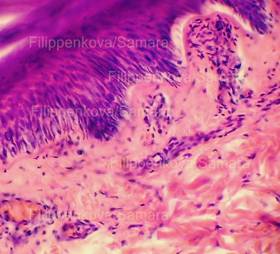
| Рис. 3. Выраженное (вплоть до нитевидного) вытягивание в длину ядер клеток базального слоя эпидермиса, вертикальная и косо-вертикальная их ориентация, участки с картиной фигур в виде «частокола». Толстый срез неравномерной толщины. Окраска: гематоксилин и эозин. Увеличение х100 и х250. |
Обязательной является обзорная окраска гистологических срезов всех исследуемых органов и тканей гематоксилином-эозином. Дополнительно допускается использование всех описанных в литературе гистологических и гистохимических методик.
Дополнительные окраски по возможности следует назначать сразу после вырезки.
При переломах длинных трубчатых и плоских костей, размозжениях мягких тканей обязательной является окраска замороженных срезов лёгких суданом.
| 
|
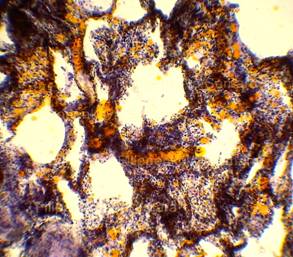
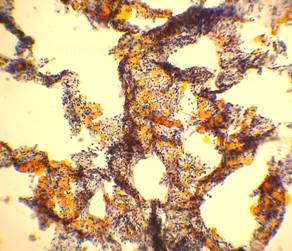
| Рис. 4, 5. Выраженная жировая эмболия лёгких. Просветы большого количества капилляров межальвеолярных перегородок, артерий и вен обтурированы оранжево-жёлтыми жировыми эмболами. Сопутствует явление жирового эмболизма (в ряде капилляров мелкие жировые капли оранжево-жёлтого цвета, размерами менее 8 мкм). Окраска: судан III. Увеличение х100. Иллюстрация авторов сайта. | |

| 
|
| Рис. 6, 7. Выраженное явление жирового эмболизма (просветы большинства межальвеолярных капилляров с наличием гомогенных жировых капель оранжево-жёлтого цвета, размерами менее 8 мкм). Окраска: судан III. Увеличение х250. Иллюстрация авторов сайта. |
При исследовании парадуральных гематом обязательно использование окраски по Перлсу.
При субарахноидальных кровоизлияниях сосуды мягких мозговых оболочек следует окрашивать на эластические волокна (по Вейгерту, орсеином или по иной методике).
При переживании ЧМТ и в других ситуациях, чреватых формированием респираторного дистресс-синдрома надлежит производить окраску срезов лёгких на фибрин.