Лекция 18. Биохимия крови.
Тема 12.
- Кровь – часть внутренней среды организма. Главнейшие функции крови. Белковый спектр плазмы. Альбумины, их транспортная функция и вклад в онкотическое давление плазмы. Глобулины, их характеристика. Белки-переносчики ионов металлов (трансферрин, церулоплазмин).
- Общие закономерности действия каскадных протеолитических систем крови; их взаимосвязи в осуществлении защитных функций. Основные закономерности функционирования калликреин-кининовой системы. Роль антипротеиназ плазмы. Эндогенные ингибиторы протеиназ.
- Белки «острой фазы». Ферменты плазмы: «собственные» и поступающие при повреждении клеток. Диагностическая ценность анализа ферментов плазмы.
- Небелковые органические компоненты плазмы. Важнейшие азотсодержащие соединения. Минеральные вещества крови: распределение между плазмой и клетками; нормальные диапазоны концентраций важнейших из них.
- Форменные элементы крови. Особенности метаболизма в эритроцитах и лейкоцитах. Основные закономерности функционирования ренин-ангиотензин-альдостероновой системы.
- Дыхательная функция крови. Молекулярные механизмы газообмена в легких и тканях. Кинетика оксигенирования миоглобина и гемоглобина. Буферные системы крови: бикарбонатная, фосфатная, белковая и гемоглобиновая. Причины развития и формы ацидоза и алкалоза.
| Краткое содержание | Конспект |
| 1. Кровь – часть внутренней среды организма. Главнейшие функции крови. Белковый спектр плазмы. Альбумины, их транспортная функция и вклад в онкотическое давление плазмы. Глобулины, их характеристика. Белки-переносчики ионов металлов (трансферрин, церулоплазмин). | |
Кровь – это жидкая внутренняя среда организма. Общий объём крови взрослого человека – 5-6 л.Кровь состоит из жидкой части (плазмы), составляющей 55 % её общего объёма и форменных элементов (эритроциты, лейкоциты, тромбоциты).
Функции крови: 1) дыхание – транспорт кислорода от легких к тканям и перенос СО2 от тканей к легким; 2) питание –транспорт поглощенных питательных веществ; 3) выделение – перенос конечных продуктов метаболизма в почки, легкие, кожу, кишечник для последующего их выведения; 4) поддержание в организме нормального кислотно-щелочного равновесия (рН крови составляет 7,36-7,4); 5) регуляция водного баланса (кровь влияет на обмен воды между циркулирующей жидкостью и тканевой жидкостью); 6) регуляция температуры тела путем распределения тепла; 7) защита от инфекций (осуществляется лейкоцитами и циркулирующими в плазме антителами); 8) транспорт гормонов и регуляция метаболизма; 9) транспорт различных метаболитов.
Белковый спектр плазмы
Общее количество белков в плазме – 7-7,5 г/дл (г%).В артериальной области кровообращения внутрисосудистое гидростатическое давление, создаваемое сердцем и крупными сосудами, на 20-25 мм рт. ст. превышает гидростатическое давление в тканях. Выходу слишком большого количества жидкости из сосудов во внесосудистое тканевое пространство противодействует внутрисосудистое коллоидно-осмотическое давление, создаваемое белками плазмы.
Альбумин
Концентрация альбумина в плазме выше, чем концентрация двух других главных белков, а его молекулярная масса наименьшая. Именно этот белок вносит основной вклад во внутрисосудистое коллоидно-осмотическое давление. Альбумин синтезируется в печени, и его единственная цепь состоит из 610 аминокислот. Наряду с участием в поддержании коллоидно-осмотического давления альбумин служит еще молекулой-переносчиком. Он транспортирует билирубин, жирные кислоты, многие лекарственные вещества и элементы, содержащиеся в плазме в следовых концентрациях.
При гипоальбуминемии (низкой концентрации альбумина в сыворотке), которая сопровождает заболевания печени и почек, наблюдается отек мягких тканей. Это связано с понижением внутрисосудистого коллоидно-осмотического давления.
Глобулины
Глобулины – это белки, нерастворимые в воде, но растворимые в растворах солей. Глобулины сыворотки – это гетерогенная сложная смесь белковых молекул, обычно называемых -, -, и -глобулинами.
Классификация глобулинов чаще основывается на структуре: гликопротеины, липопротеины (переносчики липидов), металл-связывающие белки (трансферрин – переносит железо, церулоплазмин – переносит медь и др.), ферменты (фосфатазы, липазы, ЛДГ, трансаминазы, амилаза и др.), иммуноглобулины, фибриноген.
Иммуноглобулины
Иммуноглобулины, или антитела, синтезируются В-лимфоцитами или образующимися из них плазматическими клетками. Все молекулы иммуноглобулинов состоят из двух идентичных легких (L) цепей (мол. масса 23 000) и двух идентичных тяжелых (Н) цепей (мол. масса 53000-75000), образующих тетрамер (L2H2) при помощи дисульфидных связей.
Каждая цепь может быть условно разделена на специфические домены или области, имеющие определенное структурное и функциональное значение. Половину легкой цепи, включающую карбоксильный конец, называют константной областью (CL), a N-концевую половину легкой цепи – вариабельной областью (VL). Примерно четвертую часть тяжелой цепи, включающую N-конец, относят к вариабельной области Н-цепи (VH), остальные 3/4 ее длины – это константные области (СН1, СН2, СН3). Участок иммуноглобулина, связывающийся со специфическим антигеном, формируется N-концевыми вариабельными областями легких и тяжелых цепей, т.е. VН и VL-доменами. Эти домены не являются просто линейными последовательностями аминокислот, они формируют глобулярные образования с вторичной и третичной структурой, обеспечивающие эффективное связывание со специфическими антигенами.
Имеется пять классов иммуноглобулинов: IgG, IgA, IgM, IgD и IgE. Каждый индивид способен синтезировать антитела против примерно одного миллиона различных антигенов.
Известны заболевания, при которых увеличивается продукция определенных классов или даже определенных молекул иммуноглобулинов. Например, именно так обстоит дело при возникновении клональной опухоли плазматических клеток (так называемой миеломы). Напротив, при гипогаммаглобулинемии снижается синтез либо какого-то одного класса иммуноглобулинов (например, IgA или IgG), либо всех вместе (IgA, IgD, IgE, IgG, IgM). Почти во всех случаях изменения в уровне иммуноглобулинов обусловлены нарушением либо скорости синтеза этих молекул, либо их секреции.
Упрощенная модель молекулы IgG антител человека: представлена четырехцепочечная основная структура и домены.
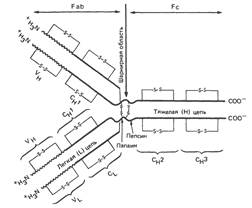 V – вариабельная область; С – константная область; вертикальная стрелка – шарнирная область. Жирными линиями обозначены Н- и L-цепи; тонкими линиями – дисульфидные связи.
Трансферринотносится к -глобулинам и обладает способностью соединяться с железом. Комплекс трансферрина с железом окрашен в оранжевый цвет. В этом комплексе железо находится в трехвалентной форме. Железо транспортируется в виде трансферрина; хранится в виде ферритина или гемосидерина; теряется со слущивающимися клетками и при кровотечении Концентрация трансферрина в сыворотке = 200-400 мг% (23-45 мкмоль/л). В норме только 1/3 трансферрина насыщена железом. Следовательно, имеется определенный резерв трансферрина, способного связывать железо. Трансферрин у различных людей может принадлежать к разным типам. Выявлено 19 типов трансферринов, различающихся по величине заряда белковой молекулы, ее аминокислотному составу и числу молекул сиаловых кислот, связанных с белком. Обнаружение разных типов трансферринов связывают с наследственными особенностями.
V – вариабельная область; С – константная область; вертикальная стрелка – шарнирная область. Жирными линиями обозначены Н- и L-цепи; тонкими линиями – дисульфидные связи.
Трансферринотносится к -глобулинам и обладает способностью соединяться с железом. Комплекс трансферрина с железом окрашен в оранжевый цвет. В этом комплексе железо находится в трехвалентной форме. Железо транспортируется в виде трансферрина; хранится в виде ферритина или гемосидерина; теряется со слущивающимися клетками и при кровотечении Концентрация трансферрина в сыворотке = 200-400 мг% (23-45 мкмоль/л). В норме только 1/3 трансферрина насыщена железом. Следовательно, имеется определенный резерв трансферрина, способного связывать железо. Трансферрин у различных людей может принадлежать к разным типам. Выявлено 19 типов трансферринов, различающихся по величине заряда белковой молекулы, ее аминокислотному составу и числу молекул сиаловых кислот, связанных с белком. Обнаружение разных типов трансферринов связывают с наследственными особенностями.
|
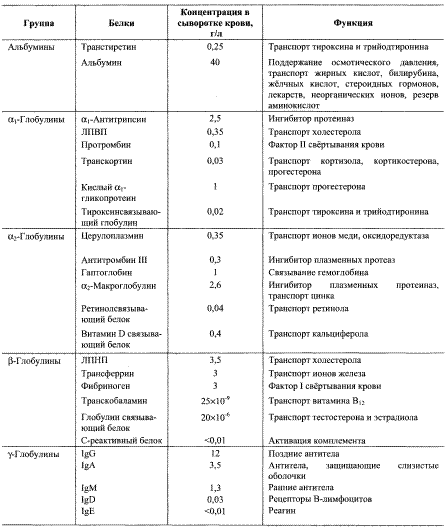
Содержание и функции некоторых белков плазмы крови:
 Транспорт меди осуществляется с помощью церулоплазмина.Церулоплазминимеет голубоватый цвет, обусловленный наличием в его составе 0,32% меди; обладает слабой каталитической активностью, окисляя аскорбиновую кислоту, адреналин, диоксифенилаланин и некоторые другие соединения. Концентрация церулоплазмина в сыворотке = 25-43 мг% (1,7-2,9 мкмоль/л). При гепатоцеребральной дистрофии (болезнь Вильсона–Коновалова) содержание церулоплазмина в сыворотке крови значительно снижено, а концентрация меди в моче высокая. Снижение уровня церулоплазмина отмечается также при мальабсорбции, нефрозе, дефиците меди, возникающем при парентеральном питании. Содержание церулоплазмина повышено при беременности, гипертиреозе, инфекции, апластической анемии, остром лейкозе, лимфогранулематозе, циррозе печени.
Транспорт меди осуществляется с помощью церулоплазмина.Церулоплазминимеет голубоватый цвет, обусловленный наличием в его составе 0,32% меди; обладает слабой каталитической активностью, окисляя аскорбиновую кислоту, адреналин, диоксифенилаланин и некоторые другие соединения. Концентрация церулоплазмина в сыворотке = 25-43 мг% (1,7-2,9 мкмоль/л). При гепатоцеребральной дистрофии (болезнь Вильсона–Коновалова) содержание церулоплазмина в сыворотке крови значительно снижено, а концентрация меди в моче высокая. Снижение уровня церулоплазмина отмечается также при мальабсорбции, нефрозе, дефиците меди, возникающем при парентеральном питании. Содержание церулоплазмина повышено при беременности, гипертиреозе, инфекции, апластической анемии, остром лейкозе, лимфогранулематозе, циррозе печени.
|
| 2. Общие закономерности действия каскадных протеолитических систем крови; их взаимосвязи в осуществлении защитных функций. Основные закономерности функционирования калликреин-кининовой системы. Роль антипротеиназ плазмы. Эндогенные ингибиторы протеиназ. | |
Кровь здорового человека in vitro свёртывается за 5-10 мин. При этом образование протромбиназного комплекса занимает 5-8 мин, активация протромбина – 2-5 сек и превращение фибриногена в фибрин – 2-5 сек.
Прекращение кровотечения после травматического повреждения кровеносных сосудов называется гемостазом.
Выделяют четыре фазы гемостаза: первая фаза – сокращение поврежденного сосуда. При этом уменьшается кровоснабжение дистальной от травмы области. Вторая фаза – образование в месте повреждения рыхлой тромбоцитарной пробки или белого тромба. Имеющийся в участке повреждения коллаген служит связывающим центром для тромбоцитов; у последних в результате связывания разрушается их внутренняя структура и высвобождаются тромбоксан и AДФ. Они в свою очередь индуцируют присоединение новых тромбоцитов и таким образом образуется рыхлая временная пробка. Длительность данной фазы гемостаза определяют по продолжительности кровотечения. Третья фаза – формирование красного тромба (кровяного сгустка). Четвертая фаза – частичное или полное растворение сгустка.
Различают три типа тромбов или сгустков. Белый тромб образуется из тромбоцитов и фибрина; в нем относительно мало эритроцитов. Формируется он в местах повреждения или на патологически измененной стенке сосуда в условиях высокой скорости кровотока (в артериях). Второй вид тромбов – это диссеминированные отложения фибрина в очень мелких сосудах (капиллярах). Третий вид тромбов – красный тромб – состоит из эритроцитов и фибрина. Морфология красного тромба сходна с морфологией сгустков, образующихся в пробирке. Красные тромбы формируются in vivo в областях замедленного кровотока при отсутствии патологических изменений в стенке сосуда, в месте повреждения или на измененной стенке сосуда вслед за инициирующей тромбоцитарной пробкой. Инициация образования сгустка в ответ на повреждение ткани осуществляется по внешнему пути свертывания.
Взаимосвязь внутреннего, внешнего и конечного общего пути в процессе свертывания крови:
 Внутренний путь активации фактора X в Ха. ВМК – высокомолекулярный кининоген:
Внутренний путь активации фактора X в Ха. ВМК – высокомолекулярный кининоген:
 Калликреин-кининогеновая система
Калликреин – сериновая протеаза, субстратами которой являются, кроме фактора XII, белки плазмы крови плазминоген (профермент, участвующий в растворении фибрина) и кининогены с низкой (69 кДа) и высокой (120 кДа) молекулярной массой. При частичном протеолизе кининогенов образуются регуляторные пептиды – кинины. В частности, мощный вазодилятатор брадикинин повышает проницаемость сосудов и вызывает разрушение клеточных мембран эндотелия.
В результате контакта фактора XII с субэндотелием сосудов он активируется. Активный фактор XIIа в комплексе с высокомолекулярным кининогеном (ВМК) протеолитически превращает прекалликреин, связанный с мембраной посредством ВКМ, в калликреин. Мембранный комплекс калликреин-ВМК по принципу положительной обратной связи частичным протеолизом активирует фактор XII. При этом фактор XII приобретает максимальную ферментативную активность и по принципу положительной обратной связи активирует связанный с ВМК прекалликреин. Кроме того, образовавшийся в результате частичного протеолиза фактор XIIа протеолитически активирует фактор XI, а фактор XIа в составе ферментного комплекса XI-ВМК активирует фактор IX. Фактор IXа мембранного комплекса IXa-VIIIa-Ca2+ активирует фактор Х, который в составе протромбиназного комплекса активирует протромбин.
Противосвёртывающая система крови
Физиологические ингибиторы свёртывания крови играют важную роль в поддержании гемостаза, т.к. они сохраняют кровь в жидком состоянии и препятствуют распространению тромба за пределы повреждённого участка сосуда.
Антикоагулянтная фаза
В каскаде реакций антикоагулянтной фазы последовательно образуются 2 мембранных комплекса: IIа-Тм-Са2+ и Са-S-Са2+.
Тромбомодулин(Тм) – интегральный белок мембран эндотелиальных клеток, служит белком-активатором тромбина. Тромбин приобретает способность активировать протеин С только после взаимодействия с тромбомодулином. Связанный с тромбомодулином тромбин не может превращать фибриноген в фибрин, не активирует фактор V и тромбоциты.
Протеин С – профермент, активируемый частичным протеолизом. Активный протеин С (Са) образует с белком-активатором S мембраносвязанный комплекс Са-S-Са2+. Активный протеин С инактивирует факторы Va и VIIIа (в течение 3 мин теряется 80 % активности этих факторов).
Ингибиторы ферментов свёртывания крови:
1) антитромбин III (на его долю приходится около 80-90 % антикоагулянтной активности крови); 2) 2-макроглобулин (образует комплекс с сериновыми протеазами крови); 3) антиконвертин (тканевой ингибитор внешнего пути свёртывания); 4) 1-антитрипсин (ингибирует тромбин).
Геморрагические заболевания и связанные с ними нарушения:
Калликреин-кининогеновая система
Калликреин – сериновая протеаза, субстратами которой являются, кроме фактора XII, белки плазмы крови плазминоген (профермент, участвующий в растворении фибрина) и кининогены с низкой (69 кДа) и высокой (120 кДа) молекулярной массой. При частичном протеолизе кининогенов образуются регуляторные пептиды – кинины. В частности, мощный вазодилятатор брадикинин повышает проницаемость сосудов и вызывает разрушение клеточных мембран эндотелия.
В результате контакта фактора XII с субэндотелием сосудов он активируется. Активный фактор XIIа в комплексе с высокомолекулярным кининогеном (ВМК) протеолитически превращает прекалликреин, связанный с мембраной посредством ВКМ, в калликреин. Мембранный комплекс калликреин-ВМК по принципу положительной обратной связи частичным протеолизом активирует фактор XII. При этом фактор XII приобретает максимальную ферментативную активность и по принципу положительной обратной связи активирует связанный с ВМК прекалликреин. Кроме того, образовавшийся в результате частичного протеолиза фактор XIIа протеолитически активирует фактор XI, а фактор XIа в составе ферментного комплекса XI-ВМК активирует фактор IX. Фактор IXа мембранного комплекса IXa-VIIIa-Ca2+ активирует фактор Х, который в составе протромбиназного комплекса активирует протромбин.
Противосвёртывающая система крови
Физиологические ингибиторы свёртывания крови играют важную роль в поддержании гемостаза, т.к. они сохраняют кровь в жидком состоянии и препятствуют распространению тромба за пределы повреждённого участка сосуда.
Антикоагулянтная фаза
В каскаде реакций антикоагулянтной фазы последовательно образуются 2 мембранных комплекса: IIа-Тм-Са2+ и Са-S-Са2+.
Тромбомодулин(Тм) – интегральный белок мембран эндотелиальных клеток, служит белком-активатором тромбина. Тромбин приобретает способность активировать протеин С только после взаимодействия с тромбомодулином. Связанный с тромбомодулином тромбин не может превращать фибриноген в фибрин, не активирует фактор V и тромбоциты.
Протеин С – профермент, активируемый частичным протеолизом. Активный протеин С (Са) образует с белком-активатором S мембраносвязанный комплекс Са-S-Са2+. Активный протеин С инактивирует факторы Va и VIIIа (в течение 3 мин теряется 80 % активности этих факторов).
Ингибиторы ферментов свёртывания крови:
1) антитромбин III (на его долю приходится около 80-90 % антикоагулянтной активности крови); 2) 2-макроглобулин (образует комплекс с сериновыми протеазами крови); 3) антиконвертин (тканевой ингибитор внешнего пути свёртывания); 4) 1-антитрипсин (ингибирует тромбин).
Геморрагические заболевания и связанные с ними нарушения:

|
Схема свертывания крови
 Система нумерации факторов свертывания крови, их основные функции и содержание в плазме:
Система нумерации факторов свертывания крови, их основные функции и содержание в плазме:


|
| 3.Белки «острой фазы». Ферменты плазмы: «собственные» и поступающие при повреждении клеток. Диагностическая ценность анализа ферментов плазмы. | |
| В острый период болезни в сыворотке крови появляется особый белок, который назвалибелком «острой фазы». Другое название этого белка – С-реактивный белок. Он получил своё название в результате способности вступать в реакцию преципитации с С-полисахаридом пневмококков. В сыворотке здорового человека С-реактивный белок отсутствует. Он обнаруживается при многих патологических состояниях (воспаления, некрозы тканей). С переходом в хроническую фазу заболевания С-реактивный белок исчезает из крови и снова появляется при обострении процесса. Ферменты плазмы (сыворотки) крови Ферменты, которые обнаруживаются в норме в плазме или сыворотке крови, условно можно разделить на 3 группы: 1) секреторные, 2) индикаторные и 3) экскреторные. Секреторные ферменты,синтезируясь в печени, в норме выделяются в плазму крови, где играют определенную физиологическую роль. Типичными представителями данной группы являются ферменты, участвующие в процессе свертывания крови, и сывороточная холинэстераза. Индикаторные (клеточные) ферментыпопадают в кровь из тканей, где они выполняют определенные внутриклеточные функции. Одни из них находятся главным образом в цитозоле клетки (ЛДГ, альдолаза), другие – в митохондриях (глутаматдегидрогеназа), третьи – в лизосомах (-глюкуронидаза, кислая фосфатаза) и т.д. Большая часть индикаторных ферментов в сыворотке крови определяется в норме лишь в следовых количествах. При поражении тех или иных тканей ферменты из клеток «вымываются» в кровь; их активность в сыворотке резко возрастает, являясь индикатором степени и глубины повреждения этих тканей. Экскреторные ферментысинтезируются главным образом в печени (лейцинаминопептидаза, щелочная фосфатаза и др.). В физиологических условиях эти ферменты в основном выделяются с желчью. Еще не полностью выяснены механизмы, регулирующие поступление данных ферментов в желчные капилляры. При многих патологических процессах выделение экскреторных ферментов с желчью нарушается, а активность в плазме крови повышается. Особый интерес для клиники представляет исследование активности индикаторных ферментов в сыворотке крови, так как по появлению в плазме или сыворотке крови ряда тканевых ферментов в повышенных количествах можно судить о функциональном состоянии и поражении различных органов (например, печени, сердечной и скелетной мускулатуры). При остром инфаркте миокарда особенно важно исследовать активность креатинкиназы, АсАТ, ЛДГ и оксибутиратдегидрогеназы. При заболеваниях печени, в частности при вирусном гепатите (болезнь Боткина), в сыворотке крови значительно увеличивается активность АлАТ и АсАТ, сорбитолдегидрогеназы, глутаматдегидрогеназы и некоторых других ферментов. Большинство ферментов, содержащихся в печени, присутствуют и в других органах тканей. Однако известны ферменты, которые более или менее специфичны для печеночной ткани. К таким ферментам, в частности, относится -глутамилтранспептидаза, или -глутамилтрансфераза (ГГТ). Данный фермент – высокочувствительный индикатор при заболеваниях печени. Повышение активности ГГТ отмечается при остром инфекционном или токсическом гепатите, циррозе печени, внутрипеченочной или внепеченочной закупорке желчных путей, первичном или метастатическом опухолевом поражении печени, алкогольном поражении печени. Иногда повышение активности ГГТ наблюдается при застойной сердечной недостаточности, редко – после инфаркта миокарда, при панкреатитах, опухолях поджелудочной железы. Органоспецифическими ферментамидля печени считаются также гистидаза, сорбитолдегидрогеназа, аргиназа и орнитинкарбамоилтрансфераза. Изменение активности этих ферментов в сыворотке крови свидетельствует о поражении печеночной ткани. В настоящее время особо важным лабораторным тестом стало исследование активности изоферментов в сыворотке крови, в частности изоферментов ЛДГ. Известно, что в сердечной мышце наибольшей активностью обладают изоферменты ЛДГ1 и ЛДГ2, а в ткани печени – ЛДГ4 и ЛДГ5. Установлено, что у больных с острым инфарктом миокарда в сыворотке крови резко повышается активность изоферментов ЛДГ1 и отчасти ЛДГ2. Изоферментный спектр ЛДГ в сыворотке крови при инфаркте миокарда напоминает изоферментный спектр сердечной мышцы. Напротив, при паренхиматозном гепатите в сыворотке крови значительно возрастает активность изоферментов ЛДГ4 и ЛДГ5 и уменьшается активность ЛДГ1 и ЛДГ2. Диагностическое значение имеет также исследование активности изоферментов креатинкиназы в сыворотке крови. Существуют по крайней мере 3 изофермента креатинкиназы: ВВ, ММ и MB. В мозговой ткани в основном присутствует изофермент ВВ (от англ. brain – мозг), в скелетной мускулатуре – ММ-форма (от англ. muscle – мышца). Сердце содержит гибридную МВ-форму, а также ММ-форму. Изоферменты креатинкиназы особенно важно исследовать при остром инфаркте миокарда, так как МВ-форма в значительном количестве содержится практически только в сердечной мышце. Повышение активности МВ-формы в сыворотке крови свидетельствует о поражении именно сердечной мышцы. | Возрастание активности ферментов сыворотки крови при многих патологических процессах объясняется, прежде всего, двумя причинами: 1) выходом в кровяное русло ферментов из поврежденных участков органов или тканей на фоне продолжающегося их биосинтеза в поврежденных тканях; 2) одновременным повышением каталитической активности некоторых ферментов, переходящих в кровь. Возможно, что повышение активности ферментов при «поломке» механизмов внутриклеточной регуляции обмена веществ связано с прекращением действия соответствующих регуляторов и ингибиторов ферментов, изменением под влиянием различных факторов строения и структуры макромолекул ферментов. |
| 4. Небелковые органические компоненты плазмы. Важнейшие азотсодержащие соединения. Минеральные вещества крови: распределение между плазмой и клетками; нормальные диапазоны концентраций важнейших из них. | |
| В группу безазотистых органических веществ крови входят углеводы, жиры, липиды, органические кислоты и некоторые другие вещества. Все эти соединения являются либо продуктами промежуточного обмена углеводов и жиров, либо играют роль питательных веществ. В клинике большое значение придают количественному определению этих компонентов крови. Содержание небелкового азота в цельной крови и плазме почти одинаково и составляет в крови 15-25 ммоль/л. Небелковый азот крови включает азот мочевины (50% от общего количества небелкового азота), аминокислот (25%), эрготионеина (8%), мочевой кислоты (4%), креатина (5%), креатинина (2,5%), аммиака и индикана (0,5%) и других небелковых веществ, содержащих азот (полипептиды, нуклеотиды, нуклеозиды, глутатион, билирубин, холин, гистамин и др.). Небелковый азот крови называют также остаточным азотом, т.е. остающимся в фильтрате после осаждения белков. К важным небелковым азотистым веществам крови относится также мочевая кислота. В норме концентрация мочевой кислоты в цельной крови составляет 0,18–0,24 ммоль/л (в сыворотке крови – около 0,29 ммоль/л). Повышение содержания мочевой кислоты в крови (гиперурикемия) – главный симптом подагры. При подагре уровень мочевой кислоты в сыворотке крови возрастает до 0,5-0,9 ммоль/л и даже до 1,1 ммоль/л. В группу безазотистых органических веществ крови входят углеводы, жиры, липиды, органические кислоты и некоторые другие вещества. Все эти соединения являются либо продуктами промежуточного обмена углеводов и жиров, либо играют роль питательных веществ. Известно, что общее содержание воды в организме человека составляет 60-65% от массы тела, т.е. приблизительно 40-45 л (если масса тела 70 кг); 2/3 общего количества воды приходится на внутриклеточную жидкость, 1/3 – нa внеклеточную. Натрий. Это основной осмотически активный ион внеклеточного пространства. В плазме крови концентрация ионов Na+ приблизительно в 8 раз выше (132–150 ммоль/л), чем в эритроцитах. При гипернатриемии, как правило, развивается синдром, обусловленный гипергидратацией организма.Гипонатриемиясопровождается дегидратацией организма. Коррекция натриевого обмена достигается введением растворов хлорида натрия с расчетом дефицита его во внеклеточном пространстве и клетке. Калий. Концентрация ионов К+ в плазме колеблется от 3,8 до 5,4 ммоль/л; в эритроцитах его приблизительно в 20 раз больше. Уровень калия в клетках значительно выше, чем во внеклеточном пространстве, поэтому при заболеваниях, сопровождающихся усиленным клеточным распадом или гемолизом, содержание калия в сыворотке крови увеличивается. Гиперкалиемиянаблюдается при острой почечной недостаточности и гипофункции коркового вещества надпочечников. Недостаток альдостерона приводит к усилению выделения с мочой натрия и воды и задержке в организме калия. При усиленной продукции альдостерона корковым веществом надпочечников возникает гипокалиемия, при этом увеличивается выделение калия с мочой, которое сочетается с задержкой натрия в тканях. Развивающаяся гипокалиемия вызывает тяжелые нарушения в работе сердца. Кальций. В эритроцитах обнаруживаются следы кальция, в то время как в плазме содержание его составляет 2,25–2,80 ммоль/л. Различают несколько фракций кальция: ионизированный кальций, кальций неионизированный, но способный к диализу, и недиализирующийся (недиффундирующий), связанный с белками кальций. Кальций принимает активное участие в процессах нервно-мышечной возбудимости (как антагонист ионов К+), мышечного сокращения, свертывания крови, образует структурную основу костного скелета, влияет на проницаемость клеточных мембран и т.д. Отчетливое повышение уровня кальция в плазме крови(гиперкалъциемии) наблюдается при развитии опухолей в костях, гиперплазии или аденоме паращитовидных желез. В таких случаях кальций поступает в плазму из костей, которые становятся ломкими. Важное диагностическое значение имеет определение уровня кальция при гипокалъциемии. Состояние гипокальциемии наблюдается при гипопаратиреозе. Нарушение функции паращитовидных желез приводит к резкому снижению содержания ионизированного кальция в крови. | При ряде патологических состояний уровень небелкового азота в крови повышается. Это состояние носит название азотемии. Азотемия в зависимости от вызывающих ее причин подразделяется на ретенционную и продукционную. Ретенционная азотемия развивается в результате недостаточного выделения с мочой азотсодержащих продуктов при нормальном поступлении их в кровяное русло. Она в свою очередь может быть почечной и внепочечной. Продукционная азотемия развивается при избыточном поступлении азотсодержащих продуктов в кровь, как следствие усиленного распада тканевых белков при обширных воспалениях, ранениях, ожогах, кахексии и др. Магний. В организме магний локализуется в основном внутри клетки – 15 ммоль/ на 1 кг массы тела; концентрация магния в плазме 0,8–1,5 ммоль/л, в эритроцитах – 2,4–2,8 ммоль/л. Фосфор. В клинике при исследовании крови различают следующие фракции фосфора: общий фосфат, кислоторастворимый фосфат, липоидный фосфат и неорганический фосфат. Для клинических целей чаще определяют содержание неорганического фосфата в плазме (сыворотке) крови.Гипофосфатемия(снижение содержания фосфора в плазме) особенно характерна для рахита. Железо. В цельной крови железо содержится в основномв эритроцитах (около 18,5 ммоль/л), в плазме концентрация его составляет в среднем 0,02 ммоль/л. Ежедневно в процессе распада гемоглобина эритроцитов в селезенке и печени освобождается около 25 мг железа и столько же потребляется при синтезе гемоглобина в клетках кроветворных тканей. При анемии различного происхождения потребность в железе и всасывание его в кишечнике резко возрастают. В костном мозге, печени и селезенке железо депонируется в форме ферритина – своеобразного резерва легкомобилизуемого железа. Недостаток железа в организме может вызвать нарушение последнего этапа синтеза гема – превращение протопорфирина IX в гем. Как результат этого развивается анемия, сопровождающаяся увеличением содержания порфиринов, в частности протопорфирина IX, в эритроцитах. |
| 5. Форменные элементы крови. Особенности метаболизма в эритроцитах и лейкоцитах. Основные закономерности функционирования ренин-ангиотензин-альдостероновой системы. | |
| У человека в 1 мкл крови содержится 5•106 эритроцитов(красные кровяные клетки), которые образуются в костном мозге. Средняя продолжительность жизни этих клеток 125 дней. Разрушаются эритроциты в селезенке и печени. Большую часть гемоглобина взрослого человека составляет HbA1 (96–98% от общего содержания гемоглобина), в небольшом количестве присутствуют НbА2 (2–3%), а также HbF (менее 1%), которого много в крови новорожденных. Содержание лейкоцитовв 1 мкл крови составляет около 7•103, т.е. почти в 1000 раз меньше, чем эритроцитов. Лейкоциты в отличие от эритроцитов являются полноценными клетками с большим ядром и митохондриями и высоким содержанием нуклеиновых кислот.Лейкоцитыпредставлены клетками 3 типов: лимфоцитами (26% от общего числа лейкоцитов), моноцитами (7%) и полиморфно-ядерными лейкоцитами, или гранулоцитами (70%). При окрашивании различными красителями выявляются 3 типа гранулоцитов: нейтрофилы, эозинофилы и базофилы. Лимфоциты продуцируются в лимфатической ткани, основная их функция – образование антител, в частности иммуноглобулинов. В крови имеются кровяные пластинки, или тромбоциты (180-320•109/л), которые образуются из цитоплазмы мегакариоцитов костного мозга. Тромбоциты не могут считаться полноценными клетками, поскольку не содержат ядра, однако в них протекают все основные биохимические процессы: синтезируется белок, происходит обмен углеводов и липидов, осуществляется биологическое окисление, сопряженное с фосфорилированием, и т.д. Основная физиологическая функция кровяных пластинок – участие в процессе свертывания крови. Ренин-ангиотензин-альдостероновая система (РААС) Ренин – протеолитический фермент, продуцируемый юкстагломерулярными клетками, расположенными вдоль конечной части афферентных (приносящих) артериол, входящих в почечные клубочки. Восстановление объёма крови при обезвоживании организма Уменьшение общего объёма жидкости (в результате кровопотери, при обильной рвоте, диарее) вызывает высвобождение ренина. Снижение импульсации от барорецепторов предсердий и артерий в результате уменьшения внутрисосудистого объёма жидкости также приводит к выходу ренина в плазму крови. В результате увеличивается продукция ангитензина II (мощный стимулятор альдостерона). В результате в крови увеличивается концентрация альдостерона, что приводит к задержке ионов натрия. А это, в свою очередь, является сигналом для осморецепторов гиопталамуса и секреции из нервных окончаний передней доли гипофиза АДГ, стимулирующего реабсорбцию воды из собирательных трубочек. Ангиотензин II, оказывая сильное сосудосуживающее действие, повышает артериальное давление (АД), а также усиливает жажду. Поступающая с питьём вода в большей мере, чем это происходит в норме, задерживается в организме. Увеличение объёма жидкости, а также повышение АД приводит к устранению стимула, который вызвал активацию ренин-ангиотензиновой системы, секрецию альдостерона и восстановление объёма крови. | Ренин-ангиотензин-альдостероновая система (РААС):
 1 – ренин катализирует превращение ангиотензиногена (гликопротеин) в ангиотензин I (декапептид); 2 – ангиотензин I превращается в ангиотензин II под действием ангиотензин-превращающего фермента (АПФ – фермент, локализованный в эндотелиальных клетках, лёгких и плазме крови), отщепляющего 2 аминокислотных остатка от декапептида; 3 – ангиотензин II стимулирует синтез и секрецию альдостерона; 4 – ангиотензин II вызывает сужение сосудов периферических артерий; 5 – альдостерон стимулирует реабсорбцию Na+ и экскрецию К+; 6,7,8,9 – торможение секреции ренина и альдостерона по механизму отрицательной обратной связи. Пунктирные линии – регуляция по принципу обратной связи.
1 – ренин катализирует превращение ангиотензиногена (гликопротеин) в ангиотензин I (декапептид); 2 – ангиотензин I превращается в ангиотензин II под действием ангиотензин-превращающего фермента (АПФ – фермент, локализованный в эндотелиальных клетках, лёгких и плазме крови), отщепляющего 2 аминокислотных остатка от декапептида; 3 – ангиотензин II стимулирует синтез и секрецию альдостерона; 4 – ангиотензин II вызывает сужение сосудов периферических артерий; 5 – альдостерон стимулирует реабсорбцию Na+ и экскрецию К+; 6,7,8,9 – торможение секреции ренина и альдостерона по механизму отрицательной обратной связи. Пунктирные линии – регуляция по принципу обратной связи.
|
| 6. Дыхательная функция крови. Молекулярные механизмы газообмена в легких и тканях. Кинетика оксигенирования миоглобина и гемоглобина. Буферные системы крови: бикарбонатная, фосфатная, белковая и гемоглобиновая. Причины развития и формы ацидоза и алкалоза. | |
Гемоглобин –олигомерный белок, состоящий из 4 субъединиц, каждая из которых имеет в своём составе гем.
 Между - и -цепями формируется сильное гидрофобное взаимодействие (за счёт большого количества гидрофобных аминокислотных остатков в определённой части этих полипептидных цепей), а также ионные и водородные связи. Вследствие этих взаимодействий образуются димеры 11 и 22, между которыми возникают полярные (ионные и водородные) связи, формирующие тетрамер. Поскольку полипептидные цепи в центральной области не могут плотно прилегать друг к другу, то в центре формируется «центральная полость».
Гемоглобин связывает четыре молекулы кислорода на один тетрамер (по одной молекуле кислорода на каждый протомер), что отличает его от миоглобина, являющегося мономерным белком. Отличия в функционировании миоглобина и гемоглобина чётко иллюстрирует кривая насыщения кислородом этих двух кислород-переносящих белков.
Оксигенирование гемоглобина
Олигомерная структура гемоглобина обеспечивает некоторые особенности обмена газов: 1) быстрое насыщение гемоглобина кислородом в лёгких (при этом образуется оксигемоглобин – Hb(O2)4); 2) возможность отщепления кислорода от гемоглобина в капиллярах тканей при относительно высоком парциальном давлении О2; 3) возможность регуляции сродства гемоглобина к О2 в зависимости от потребностей тканей в кислороде.
Перенос Н+ и СО2 с кровью. Эффект Бора:
Между - и -цепями формируется сильное гидрофобное взаимодействие (за счёт большого количества гидрофобных аминокислотных остатков в определённой части этих полипептидных цепей), а также ионные и водородные связи. Вследствие этих взаимодействий образуются димеры 11 и 22, между которыми возникают полярные (ионные и водородные) связи, формирующие тетрамер. Поскольку полипептидные цепи в центральной области не могут плотно прилегать друг к другу, то в центре формируется «центральная полость».
Гемоглобин связывает четыре молекулы кислорода на один тетрамер (по одной молекуле кислорода на каждый протомер), что отличает его от миоглобина, являющегося мономерным белком. Отличия в функционировании миоглобина и гемоглобина чётко иллюстрирует кривая насыщения кислородом этих двух кислород-переносящих белков.
Оксигенирование гемоглобина
Олигомерная структура гемоглобина обеспечивает некоторые особенности обмена газов: 1) быстрое насыщение гемоглобина кислородом в лёгких (при этом образуется оксигемоглобин – Hb(O2)4); 2) возможность отщепления кислорода от гемоглобина в капиллярах тканей при относительно высоком парциальном давлении О2; 3) возможность регуляции сродства гемоглобина к О2 в зависимости от потребностей тканей в кислороде.
Перенос Н+ и СО2 с кровью. Эффект Бора:
 А – влияние концентрации СО2 и Н+ на высвобождение О2 из комплекса с гемоглобином в тканях (эффект Бора); Б – оксигенирование дезоксигемоглобина в лёгких, образование и выделение СО2.
Буферные системы крови
«Первая линия защиты» живых организмов, препятствующая изменениям рН их внутренней среды, обеспечивается буферными системами крови. Буферная система представляет собой сопряженную кислотно-основную пару, состоящую из акцептора и донора водородных ионов (протонов).
Установлено, что состоянию нормы соответствует определенный диапазон колебаний рН крови – от 7,37 до 7,44 со средней величиной 7,40.
Важнейшими буферными системами крови являются бикарбонатная, фосфатная, белковая и наиболее мощная гемоглобиновая.
Бикарбонатная буферная система– мощная и, пожалуй, самая управляемая система внеклеточной жидкости и крови. На долю бикарбонатного буфера приходится около 10% всей буферной емкости крови. Бикарбонатная система представляет собой сопряженную кислотно-основную пару, состоящую из молекулы угольной кислоты Н2СО3, выполняющую роль донора протона, и бикарбонат-иона НСО3–, выполняющего роль акцептора протона.
Фосфатная буферная системапредставляет собой сопряженную кислотно-основную пару, состоящую из иона Н2РО4– (донор протонов) и иона НРО42– (акцептор протонов).
Белковая буферная система.Белки образуют буферную систему благодаря наличию кислотно-основных групп в молекуле белков: белок–Н+ (кислота, донор протонов) и белок (сопряженное основание, акцептор протонов). Белковая буферная система плазмы крови эффективна в области значений рН 7,2–7,4.
Гемоглобиновая буферная система– самая мощная буферная система крови. Она в 9 раз мощнее бикарбонатного буфера; на ее долю приходится 75% от всей буферной емкости крови. Участие гемоглобина в регуляции рН крови связано с его ролью в транспорте кислорода и углекислого газа. Гемоглобиновая буферная система состоит из неионизированного гемоглобина ННb (слабая органическая кислота, донор протонов) и калиевой соли гемоглобина КНb (сопряженное основание, акцептор протонов). Система гемоглобина и система оксигемоглобина являются взаимопревращающимися системами и существуют как единое целое.
Нарушения кислотно-основного равновесия (КОР)
Если компенсаторные механизмы организма не способны предотвратить сдвиги концентрации водородных ионов, то нарушается кислотно-основное равновесие. При этом наблюдаются два противоположных состояния – ацидоз и алкалоз. При ацидозеконцентрация водородных ионов в крови выше нормальных величин. Естественно, при этом рН уменьшается. Снижение величины рН ниже 6,8 вызывает смерть. В тех случаях, когда концентрация водородных ионов в крови уменьшается (соответственно значение рН возрастает), наступает состояние алкалоза. Предел совместимости с жизнью – рН 8,0. В клинике практически такие величины рН, как 6,8 и 8,0, не встречаются. В зависимости от механизмов развития нарушений КОР выделяют дыхательный и метаболический ацидоз (или алкалоз).
Дыхательный ацидоз возникает в результате уменьшения минутного объема дыхания (например, при бронхиальной астме, отеке, эмфиземе, ателектазе легких, асфиксии механического порядка и т.д.). Все эти заболевания ведут к гиповентиляции и гиперкапнии, т.е. повышению Рсо2 артериальной крови.
А – влияние концентрации СО2 и Н+ на высвобождение О2 из комплекса с гемоглобином в тканях (эффект Бора); Б – оксигенирование дезоксигемоглобина в лёгких, образование и выделение СО2.
Буферные системы крови
«Первая линия защиты» живых организмов, препятствующая изменениям рН их внутренней среды, обеспечивается буферными системами крови. Буферная система представляет собой сопряженную кислотно-основную пару, состоящую из акцептора и донора водородных ионов (протонов).
Установлено, что состоянию нормы соответствует определенный диапазон колебаний рН крови – от 7,37 до 7,44 со средней величиной 7,40.
Важнейшими буферными системами крови являются бикарбонатная, фосфатная, белковая и наиболее мощная гемоглобиновая.
Бикарбонатная буферная система– мощная и, пожалуй, самая управляемая система внеклеточной жидкости и крови. На долю бикарбонатного буфера приходится около 10% всей буферной емкости крови. Бикарбонатная система представляет собой сопряженную кислотно-основную пару, состоящую из молекулы угольной кислоты Н2СО3, выполняющую роль донора протона, и бикарбонат-иона НСО3–, выполняющего роль акцептора протона.
Фосфатная буферная системапредставляет собой сопряженную кислотно-основную пару, состоящую из иона Н2РО4– (донор протонов) и иона НРО42– (акцептор протонов).
Белковая буферная система.Белки образуют буферную систему благодаря наличию кислотно-основных групп в молекуле белков: белок–Н+ (кислота, донор протонов) и белок (сопряженное основание, акцептор протонов). Белковая буферная система плазмы крови эффективна в области значений рН 7,2–7,4.
Гемоглобиновая буферная система– самая мощная буферная система крови. Она в 9 раз мощнее бикарбонатного буфера; на ее долю приходится 75% от всей буферной емкости крови. Участие гемоглобина в регуляции рН крови связано с его ролью в транспорте кислорода и углекислого газа. Гемоглобиновая буферная система состоит из неионизированного гемоглобина ННb (слабая органическая кислота, донор протонов) и калиевой соли гемоглобина КНb (сопряженное основание, акцептор протонов). Система гемоглобина и система оксигемоглобина являются взаимопревращающимися системами и существуют как единое целое.
Нарушения кислотно-основного равновесия (КОР)
Если компенсаторные механизмы организма не способны предотвратить сдвиги концентрации водородных ионов, то нарушается кислотно-основное равновесие. При этом наблюдаются два противоположных состояния – ацидоз и алкалоз. При ацидозеконцентрация водородных ионов в крови выше нормальных величин. Естественно, при этом рН уменьшается. Снижение величины рН ниже 6,8 вызывает смерть. В тех случаях, когда концентрация водородных ионов в крови уменьшается (соответственно значение рН возрастает), наступает состояние алкалоза. Предел совместимости с жизнью – рН 8,0. В клинике практически такие величины рН, как 6,8 и 8,0, не встречаются. В зависимости от механизмов развития нарушений КОР выделяют дыхательный и метаболический ацидоз (или алкалоз).
Дыхательный ацидоз возникает в результате уменьшения минутного объема дыхания (например, при бронхиальной астме, отеке, эмфиземе, ателектазе легких, асфиксии механического порядка и т.д.). Все эти заболевания ведут к гиповентиляции и гиперкапнии, т.е. повышению Рсо2 артериальной крови.
| Сатурационная кривая О2:
 Кривая связывания О2 крови (красная кривая). Для сравнения приведена кривая связывания кислорода миогобином, имеющая форму гиперболы (зелёная кривая)
2,3-Бифосфоглицерат (БФГ) – аллостерический регулятор сродства гемоглобина к О2:
Кривая связывания О2 крови (красная кривая). Для сравнения приведена кривая связывания кислорода миогобином, имеющая форму гиперболы (зелёная кривая)
2,3-Бифосфоглицерат (БФГ) – аллостерический регулятор сродства гемоглобина к О2:
 Ткани
Нb(О2)4 + БФГ Нb-БФГ + 4О2
Лёгкие
Влияние различных концентраций 2,3-бисфосфоглицерата на сродство гемоглобина к кислороду:
Ткани
Нb(О2)4 + БФГ Нb-БФГ + 4О2
Лёгкие
Влияние различных концентраций 2,3-бисфосфоглицерата на сродство гемоглобина к кислороду:
 Метаболический ацидоз – самая частая и тяжелая форма нарушений КОР. Он обусловлен накоплением в тканях и крови органических кислот. Этот вид ацидоза связан с нарушением обмена веществ. Метаболический ацидоз возможен при диабете, голодании, лихорадке, заболеваниях пищеварительного тракта, шоке (кардиогенном, травматическом, ожоговом и др.).
Дыхательный алкалоз возникает при резко усиленной вентиляции легких, сопровождающейся быстрым выделением из организма СО2 и развитием гипокапнии (понижение Рсо2 в артериальной крови). Данный вид алкалоза может наблюдаться, например, при вдыхании чистого кислорода, компенсаторной одышке, сопровождающей ряд заболеваний, пребывании в разреженной атмосфере и при других состояниях.
Метаболический алкалоз развивается при потере большого количества кислотных эквивалентов (например, неукротимая рвота и др.) и всасывании основных эквивалентов кишечного сока, которые не подвергались нейтрализации кислым желудочным соком, а также при накоплении основных эквивалентов в тканях (например, при тетании) и в случае неправильной коррекции метаболического ацидоза.
Метаболический ацидоз – самая частая и тяжелая форма нарушений КОР. Он обусловлен накоплением в тканях и крови органических кислот. Этот вид ацидоза связан с нарушением обмена веществ. Метаболический ацидоз возможен при диабете, голодании, лихорадке, заболеваниях пищеварительного тракта, шоке (кардиогенном, травматическом, ожоговом и др.).
Дыхательный алкалоз возникает при резко усиленной вентиляции легких, сопровождающейся быстрым выделением из организма СО2 и развитием гипокапнии (понижение Рсо2 в артериальной крови). Данный вид алкалоза может наблюдаться, например, при вдыхании чистого кислорода, компенсаторной одышке, сопровождающей ряд заболеваний, пребывании в разреженной атмосфере и при других состояниях.
Метаболический алкалоз развивается при потере большого количества кислотных эквивалентов (например, неукротимая рвота и др.) и всасывании основных эквивалентов кишечного сока, которые не подвергались нейтрализации кислым желудочным соком, а также при накоплении основных эквивалентов в тканях (например, при тетании) и в случае неправильной коррекции метаболического ацидоза.
|