Классификации комплексных соединений
Основные положения «Координационной теории» Вернера
1. В любом комплексном соединении есть внутренняя и внешняя сфера.Внутренняя сфера называется «комплексным ионом» и заключается в квадратные скобки. В химических реакциях или в кристаллической структуре комплексный ион выступает как самостоятельная единица: K3[Fe(CN)6] 3K+ + [Fe(CN)6]3
2. Центральный атом внутренней сферы называется комплексообразователем (КО) или ядром комплекса. Роль комплексообразователя выполняют чаще всего катионы металлов, напр. [Fe(CN)6]3, [Co(NH3)6]2+, реже нейтр.атомы - Ni(CO)4 или анионы - [NH4]+.
3. Ионы или молекулы, которые координируются вокруг центрального атома во внутренней сфере, называются лигандами (от латинского liganda - «то, что связано») или аддендами (от латинского addenda - «то, что добавлено»).
4. Координационное число – это число лигандов, которое удерживается комплексообразователем. Координационное число обычно бывает больше, чем степень окисления КО:
Заряд центр.иона координац.число
+1 2
+2 4, 6
+3 6, 4
+4 8
Координационное число (к.ч.) зависит от: 1) природы КО и лигандов; 2) размеров КО и лигандов.
5.Число мест во внутренней сфере, которые занимает один лиганд, называется координационной емкостью лиганда. Монодентатный лиганд связан с комплексообразователем только одним из своих атомов: NH3, OH.
Бидентатный лиганд – двумя атомами: CO32-, SO42-, C2O42- и т.д.
Полидентатные лиганды связаны с комплексообразователем тремя и более атомами (например, ЭДТА занимает 6 мест во внутренней сфере).
6. Заряд комплексного иона численно равен алгебраической сумме зарядов всех составляющих его ионов. С другой стороны, заряд внутренней сферы равен по абсолютному значению и противоположен по знаку заряду внешней сферы.
В целом, комплексные соединения – электронейтральны.
Примеры:
x
а) [Co(NH3)6]Cl3 [Co(NH3)6]3+ + 3Cl
х + 6 · 0 = + 3
х = +3
х
б) K3[Fe(CN)6] 3K+ + [Fe(CN)6]3
х + 6 · (-1) = - 3;
х = 6 - 3 = +3
в) в нейтральных комплексах внешняя сфера отсутствует:
[Fe(CO)5]о ; [Xe(H2O)6]о
Так как лиганды являются нейтральными молекулами, следовательно, заряд комплексообразователя в данном случае равен нулю: q(Fe) = 0; q(Xe) = 0.
Номенклатура комплексных соединений
Названия комплексных соединений основаны на рекомендациях IUPAC (Международного союза теоретической и прикладной химии).
1.Сначала называют катион, затем - анион. Если катион – комплексный, то используют русское название в родительном падеже: … меди, …. хрома
Если комплексный анион, то используют корень латинского названия КО с добавлением окончания «ат»: сульфат, феррат, цинкат и т.д.
2. Число лигандов указывается с помощью приставок, образованных от греческих числительных:
ди-, три-, тетра-, пента-, гекса- (простые лиганды).
Бис-, трис- и т.д. (сложные лиганды).
Лиганды перечисляются без дефиса в следующем порядке:
анионы (с соединительной гласной «о»);
нейтральные лиганды (без изменения названия, кроме «аква» и «амин»);
катионы.
Если анионов несколько, то их перечисляют в следующем порядке:
Н–; О2–; ОН–; простые анионы; многоатомные; органические.
3. Степень окисления КО обозначают арабскими цифрами в скобках после названия комплексообразователя (знак ставят перед цифрой).
Например: K2[HgI4] – тетрайодомеркурат (+2) калия;
[Co(NH3)6][Fe(CN)6] – гексацианоферрат (+3)гексаамминкобальта (+3).
Классификации комплексных соединений
По заряду комплексного иона:
а) катионные - [Co(NH3)6]Cl3,
б) анионные – H2[SiF6], K2[HgI4],
в) нейтральные – [Pt(NH3)2Cl2]о, [Xe(H2O)6]о.
По природе лигандов:
Аквакомплексы: [Co(H2O)6]SO4
Амминокомплексы (аммиакаты): [Ag(NH3)2]Cl
Ацидокомплексы: K3[Fe(CN)6]
Гидроксокомплексы: K3[Al(OH)6]
По классу соединений:
Комплексные кислоты: H2[SiF6],
Комплексные основания: [Ag(NH3)2](ОН)
Комплексные соли: K2[HgI4],
По внутренней сфере:
- Моноядерные;
- Полиядерные – содержат 2 (и более) центральных атома одного химического элемента (или разных химических элементов). Тогда эти атомы-ядра связываются друг с другом «мостиковыми группами», например,
Оловые соединения – мостиком является ОН-группа,
Оксоловые соединения – мостиком является – -О- и т.д.
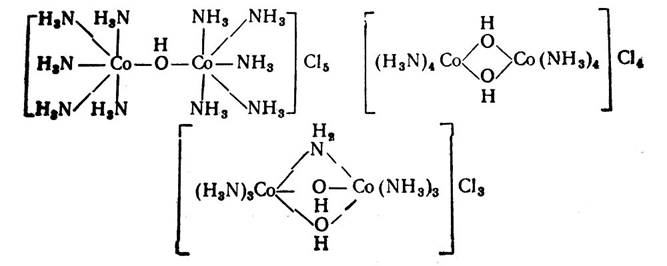
- Циклические (хелатные) – внутрикомплексные соединения, где лиганды связаны с комплексообразователем как парно-электронной связью, так и донорно-акцепторной. Например, гликолят меди (+2), где лиганд – аминоуксусная кислота (гликокол) использует обе функциональные группировки: –СООН и –NH2, которые захватывают центральный атом подобно клешням рака.

За счет хелатного эффекта устойчивость внутрикомплексных соединений возрастает.