Учебно-методические материалы по дисциплине
УЧЕБНОЕ ПОСОБИЕ К ПРАКТИЧЕСКИМ ЗАНЯТИЯМ ПО ХИМИИ
Утверждено на заседании каф. 908
1 сентября 2012 г
ЧАСТЬ 1-ая.
СОКРАЩЕНИЯ В ТЕКСТЕ
кр. - кристаллический
г. - газообразный
ж. - жидкий
гр. - графит
н.у. - нормальные условия (10132 Па 273 К)
р. - раствор
н. - бутан - нормальный бутан
т.с. - теплотворная способность
водн. - водный
j, i- - стехиометрические коэффициенты продуктов
реакции и реагентов
мех. - механическая
Глава 1. ОСНОВЫ ХИМИЧЕСКОЙ ТЕРМОДИНАМИКИ
1.1. ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ. ПРОЦЕССЫ
ПРИ ПОСТОЯННОМ ДАВЛЕНИИ И ПРИ ПОСТОЯННОМ
ОБЪЕМЕ
Пример 1. Рассчитайте разницу между тепловыми эффектами при постоянном давлении и постоянном объеме (Qp — Qv ) реакции
С2 H4 0(г) + H2 (г) =C2 Н5 0Н(Ж) , протекающей при 298 К. Чему равна эта разница, если температуру повысить до 400 К и спирт перевести в газообразное состояние?
Решение. 1-й закон термодинамики можно выразить уравнением
U = Q - Aмех
где U - изменение внутренней энергии системы (U2-U1) при переходе системы из состояния "1" в состояние “2"; Q — теплота; Aмех - работа механическая, равная рV, где р - давление, а V- изменение объема (V2-V1).
Тепловой эффект процесса, протекающего при р=const
Qp= H = U+p , (1.1.2)
H - изменение энтальпии.
Тепловой эффект процесса, протекающего при р = const
Qp-Qv=pV=nRT,
где R - газовая постоянная = 8,3144 Дж/моль *К; n=n2-n1 ;
n1 и n2 - количество молей реагентов и продуктов реакции газообразных веществ; T - температура, К.
Отсюда: 1) при 298 К Qр - Qv = nRT = (0-2) 8,3144-298 = -4955,38 Дж;
2) при 400 К и газообразном С2Н5ОН Qp – Qv = (1-2) 8,3144-400 = -3325,76 Дж.
Ответ при 298 К Qp-Qv = -4955,38 Дж;
при 400°К Qp - Qv= -3325,76 Дж.
Пример 2. Определить стандартную энтальпию образования
ацетилена по энергиям связей отдельных его атомов:
2С(гр) + H2 C2H2 ; Hообр .
Решение. Стандартная энтальпия (теплота) образованиям Hообр - тепло, поглощенное или выделенное в процессе синтеза 1 моля соединения из простых веществ при условии, что все компоненты системы находятся в стандартных состояниях.
Верхний индекс Hо здесь и в последующих случаях Gо, Sо, Fо обозначает, что реагирующие вещества находятся в своих стандартных состояниях. Стандартное состояние для газов - это состояние идеального газа при давлении 1 атм (101330 Па) и определенной температуре. Для жидкости - это состояние чистой жидкости, а для твердых веществ — это кристаллическое состояние при тех же условиях. Строго говоря, температура должна быть точно указана в виде индекса.
Например, Hо 273 , однако, если не оговорено, то стандартное состояние относится к 298 К. Образование молекулы ацетилена Н – С С- Н сопровождается образованием двух связей Н - С (358,2 кДж/моль) и одной связи С С (536 кДж/моль); разрушением связи H – H (430 кДж/моль) и переходом 2C(rp) 2-С(г) (525 кДж/моль).
Образование связи сопровождается выделением энергии, разрушение - поглощением.
Hообр C2H2 = (-358,2*2)+(-536)+430+525*2=227,6 кДж/моль.
Ответ. Hообр C2H2 = 227,6 кДж/моль.
Задачи
1.Вычислить разность между Qp и Qv при 298 К для реакции полного сгорания бензола С6Н6, нафталина С10 Н8 и этилена C2H4 с образованием диоксида углерода и воды в жидком состоянии.
2. Найти разность между Qp и Qv при 298 К для следующих реакций:
N2(г) + 3H2(г) 2NH3(г) ; 2SO2(г)+O2(г) 2SO3(г)
2C(гр)+O2(г)=2CО2(г); NH4CL(кp) NH3(г)+ HCL(г).
3. Тепловой эффект реакции 1/2 N2(r)+3/2 H2(г) NH3(г) при постоянном давлении, при температуре 298 К Qp = H= = -46,26 кДж/моль.
Определить Qv для этой реакции при этой же температуре.
4. Тепловой эффект изобарного процесса, протекающего по реакции
2Fe(кр)+3/2 О2(г)=Fe2O3 (кр) , при 291 К равен -82З,З кДж/моль. Определить тепловой эффект для изохорного процесса, протекающего по этой реакции при той же температуре.
5. Вычислить разность между Qp и Qv при 773 К для реакции CO2(г) + C(гр)= CO(г) и
3C2H2(г) C6H6(г) .
6. Энергия диссоциации H2 , Cl2 и стандартная энтальпия образования HCl соответственно составляют 436,243 и -92 кДж/моль. Вычислить энергию связи H-Cl .
7. Рассчитайте тепловой эффект сгорания метилацетата по энергиям связей при 298 К. Реакция сгорания метилацетата протекает по уравнению
CH3COOCH3(ж) + 3,5O2(г) 3H2O(г) + 3CO2(г) ; Hо.
Структурная формула метилацетата
H O H
| || |
H— C— C —O — C — H
| |
H H
8. Рассчитать стандартную энтальпию образования этилена
H H
| |
H — C = C — H
получаемого по уравнению
2C(гр) + 2H2(г)- C2H4(г) ; H
по величинам энергии связей. Сравнить полученный результат с табличным (см. табл. 1).
9. Вычислить стандартную энтальпию образования H — бутана
H H H H
| | | |
H — C — C — C— C— H
| | | |
H H H H
по энергиям связей.
Уравнение образования бутана
4C(гр) + 5H2(г) = C4 H10 ; H°
10. Вычислить стандартную энтальпию образования метанола по величинам энергий связи
C(гр) + 2H2 + 1/2 O2 = CH3OH ; H°.
Сравнить полученную величину с табличным значением (см. табл. З).
11. Рассчитайте тепловой эффект (H° ) дегидратации этилового спирта по уравнению реакции
H H H H
| | \ /
H — C— C — OH(ж) C = C + H — O — H ; H°
| | / \
H H H H(г)
Энергии соответствующих связей взять в табл. 1, теплоты испарения спирта
и воды - в табл. 2.
12. Рассчитать тепловой эффект ( H° ) сгорания этилацетата
H
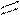 | O H H
| O H H
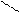 H — C — С | |
H — C — С | |
| O — C — C — H(ж)
H | |
H H до СO2 и H2O(ж)
по энергиям разрыва связей при 298 К. (Энергию связей см. в табл. 1, теплоту испарения этилацетата и H2 O - в табл. 2).
1.2. ЗАКОН ГЕССА. РАСЧЕТ ТЕПЛОПРОИЗВОДИТЕЛЬНОСТИ ТОПЛИВА. ЗАВИСИМОСТЬ ТЕПЛОВОГО ЭФФЕКТА РЕАКЦИИ ОТ ТЕМПЕРАТУРЫ. УРАВНЕНИЕ КИРХГОФА
Пример 1. Определить при 298 К тепловой эффект (H°) реакции
Al2O3(кр) + ЗSO3(г)= Al2(SO4)3(кр) ; H° .
Решение. Если H реакции > О - реакция эндотермическая, идет с поглощением тепла; если H реакции < О - реакция экзотермическая, идет с выделением тепла. По следствию из закона Гесса имеем: тепловой эффект реакции H° равен разности между суммой стандартных энтальпий (теплот) образования Hообр продуктов реакции и реагентов с учетом их стехиометрических коэффициентов j, i) :
продукты реагенты
°= vj Hообр - i Hообр . (1.2.1)
Из табл. 3 выпишем значения стандартных энтальпий образования:
Hо298 Al2O3(кр) = -1672 кДж/моль;
Hо298 SO3(г) =-395,7 кДж/моль;
Hо298 A12(S04)3(кр)= -3439,0 кДж/моль.
Тепловой эффект реакции находим по (1.2.1):
Hо= Hо298 A12(S04)3 - Hо298 Al2O3-3 Hо298 SO3 =
= -3439,0+1672+3*395,7 = -580,8 кДж
Ответ °=-580,8 кДж.
Пример 2. Определить тепловой эффект ° реакции этерификации щавелевой кислоты метиловым спиртом, протекающей по уравнению
(СООН)2+ 2СН3 ОН—> (соосн3)2 + 2Н2О ,
если стандартные энтальпии сгорания (см. табл. 5)
Hocгop(COOН)2 = -251,8 кДж/моль;
Hocгop (СН3ОН) = -727,59 кДж/моль;
Hocгop (COOCН3)2= -168О,19 кДж/моль.
Решение. По следствию из закона Гесса имеем: тепловой эффект реакции равен разности между суммой энтальпий сгорания реагентов и суммой энтальпий сгорания конечных продуктов с учетом их стехиометрических коэффициентов:
реагенты продукты
Ho= i Hocгop - j Hocгop (1.2.2)
Следовательно,
Ho = Hocгop(COOН)2 + 2 Hocгop (СН3ОН) - 2 Hocгop (COOCН3)2 - 2 Hocгop (H2O)= - 251,8 - (2*727,59)+1680,19 = -26,79 кДж.
Энтальпия сгорания Н20 (а также CO2 ) равны нулю.
Ответ. Ho = -26,79 кДж.
Пример 3. Определить стандартную энтальпию образования ( Hо298 обр) этилена, если тепловой эффект реакции горения этилена равен - 1412,99 кДж/моль, а стандартные энтальпии образования ( Hо298 обр) CО2 и H2O(ж) равны соответственно - 394,07 и - 286,26 кДж/моль.
Решение. Горение этилена происходит по реакции
C2H4(г) + 3О2 = 2СО2(г) + 2Н2О(ж);
= -1412,99 кДж/моль
По следствию из закона Гесса (1.2.1):
Hо =2 Hо298 Н2О + 2 Hо298 СО2 - Hо298 С2Н4 - Hо298 О2
Стандартные энтальпии образования простых веществ равны нулю, отсюда Hо298 О2= 0. Тогда
Hо298 C2H4 = 2 Hо298 H20 +2 Hо298 CO2 - Hо =-(2*286,26)- (2*394,07) +1412,99 = -572,52-788,14+ +1412,99 = 52,3 кДж/моль.
Ответ. Hо298 C2H4 = 52,3 кДж/моль.
Пример 4. Рассчитать теплотворную способность метана. Реакция горения метана протекает по уравнению
СН4 + 2O2 =СО2 + 2H2O; Hо.
Hocгop метана равна -891,63 кДж/моль.
Решение. Теплотворной способностью топлива называется количество тепла, выделяющееся при сгорании одного килограмма топлива (топливо состоит из горючего и окислителя).
По формуле (1.2.2) имеем
°= Hocгop CH4 + Hocгop O2 - Hocгop CO2 - Hocгop H2O;
Hocгop для O2, Н2O и СO2 равны нулю,
Поэтому 0= Hocгop CH4 = -891,632 кДж/моль. Это количество тепла выделяется при сгорании 80 г топлива (вес 1-го моля метана и 2-х молей кислорода). Следовательно, теплотворная способность метана
Т.С. = (891,632/80)*1000=1114,54кДж/кг
Ответ. т.С. метана равна 1114,54 кДж/кг.
Пример 5. Определить тепловой эффект реакции
CH3OH(г) + 3/2O2=CO2(г) + 2H2O(г) при 500К и 1013 гПа
Решение. Зависимость теплового эффекта реакции от температуры выражается уравнением Кирхгофа (если в данном процессе отсутствуют фазовые превращения)
= 0Т0 + 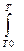 С°р dT,(1.2.3)
С°р dT,(1.2.3)
где С°р -разность сумм молярных изобарных теплоемкостей продуктов реакций и реагентов с учетом их стехиометрических коэффициентов. Приняв, что С°р не зависит от температуры в данном температурном интервале(T0 до T), уравнение (1.2.3) запишем в виде
т= 0Т0 + С°р (Т-Т0). (1.2.4)
Для решения этого уравнения необходимо знать тепловой эффект реакции при какой-либо температуре Т0. Удобно воспользоваться тепловым эффектом, вычисленным по закону Гесса- при Т0=298 К. Стандартные энтальпии образования компонентов берем из табл. 3. По формуле (1.2.1)
Hо298= Hо298 CO2 + 2 Hо298 H2O - Hо298 CH3OH(г) -3/2 Hо298 O2=
=-394-(2*241,8)-(-201,2)-0=-676,4 кДж.
Далее находим С°рпо табличным значениям Ср (табл.4):
С°р= С°р CO2 + 2 С°рH2O - С°рCH3OH -3/2 С°рO2=
37,13+2.3356-43,9-3/2·(29,36)=16>31 Дж/моль*К =
= 16,31·10-3 кДж/моль*К, отсюда по формуле (1.2.4)
°500 = -676,4+16,31·10-3(500-298) = -676,4 + 3,29 = -673,11 кДж.
Ответ. °500 = -673,11 кДж.
Задачи
13. Вычислить тепловой эффект реакции дегидрирования этана
2С2Н6 2СН4 + C2H2+H2.
Расчет произвести по стандартным энтальпиям сгорания компонентов табл. 5 и по стандартным энтальпиям образования табл. 3. Ответы сравнить.
14. Опpедeлить теплоту cгopания фocфopиcтогo водорода
2PH3 + 4O2 = P2 O5 +3H2O(ж) ; Нo.
Cтандapтныe энтальпии образования компонентов взять в табл. 3.
15. Опpедeлить тепловой эффект peaкции:
Fe3O4 + CО = 3FeO + CO2 ; Ho.
16. При cединении 2,1 г железа c ceой выдeлилocь
3,77 кДж. Pаccчитать cтандаpтнyю энтальпию oбpазoвания сульфида железа.
17. Найти кoличecтво теплоты, выделяющейся при взрыве
8,4 л гpeмучeгo газа, взятого при ноpмaльныx ycлoвияx.
18. Определить cтандатнyю энтальпию ( Hо298 ) обpазoвания
РH3 , иcxoдя из ypавнения
2PH3(г)+4O2(г)=P2О5(кр) + 5H2O(ж) ; Hо=-2398 кДж
19. Cpавнить Hо298 peакций воccтановления оксида железа (III) различными вoccтановителями при 298 K:
а) Fe2O3(кр)+2H2(г)=2Fe(кр) + 3H2O(г);
б) Fe2O3(кр)+3C(гр)=2Fe(кр) + 3СО(г);
в) Fe2O3(кр)+3CO(г)=2Fe(кр) + 3СО2(г).
20. Bычиcлить Hо298 обpaзования MgCO3(кр) при 298 K, пользуясь cледyющими данными:
C(гр)+O2(г) = CO2 (г) ; Hо298 = -394 кДж;
2Mg+O2 = 2MgO(кp); Ho298 = -1203,6 кДж;
MgO(кр) + CO2 (г)=MgCO3(кр); Ho298 = -117,6 кДж.
2 . Bычиcлить H298 pеaкций :
а) 2Li(кр)+2H2O(ж)=2Li+(водн) + 2OH-(водн) + H2(г) ;
б) 2Na(кр)+ 2H2O(ж)=2Nа+(водн) + 2OH-(водн) + H2(г).
Cтандаpтные энтальпии обpазвания Li+(водн), Na+(водн) и OH-(водн) принять cooтвeтcтвeннo paвными - 278,5: -239 и 228,9 кДж/моль.
22. Bычиcлить, какое кoличеcтвo тепла выделяeтcя при протекающих в opганизмe pеакциях пpевpaщения глюкозы:
а) C6 H12 O6 (кр) =2 C2 H5 OH( ж) + 2 CO2 (г) ; H о1
б) C6H12O6(кр)+6O2(г)=6СO2(г) + 6H2O(ж); Hо2.
Какая из этих реакций ocтавляeт оpганизмy больше энергии?
23. Cтандаpтная теплота oбpазoвания жидкого бензола при
298 K paвнa 82,9 кДж/моль. Haпишитe ypaвнение peaкции, к
котopой отноcитcя этот тепловой эффект.
24. Сколько тепла выдeлитcя при вoccтанoвлeнии 8г окиси
меди водородом c oбpазoванием жидкой воды?
25. Реакция oбpазoвания xлopиcтoгo водоpодa из xлоpа и
водорода выpажаeтcя ypавнeниeм:
H2+Cl2=2HCl; H°= -184,6 кДж.
Cкoлькo тепла выдeлитcя при coeдинeнии 1 литра xлopа c
водородом?
26. Oпpeдeлить тeплотвоpнyю cпоcобноcть этилена. Реакция
гоpeния этилена выpажаeтcя уравнением:
С2H4+3O2=2CO2+2H2O.
27. Определить теплотвоpнyю cпocoбнocть этана. Реакция
горения этана:
C2H6 +3,5O2 =2CO2+3H2O.
28. Рассчитать тeплoтвopнyю cпоcобноcть ацетилена. Реакция горения ацетилена:
C2H2+ 2,5O2=2CO2+H2O.
29. пpeдeлить тепловой эффект реакции:
CH4+2О2 =CO2+2H2О(г) при Т=700 K.
30. пpеделить тепловой эффект реакции:
4NH3+5O2=4NO+6H2O(г) пpи Т= 500 K.
31. пpeдeлить тепловой эффект peакции:
2CO+O2=2CO2 при 800 K.
32. пpeдeлить тепловой эффект реакции:
2SO2 + O2 =2SO3 при 400 K.
ЗЗ. предeлить тепловой эффект реакции oбpазoвания хлориcтoгo водopoда из xлopа и вoдopoдa при 800 K.
34. Реакция получения водяного газа H2+CO идет по уравнению
C(гр)+H2O(г)=CO(г)+H2(г) ; Ho.
Вычислите тепловой эффект Ho реакции. Найдите, сколько поглощается тепла при образовании 1000 л водяного газа (н.у.).
35. Исходя из Ho298 образования H2O(г) (-241,8 кДж/моль)
и следующих данных:
FeO(кр)+ CO(г)= Fe(кр)+ CO2(г); Hо298 =-18,2 кДж
2CO(г) + O2 (г)= 2CO2(г); Hо298 = -566,0 кДж.
вычислить Hо298 реакции
FeO(кр)+H2(г)=Fe(кр)+H2O(г).
36. Найти массу метана, при полном сгорании которой с образованием жидкой воды выделяется теплота, достаточная для нагревания 100 г воды от 293 K до 303 K. Мольную теплоемкость воды принять равной 75,3 Дж/моль*К.
37. Рассчитайте тепловой эффект Ho реакции
2Cl2 + 2H2O=4HCl + O2 ,
протекающей при 798 K, считая, что теплоемкости вcex веществ - участников реакции - в интервале 298 - 798K остаются постоянными.
38. Укажите, как изменится (увеличится, уменьшится или останется неизменным тепловой эффект реакции СО +2Н2= СН3ОН(г) при изменении температуры от 298 K до 1ООО K при
P=const.
1.3. ВТОРОЙ 3AKОH ТЕРМОДИНАМИКИ. ЭНТРОПИЯ.
ЭНЕРГИИ ГИББСА И ГЕЛЬМГОЛЬЦА. КРИТЕРИЙ
САМОПРОИ3ВОЛЬНОГО ПРОТЕКАНИЯ ПРОЦЕССА
Пример 1. Один моль кислорода расширяется до десятикратного увеличения объема и одновременно охлаждается от 400К до 300К. Чему равно изменение энтропии, если для заданного
температурного интервала мольная изобарная теплоемкость кислорода C = 29,2 Дж/моль*К (Ср считаем в данном интервале температур постоянной).
Решение. Общее изменение энтропии S будет складываться из изменения энтропии газа S1 при его расширении и изменения энтропии газа S2 при изменении температуры:
S1= R ln  , (1.3.1)
, (1.3.1)
где R - газовая постоянная; V1 и V2 — соответственно конечный и начальный объемы газа. .Находим по формуле (1.3.1)
S1= 8,31*ln10=19,1 Дж/моль*K.
S2 =Cp*ln  , (1.3.2)
, (1.3.2)
где С - мольная изобарная теплоемкость О2; Т2 и Т1 — конечная и начальная температуры.
Отсюда
S2 = 29,2·1n  = -8,05 Дж/моль*К, тогда S = S1+S2= 19,1-8,05 = 11,05 Дж/моль*К.
= -8,05 Дж/моль*К, тогда S = S1+S2= 19,1-8,05 = 11,05 Дж/моль*К.
Ответ. S = 11,05 Дж/моль*К.
Пример 2. При охлаждении 12 л кислорода от 473 до 233 K одновременно повышается давление от 105 до 6·106. Рассчитать изменение энтропии, если мольная изобарная теплоемкость кислорода Ср = 29,2 Дж/моль*К (газ считать идеальным).
Решение. Рассчитаем число молей кислорода из уравнения состояния идеального газа
pV= nRT ; n=  =(105*12*10-3)/(8,31*473)= 0,3052 моля.
=(105*12*10-3)/(8,31*473)= 0,3052 моля.
Общее изменение энтропии S будет складываться из изменения энтропии S1 при увеличении давления и изменения энтропии S2 при охлаждении газа
S1 =R ln  , (1.З.З)
, (1.З.З)
где 1 и 2 — исходное и конечное давления; R — газовая постоянная.
S2 находим по формуле (1.3.2).
Отсюда
S = R ln  + Cpln
+ Cpln  .
.
Так как у нас участвует 0,3052 молей кислорода, то
S =0,3052(8,31*ln(105/(6*106)) + 29,2*ln(233/437))=-16,77 Дж/моль*К.
(энтропия уменьшается при охлаждении газа).
Ответ. S = —16,77 Дж/моль*К.
Пример 3. Определить изменение энтропии S при нагревании 30 г ледяной уксусной кислоты (СН3 СООН) от температуры плавления до 333 K. пл уксусной кислоты 289,6 K. Теплота
плавления пл= 194 Дж/г, удельная теплоемкость уксусной кислоты равна 2,19 Дж/г*К.
Решение. Общее изменение энтропии S Равно сумме изменения энтропии при плавлении уксусной кислоты S1 и при нагревании жидкой уксусной кислоты от пл до заданной температуры (333 К) S2
S1= Hпл/Tпл (1.3.4)
1 моль СН3СООН= 60 г.
По формуле (1.3.4) находим S1=194*30/289,6*60=20,1 Дж/К
S2 рассчитываем по формуле (1.3.2):
S2=Сpln(T2/T1)=2,19*30ln(333/289,6)=9,20 Дж/К.
Тогда
S = S1 + S2= 20,1+9,2=29,3 Дж/К.
Ответ: S = 29,3 Дж/К.
Пример 4. Определить изменение энтропии Sо и энергии Гиббса Gо при стандартных условиях для системы
Fe3О4 + CO = 3FeO + CO2
и решить вопрос о возможности самопроизвольного протекания ее при указанных условиях.
Решение. Значения Sо и Gо Для реакции определяем по следствию из закона Гесса (2.2.1). Стандартные энтропии S°298 и энергии Гиббса Gо 298 компонентов берем из табл.3.
Следовательно,
продукты реагенты
Sо = j S°298 - i S°298.
или
Sо = 3Sо298 FeO + Sо298 CO2 - Sо298 Fe3O4 - Sо298 CO =3*58,79 + 213,6 -151,46 – 197,4 = 39,11Дж
продукты реагенты
Gо = j Gо 298 - i Gо 298. (1.3.6)
или
Gо = 3 Gо 298 FeO + Gо 298 CO2 - Gо 298 Fe3O4 - Gо 298 CO = 3(-246,0) – 394,89 +1010 +137,4 = 14,51 кДж
Если G < О, процесс идет самопроизвольно, при G > 0 процесс не идет. В данном случае G > 0, следовательно, процесс самопроизвольно не пойдет.
Ответ. S° = 39,11 Дж; Gо = 14,51 кДж, реакция самопроизвольно не пойдет.
Пример 5. Вычислить стандартное значение изменения свободной энергии Gо реакции: C2H2+5/2 О2 = 2 CО2 + Н2О (ж); Gо,
По табличным данным -Sо298 и о298 для компонентов (табл. 3).
Решение. Определяем тепловой эффект и изменение энтропии реакции по закону Гесса (формулы (1.2.1) и (1.3.5)).
° = °298 H2O + 2°298 CO2 - 2°298 C2H2= -285,8+2* (-394)-226,8= -1299,6 кДж/моль;
S°= Sо298 H2O + 2Sо298 CO2 - Sо298 C2H2 – 5/2Sо298 O2 =
= 70+2213,6-200,8-2,5*205= -216,2 Дж/моль*К;
S°= -0,2162 кДж/моль*К.
Изменение изобарно-изотермического потенциала находим по формуле
G° = °- T Sо, (1.3.7)
G°= -1299,6+0,2162*298= -1235,19 кДж/моль.
Таким образом, Gо < 0 - самопроизвольный процесс возможен.
Ответ. Gо =-1235,19 кДж.
Задачи
39. Определить изменение энтропии для 1 кг воздуха при нагревании его от 223 до 323 К (при этом происходит изменение давления от 106 до 105 Па). Массовая теплоемкость воздуха 1,005 Дж/г*К. Средняя молекулярная масса воздуха 29.
40. Средняя массовая теплоемкость железа равна 0,486 Дж/г* К. Определить изменение энтропии S при нагревании 1 кг железа от 100 до 150оС.
41. Определить суммарное изменение энтропии при нагревании 1 моля бензола от температуры плавления (5,49 С) до полного испарения при температуре кипения (80,2оС). Теплота
плавления бензола 126,54 Дж/г, теплота парообразования 396 Дж/г, массовая теплоемкость бензола 1,94 Дж/г* К.
42. Вычислить cyммаpное изменение энтропии при нагревании 1 моля воды от темпеpатуpы плавления до полного иcпаpения пpи температypе кипения. Теплота плавления льда 335,2 Дж/г, теплота паpообpазоваиия воды 2260 Дж/г, маccовая теплоемкость воды 4,188 Дж/г*K.
43. Вычиcлить изменение энтpопии S пpи cтандapтныx
уcловияx для yравнений pеакций:
2H2S+SO2=2H2O(ж)+3S(кр) ; Zn(кр)+H2SO4(ж) = ZnSO4(ж) + H2(г).
CH4 + 2O2 = CO2 +2H2O(r) .
44. Oпpеделить изменение энеpгии Гиббcа для реакции
N2+2H2O(ж)=NH4NO2; Go
и дать заключение о возможноcти ее пpотекания пpи cтандаpтных ycловиях.
45. Вычиcлить изобарно-изотeрмичecкий потеициал Go реакций и дать заключение о возможноcти иx пpтекания пpи cтандаpтныx yсловияx:
а) 3С2H2=C6H6 ; Go1 ;
б) CO2+2NH3NH2-CO-NH2 + H2O(ж) ; G°2;
в) СH3-CH2-CH2OH CH3-СН=СН2 + Н2О(ж); G°3.
46. Hе пpоизводя вычиcлений, ycтанвить знак S cледyющиx пpоцеcсов:
а) 2NH3(г)=N2(г)+3H2(г) ;
б) CO2(кр)=CO2(г) ;
в) 2NO(г)+O2(г)=2NO2(г) ;
г) 2H2S(г)+3O2(г)=2H2O(ж)+2SO2(г) ;
д) 2CH3OH(г)+3O2(г)=4H2O(г)+2CO2(г).
47. Опpеделить знак изменения энтpoпии для pеакций:
2A2(г)+B2(г)=2A2B(ж).
Возможно ли пpотекание этой pеакции в cтандаpтны ycловияx? Ответ обоcновать.
48. Установить, пpотекание какиx из нижеcледyющих pеакций возможно в cтандаpтных ycловияx пpи 298 K:
а) N2(г)+1/2O2(г) =N2O(г);
б) 4HCl(г)+ O2 (г) = 2Cl2 (г) + 2H2O(ж) ;
в) Fe2O3(кр)+ 3CO(г)=2Fe(кр)+ 3CO2(г) .
49. Вычислить G для реакции:
CаCO3(кр) = СаО(кр)+CO2(г)
при 298 К, 773 К и 1773 K. Зависимостью H , S от температуры пренебречь. Построить график зависимости G от температуры и найти по графику температуру, выше которой указанная реакция может протекать самопроизвольно.
50. Вычислить G°298 следующих реакций восстановления
оксида железа (II):
а) FeO(кр) + 1/2 C(гр) = Fe(кр) + 1/2 CО2 (г);
б)FeO(кр) + C(гр) = Fe(кр) + CO(г) ;
в) FeO(кр) + CO(г) = Fe(кр) + CO2(г) .
Протекание какой из этих реакций наиболее вероятно?
51. Указать, какие из реакций образования оксидов азота,
и при каких температурах (высоких или низких) могут протекать самопроизвольно:
а) 2N 2(г) + O2 (г) = 2N2O(г) ; Hо298>0 ;
б) N2(г) + O2(г) = 2NO(г) ; Hо298>0 ;
в) 2NO(г) + O2(г) = 2NO2(кр); Hо298<0 ;
г) NO(г) + NO2(г) = N2 O3 (кр) ; Hо298<0 ;
д) N2(г) + 2O2(г) = 2NО2(г) ; Hо298>0 ;
52. На основании расчета G°298 реакций сделайте вывод,
какие из перечисленных ниже окислов могут быть восстановлены алюминием при 298 К: CаО; FеO; СuО, PbO; Fe2O3 ; Cr2O3?
53. Можно ли получить пероксид водорода H2О2 по реакции:
2H2O(ж) + O2 (г) = 2N2O2(ж).
54. Возможно ли горение кальция в атмоофере оксида углерода по реакции
Са (кр) + CО(г) = CаO(кр) + C(кр).
55. Чему равно изменение энтропии S при плавлении одного моля льда при 273,15 K, если изменение энтальпии при плавлении льда Hпл= 6016,8 Дж/моль.
1.4. ХИМИЧЕСКОЕ РАВНОВЕСИЕ. КОНСТАНТА ХИМИЧЕСКОГО РАВНОВЕСИЯ
Пример 1. Вычислить изменение энергии Гиббса G в реакции димеризации диоксида азота 2NО2(г)= N2O4(г) при стандартной температуре 298 К, 273 К и 373 К. Сделать вывод о направлении процесса. Определить константы равновесия реакции димеризации диоксида азота при выше указанных температурах. Определить температуру, при которой G = 0. Сделайте вывод о направлении этой реакции выше и ниже этой температуры. Термодинамические характеристики компонентов:
°298 So298
В-во кДж/моль Дж/моль*K
NO2 (г) 33,3 240,2
N2O4(г) 9,6 303,8
Решение. Для обратимого процесса:
aA(г) + bB(г) сС(г) + dD(г)
выражение для константы равновесия Kр будет
Kр =(PcC*PdD)/(PaA*PbB)
где PA, PB, PC, PD - равновесные парциальные давления газообразных компонентов А,В,С,D a, b, c, d - стехиометрические коэффициенты.
Для процесса aA(ж)+bB(ж) сC(ж)+dD(ж) выражение для константы равновесия
Kc = (CcC*CdD)/(CaA*CbB)
где CA, CB, CC, CD - равновесные концентрации веществ А,В,С,D a, b, c, d - стехиометрические коэффициенты.
По формуле (1.4.1) для системы 2NO2 N2O4 имеем
Kр =PN2O4/P2NO2
При стандартной температуре 298 K изменение энтальпии ( Ho реакции) определим по формуле (1.2.2)
Ho реакции = °298 N2O4 - 2°298 NO2 = 9,6-2*33,5 = -57400 Дж.
Изменение энтропии (1.3.5)
So реакции = S°298 N2O4 - 2S°298 NO2 =303,8-2* ( 240 ,2 )=-176 Дж/моль*К
Пользуясь принципом Ле-Шателье, который говорит о том, что при изменении условий, при которых обратимая реакция находится в состоянии равновесия, равновесие сместится в сторонy процесса ослабевающего изменения, предскажем направление смещения равновесия. Значение о отрицательно, следовательно реакция образования экзотермическая (идет c выделением тепла) и при понижении температуры равновесие должно смещаться вправо, при повышении температуры - влево. Кроме того, по фopмyлe (1.3.6), зная, что H<O; S < 0 мы можем сделать заключение о том, что G < 0 будет при низких температypax; G < 0 характеризует возможность самопроизвольного процесса; G > 0 характеризует невозможность самопроизвольного процесса (см. пример 4 разд. 1.3). Следовательно, в нашем случае при понижении температуры будет предпочтительнее образование N2О4 (равновесие смещается вправо), а при увеличении температуры предпочтительнее образование NO2 (равновесие смещается влево). Качественные выводы подтвердим расчетами
Go273; Go298 ; Go373 и K273; K298 ; K373
Значение энергии Гиббса для заданных температур рассчитаем по формуле (1.3.7):
Go298=Ho-TSo=-57400-298*(-176)=-4952Дж.,
Go273=-57400-273*(-176)=-9352Дж:
Go373=-57400-373*(-176)= 7129 Дж.
Отрицательное значение Go298 говорит о смещении равновесия реакции вправо, а более высокое отрицательное значение Go273 свидетельствует о том, что при снижении температуры от (298 до 273 К) равновесие смещается вправо.
Положительное значение Go373 указывает на изменение направления самопроизвольного процесса. При этой температуре предпочтительнее становится обратная реакция (смещение равновесия влево).
Константы равновесия Кp и энергию Гиббса Go связывает формула
Go=-RTlnKp
где Кp — константа равновесия процесса; R - газовая постоянная; T - абсолютная температура. По формуле (1.4.3) имеем:
lnK273=- Go273/RT=9352/8,31*273=4,12
K273= 61
lnK298= -Go298/RT=4952/8,31*298=2
K298=7,3
lnK373= -Go373/RT=-7129/8,31*298=-2,3
K373=0,1
значение К298 и K273 > 1 показывает на смещение равновесия вправо (сравни с (1.4.1)) и тем больше, чем выше значение константы равновесия. K373 < 1, говорит смещении равновесия в системе влево (сравни с (1.4.1)).
Условию Goреакции =0 отвечает константа равновесия,
реакции
равная единице.
Рассчитаем температуру Т , соответствующую этой константе по формуле (1.3.7):
G°=°-TSo ; O=Ho-TSo;
TG=0 =°/S°=57400/176=326,19 K
Вывод. При температуре 326,19 K прямая и обратная реакции протекают c одинаковой вероятностью, Kр=1. С понижением температуры равновесие будет смещаться вправо с повышением влево.
Пример 2. Константа равновесия Кр реакции синтеза NH3 по реакции N2+3H2==2NH3 при 623 K равна 2,32*10-13. Вычислить Кс при той же температуре.
Решение. Связь Кр и Кс осуществляется по формуле
K p= Kc (RT)n, (1.4.4)
n= n2- n1 =2-4= -2, где n1и n2 количество молей peaгентов и продуктов. Следовательно,
Kc=Kp/(RT)n=0,624*10-5
Ответ. К = 0,624*10-5.
Пример 2. Упругость диссоциации карбоната кальция при 1154 К равна 80380 Па, а при 1164 K - 91177 Па. Рассчитать, при какой температуре упругость диссоциации карбоната кальция будет равна 101325 Па.
Решение. Реакция диссоциации CaCO3(кр) CaO(кр)+СО2(г)
Отсюда по (1.4.1)
Kp=PCO2
Следовательно, при каждой температуре (Т1 - 1154 K; =1164 К* = X) константы равновесия будут соответствовать давлению:
KT1 = 80380; KT2 = 91177; K T3 = 101325.
Зависимость константы равновесия от температуры показывает уравнение Аррениуса
dlnKp/dT= /RT2 (1.4.5)
где Кp - константа равновесия; - температура, К; - тепловой эффект реакции; R - газовая постоянная.
Интегрируя уравнение (1.4.5) в интервале температур Т1-Т2 при H= соnst получим
lnKT1/KT2= /R(1/T1-1/T2),
Где KT1 и KT2 – константы равновесия при T1 и T2.
Определим сначала (по 1.4.6)
=ln(91177*8,31*1154*1164/80380*10)=140500 Дж/моль.
Далее определяем T3
ln(101325/91177)=140500/8,31(1/1164-1/T3)
T3=1172 K
Ответ. При Т=1172К упругость диссоциации карбоната кальция будет равна 101325 Па.
Задачи
56. Константа диссоциации уксусной кислоты при 298 К равна 1,75*10-5. Чему равно изменение энергии Гиббса диссоциации уксусной кислоты?
57. Найти значение энергии Гиббса (Go298) и константы равновесия K298 для реакции BaSО4(кр) Ba2+(р) + SО2-4(p).
Для расчета использовать следующие данные:
Вещество Sо298 Дж/моль*К Ho 298кДж/моль 2^ 2^
BaSO4(кр) 132,4 -1447,39
Ba2+(р) 9,64 -533,83
SO2-4 (р) 18,44 -904,2.
58. Найти константу равновесия при 473 К для реакции гидратации этилена
С2Н4(г) + H2O(г)=С2Н5ОН(г).
Свойства реагентов взять в табл. 3. Зависимостью S и H от температуры пренебречь.
59. Считая, что Ho 298 и Sо298реакции 4HCl+O2 2Н2О + 2Сl2 не зависят от температуры, найти температуру, при которой
Кр =1, а Go= О.
60. Пользуясь табличными данными, вычислить константы равновесия следующих реакций при 298 К и при 1000 К:
а) Н2О(г) + СО СО2 + Н2
б) СО2 + С(гр) 2СО;
c) N2 + 3H2 2NH3.
Изменениями Hoи Sоот температуры пренебречь.
61. Для некоторой самопроизвольно протекающей реакции S < О. Как будет изменяться константа равновесия с повышением температуры: а) увеличиваться, б) уменьшаться, в) по данным задачи нельзя определить.
62. Не пользуясь вычислениями, установить знак So следующих процессов:
а) 2NH3(г) N2(г) + H2(г) ;
б) CO2(кр) CO2(г);
в) 2NO(г) + O2(г) = 2NO2(г);
г) 2Н2S(г) + 3O2 = 2H2O(ж) + 2SO2(г);
д) 2СН3ОН(г) + 3О2(г) = 4H2O(г) + 2СО2(г).
63. В каком из следующих случаев реакция возможна при любых температурах: а) Н°< 0, S°> 0; б) Н°<0, S°<0; в) Н°>0, S°> 0 ?
64. В каком из следующих случаев реакция неосуществима при любых температурах: а) Н°> 0, S°> 0; б) Н°>0, S°<0; в) Н°<0, S°<0 ?
65. Если °<0 и S°<0 , в каком из случаев реакция может протекать самопроизвольно:
а)| Н°| > |TS°|; б)| Н°| > |TS°| ?
66. Какими воздействиями на систему можно сместить равновесие систем:
а) N2(г) + 3Н2(г) 2NH3(г) ;
б) 4Fe(кр) + 3О2(г) 2Fe2O3(кр);
в) SO2(г) + О2(г) 2SO3(г).
67. В каком направлении произойдет смещение равновесия при повышении температуры в системах:
1) СОCl2 CO +Cl2; Н°=113 кДж;
2) 2СО СО2 + С; Н°=-171 кДж;
3) 2SO3 2SO2 + O2; Н°=192 кДж.
68. В каком направлении сместится равновесие при повышении давления в системах:
1) Н2(г) + S(кр) Н2S(г) ;
2) 2CO(г) СО2(г) + С(гр);
3) 4HCl(г) +О2(г) 2Н2О(г) + 2Cl2(г).
69. Как повлияет на равновесие следующих реакций:
СаСО3(кр) СаО(кр) + СО2(г); Н°=178 кДж;
2СО(г) + О2(г) 2СО2 ; Н°=-566 кДж;
N2(г) + О2(г) 2NO(г) ; Н°=180 кДж.
а) повышение температуры,
б) повышение давления?
70. Используя справочные данные, найти приближенное значение температуры, при которой константа равновесия реакции образования водяного газа
С(гр) + Н2О(г) СО(г) + Н2(г)
равна 1. Зависимостью Hoи Sоот температуры пренебречь.
71. Константа равновесия Кр реакции СО+Сl2 СОCl2 при 600о С равна 1,67*10-6. Вычислять Кс реакции при данной температуре.
72. Упругость диссоциации карбоната магния при 1000 К равна 42189 Па, а при 1020 К - 80313 Па. Определить тепловой эффект реакции MgCО3 МgО+СO2 и температуру, при которой упругость диссоциации карбоната магния станет равной 1 Па.
73. Для реакции S02+1/2О2SO3 константа равновесия Кр при 900 К равна 2,058·10-2. Вычислить Кс для данной реакции при указанной температуре.
74. Определить константу равновесия KT2 при T2=1069 K для реакции 2СО С + О2 , если при T1 = 1000 K KT1=8,1*10-8, а H=-109,5 кДж/моль.
75. Для реакции CO(г) + H2O(г) СО2(г) + Н2(г) определить Кр при 398 К, если при 298 К константа равновесия этой реакции равна 1*105. Для температуры 298 К рассчитайте изменение энергии Гиббса (G°).
Глава 2. РАСТВОРЫ
2.1. КОНЦЕНТРАЦИЯ РАСТВОРОВ. ТИТРОВАНИЕ
Пример 1. Какова процентная концентрация раствора, полученного в результате растворения 18 г едкого натра в 180 г воды?
Решение. Процентная концентрация выражается числом граммов растворенного вещества, содержащимся в 100 г раствора. Общая масса раствора составляет 18+180=198 г. В 198 г раствора содержится 18 г щелочи, а в 100 г раствора будет содержаться X г (или Х%):
18 - 198
X – 100
Х=18*100/198=9,1%
Ответ. При растворении 18 г едкого натра в 180 г воды получается раствор 9,1%-й концентрации.
Пример 2. Сколько граммов КОН нужно взять для приготовления 500 мл 0,1 раствора?
Решение. Молярная концентрация (М) выражается числом молей растворенного вещества, содержащимся в 1 л раствора.
1 моль КОН имеет массу 56 г. 0,1 моль составляет 5,6 г. Следовательно, в 1000 мл 0,1 раствора содержится 5,6 г, а в 500 мл в два раза меньше, т.е. 2,8 г.
Ответ. Для приготовления 500 мл 0,1 раствора КОН нужно взять 2,8 г КОН, растворить в небольшом количестве воды в мерной колбе и разбавить водой до 500 мл.
Пример 3. Определить нормальную концентрацию и титр раствора серной кислоты, в 250 мл которого содержится 24,5г.
Решение. Нормальная концентрация выражается числом грамм-эквивалентов растворенного вещества, содержащимся в 1 л раствора.
В 250 мл H2SО4 содержится 24,5 г, а в 1000 мл раствоpa X, следовательно,
Х=24,5*1000/250=98 г.
Эквивалент кислоты равен ее молекулярной массе, деленной на основность. Эквивалент серной кислоты равен 49, значит, 98 г составляет 2 г-экв.
Титром раствора называется количество вещества в граммах, содержащегося в одном миллилитре раствора Т=НЭ/1000, где Т - титр раствора; Н - нормальная концентрация; Э - эквивалент.
Следовательно, = 2*49/1000 = 0,098 г/мл.
Ответ. Данный раствор H2SO4 является 2 (двунормальным); титр равен 0,098 г/мл.
Пример 4. Определить нормальную концентрацию 16%-ного раствора NaOH ( = 1,18).
Решение. Масса 1 л 16%-го раствора aО равна произведению объема на плотность, т.е. 1000 мл*1,18 г/мл=1180г.
В 16%-м растворе содержится 16 г aОН в 100 г раствора, отсюда в 1180 г раствора будет содержаться 1180*16/100=188,8 г.
1 моль NaOH = 40 г. Эквивалент основания равен его молекулярной массе, деленной на число гидроксильных групп. Грамм—эквивалент едкого натра равен 40/1=40 г. Следовательно,
нормальность раствора 188,8г/40г=4,72 Н.
Ответ. Нормальность раствора 4,72 Н.
Пример 5. Сколько миллилитров 0,25 раствора серной кислоты потребуется для осаждения в виде BaSO4 всего бария, содержащегося в 20 миллилитрах 2 раствора хлористого бария?
Решение. Одним из методов определения концентрации растворов является титрование. Титрование в общем случае означает постепенное прибавление определенного количества реагента к анализируемому раствору при титрометрическом анализе. Титрометрический анализ представляет собой метод, основанный на измерении объема раствора известной концентрации, который расходуется на реакцию с данным объемом раствора неизвестной концентрации.
В соответствии с законом эквивалентов растворы одинаковой нормальности реагируют в равных объемах. Если реагируют растворы различной нормальности, то объемы таких растворов обратно пропорциональны их нормальностям;
V1/V2=H2/H1 (2.1.1)
где Н1 и Н2 — нормальные концентрации; V1 и V2 — объемы растворов.
Обозначив искомый объем раствора серной кислоты через V1, составляем по формуле (2.1.1) пропорцию: V1 : 20 = 2:0,25, откуда V1=20*2/0,25=160 мл.
Ответ. Для полного осаждения потребуется 160 мл 0,25 М раствора.
Пример 6. Вычислить модальность т 10%-го раствора серной кислоты.
Решение. Модальная концентрация выражается числом молей растворенного вещества, содержащегося в 1000 г растворителя.
В 100 г, 10%-го раствора содержится 10 г кислоты и 90 г воды. Определяем содержание серной кислоты в 1000 г воды. Оно равно (1000*10)/90=111,1 г, что составляет 111,1/98= 1,13 моль серной кислоты.
Ответ. Моляльность 10%-го раствора серной кислоты равна 1,13.
Задачи
1. Сколько граммов КСl следует растворить в 100 г воды для получения 5%-го раствора?
2. Сколько граммов NaNO3 и воды необходимо для приготовления 1,6 кг 10%-го раствора?
3. Сколько граммов Na2SO4 следует растворить в 400 г воды для получения 8%-го раствора?
4. Сколько граммов НСl содержится в 250 мл 10%-го раствора, плотность которого 1,05?
5. Чему равна молярная концентрация раствора, который содержится в 3 л
175,5 г поваренной соли?
6. Сколько граммов а ОН необходимо взять для приготовления 125 мл 0,15 раствора?
7. Сколько граммов 3 содержится в 200 мл 0,1 раствора HNO3?
8. В каком объеме 0,1 раствора содержится 7,1 г Na2SO4 ?
9. Сколько граммов Na2CO3 содержится в 500 мл 0,1 H раствора?
10. Сколько воды надо прибавить к 200 мл 1 раствору NаОН , чтобы получить 0,05 раствор?
11. Сколько миллилитров 0,2 раствора щелочи потребуется для осаждения в виде Fe(0H)3 всего железа, содержащегося в 100 мл 0,5 раствора?
12. Для нейтрализации 20 мл 0,1 раствора кислоты потребовалось 8 мл раствора едкого натра. Сколько граммов едкого натра содержится в 1 л этого раствора?
13. На нейтрализацию 40 мл раствора щелочи пошло 24 мл 0,5 раствора серной кислоты. Какова нормальность раствора щелочи? Сколько 0,5 Н HCl потребовалось бы для той же цели?
14. Для осаждения всего хлора, содержащегося в 15 мл раствора NaCl , израсходовано 25 мл 0,1 раствора AgNO3. Сколько граммов NaCl содержит 1 л этого раствора?
15. Сколько граммов 5%-го раствора AgNO3 требуется для обменной реакции со 120 мл 0,6 раствора AlCl3?
16. Вычислить моляльность 4,7 раствора aО, плотность которого 1,175 г/см3 .
17. Вычислить моляльность 10 раствора серной кислоты.
Плотность раствора 1,290 г/см3.
18. В 50 мл воды растворили 18 г глюкозы. Определить моляльность полученного раствора.
19. Смешаны 800 мл 3 КОН и 1,2 л 12%-го раствора КОН ( = 1,1). Чему равна нормальная концентрация и титр полученного раствора?
20. Чему равна нормальная концентрация и титр 18%-го раствора HCl ( =1,09)?
21. Xлороводород (HCl) растворен в 1 л воды. На титрование 10 мл полученного раствора пошло 5 мл 0,1 раствора едкого натра аОН. Какова нормальная концентрация полученного раствора кислоты?
22. При титровании 30 мл раствора ортофосфорной кислоты потребовалось 20 мл 2 раствора едкого калия КОН. Определить нормальную концентрацию кислоты.
2.2. ТЕМПЕРАТУРА КИПЕНИЯ И ТЕМПЕРАТУРА ЗАМЕРЗАНИЯ
РАЗБАВЛЕННЫХ РАСТВОРОВ НЕЭЛЕКТРОЛИТОВ
Пример 1. Вычислить температуру замерзания раствора, содержащего 5,4 г глюкозы C6H12O6 в 250 г воды. Криоскопическая константа воды равна 1,86o.
Решение. Математически зависимость между величиной понижения точки замерзания растворителя и количеством растворенного вещества может быть выражена формулой (закон Рауля)
T3ам =K*m (2.2.1)
где T3ам — понижение температуры замерзания раствора; К —
криоскопическая константа; m — моляльность раствора.
Моляльность раствора
m=(g2*1000)/(M*g1), (2.2.2).
где g1- масса растворителя; g2 - масса растворенного вещества; - мольная масса растворенного вещества.
Тогда, подставив (2.2.2) в формулу (2.2.1), получим Тзам=K*g2*1000/M*g1 .
Мольная масса глюкозы С6Н16О6 = 180 г. Подставляя данные в формулу (2.2.3), получим;
Тзам=1,86*5,4*1000/180*250=0,223.
Ответ. Раствор будет замерзать при -0,223о С.
Пример 2. При растворении 0,94 г фенола C6H5OH в 50г спирта температура кипения повысилась на 0,232°. Определить молекулярную массу фенола, если эбуллиоскопическая константа спирта равна 1,16о .
Решение. Зависимость между повышением точки кипения растворителя и количеством растворенного вещества выражается формулой:
Ткип=E*m=E*g2*1000/M*g1 , (2.2.4)
где Ткип - повышение температуры кипения раствора; —эбуллиоскопическая константа; g2 — количество граммов вещества, содержащееся в g1 граммах растворителя.
Подставляя известные величины в формулу (2.2.4), получим
M=E*g2*1000/Т*g1=1,16*0,94*1000/0,232*50=94 г.
что соответствует молекулярной массе фенола, равной 94 a.e.м.
Ответ. Молекулярная масса фенола равна 94 а.е.м.
Пример 3. Раствор, содержащий 0,85 г хлористого цинка ZnCl2 в 125 г воды, замерзает при -0,23o С. Определить кажущуюся степень диссоциации ZnCl2 в этом растворе.
Решение. Для растворов электролитов в формулы (2.2.1) и (2.2,4) вводится поправка - изотонический коэффициент i:
Тзам=i*K*m; (2.2.5)
Ткип= i*E*m; (2.2.6)
Выразим моляльность раствора, так как молекулярная маccа ZnCl2 равна 136 а.е.м., тогда
m=0,85*1000/125*136=0,05 моля.
Вычисляем изотонический коэффициент:
i= Тзам/K*m=0,23/1,86*0,05=2,47
Между изотоническим коэффициентом i, степенью диссоциации и числом ионов n , на которое распадается молекула электролита, существует зависимость, выражающаяся по формуле . .
=(i-1)/(n-1)
Находим кажущуюся степень диссоциации:
= (2,47-1)/(3-1) = 0,735 или 73,5%.
Ответ. ОС = 73,5%.
Задачи
23. Вычислить, на сколько градусов понизится температура замерзания бензола, если в 100 г его растворить 4 г нафталина C10H8 .
24. На сколько градусов повысится температура кипения, если в 100 г воды растворить 9 г глюкозы C6H12O6?
25. При какой температуре будет кипеть 50%-й водный раствор сахара C12 H22 O11?
26. Сколько граммов сахара C12 H22 O11 растворить в 100 г воды, чтобы понизить ее точку замерзания на 1oС?
27. В каком количестве воды следует растворить 23 г глицерина С3Н8О3, чтобы получить раствор с температурой кипения 100,104°?
28. Сколько граммов глюкозы C6H12O6 следует растворить в 260 г воды, чтобы температура кипения раствора повысилась на 0,05°С?
29. Раствор, содержащий 5,4 г неэлектролита в 200 г воды, кипит при 100,078°С. Вычислить молекулярную массу растворенного вещества.
30. Раствор, содержащий 2 г растворенного вещества в 200 г воды, замерзает при -0,547°С. Вычислить молекулярную массу растворенного вещества.
31. Раствор, содержащий 6,15 г растворенного вещества в 150 г воды, замерзает при -0,93°С. Определить молекулярную массу растворенного вещества.
32. При растворении 2,76 г глицерина C3H8O3 в 200 г воды температура замерзания понизилась на 0,279o C. Определить молекулярную массу глицерина.
33. Раствор, приготовленный из 2 кг этилового спирта С2Н5OН и 8 кг воды, залили в радиатор автомобиля. Вычислить температуру замерзания раствора.
34. Раствор, содержащий 2,7 г фенола C6H5OH в 75 г бензола, замерзает при 3,5°С, тогда как чистый бензол замерзает при 5,5°С. Вычислить криоскопическую константу бензола.
35. Температура кипения уксусной кислоты 118,4°С. Эбулиоскопическая константа 3,1о. Раствор антрацена в уксусной кислоте, содержащий 10 г антрацена в 164 г раствора, кипит при 119,53°С. Вычислить молекулярную массу антрацена.
36. Антрифризы - жидкости с пониженной температурой замерзания,