Экспериментальное обоснование представления об атоме как о сложной системе. Состав атомного ядра, изотопы.
Понятие «атом» было известно ещё в древности и использовалось для описания представлений об устройстве окружающего мира древнегреческими философами, так Левкипп (500-200 гг. до н.э.) утверждал, что мир состоит из мельчайших частиц и пустоты, а Демокрит назвал эти частицы атомами и считал, что они существуют вечно и способны двигаться. По представлениям древних философов атомы были настолько малы, что не могли быть измерены, а форма и внешнее различие придают свойства определенным телам. Например, атомы железа должны обладать «зубцами», чтобы зацепляться друг за друга и образовывать твердое тело, атомы же воды, напротив, должны быть гладкими и перекатываться, чтобы обеспечивать воде текучесть. Первое предположение о способности атомов самостоятельно взаимодействовать друг с другом было сделано Эпикуром.
 К концу XIX в. были накоплены сведения, подтверждающие сложное строение атома. В тот период был выдвинут целый ряд моделей строения атома. Одна из первых моделей была предложена Джозефом Томсоном в 1903 г. Томсоновская модель «сливового пудинга» (в русском литературном переводе – «булочка с изюмом») уподобляла атом положительно заряженному сферическому пудингу, в который вкраплены отрицательно заряженные шарики – электроны.
К концу XIX в. были накоплены сведения, подтверждающие сложное строение атома. В тот период был выдвинут целый ряд моделей строения атома. Одна из первых моделей была предложена Джозефом Томсоном в 1903 г. Томсоновская модель «сливового пудинга» (в русском литературном переводе – «булочка с изюмом») уподобляла атом положительно заряженному сферическому пудингу, в который вкраплены отрицательно заряженные шарики – электроны.
Атомы элементов состоят из нескольких отрицательно заряженных частиц заключенных в сферу и имеющих однородно распределенный положительный электрический заряд.
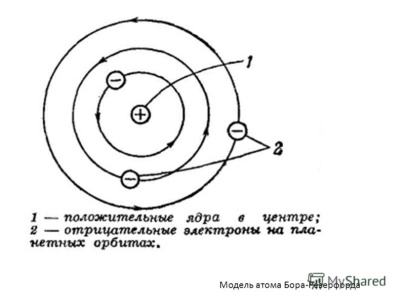 В жизни часто случается, что ученики продолжают путь, начатый учителями, и идут в этом направлении дальше. Так, ученик Томсона Эрнест Резерфорд на основе данных подготовленного и проведенного им эксперимента сделал вывод, что в атоме положительный заряд сконцентрирован в малом объеме. Атом состоящий из крохотного положительно заряженного ядра вокруг которого вращаются электроны.
В жизни часто случается, что ученики продолжают путь, начатый учителями, и идут в этом направлении дальше. Так, ученик Томсона Эрнест Резерфорд на основе данных подготовленного и проведенного им эксперимента сделал вывод, что в атоме положительный заряд сконцентрирован в малом объеме. Атом состоящий из крохотного положительно заряженного ядра вокруг которого вращаются электроны.
Боровская модель атома (Модель Бора) полуклассическая модель
атома, предложенная НильсомБором в 1913 г. За основу он взял
планетарную модель атома, выдвинутую Резерфордом. Однако, с
точки зрения класической электродинамики, электрон в модели
Резерфорда, двигаясь
вокруг ядра, должен был бы излучать непрерывно, и очень быстро, потеряв энергию, упасть на ядро. Чтобы преодолеть эту проблему Борввел
допущение, суть которого заключается в том, что электроны в атоме могут двигаться только поопределенным (стационарным) орбитам, находясь на
которых они не излучают, а излучение или поглощениепроисходит только в момент перехода с одной орбиты на другую.
Атом— это наименьшая частица химического элемента, сохраняющая все его химические свойства.
Атом состоит из ядра, имеющего положительный электрический заряд, и отрицательно заряженных электронов.
Заряд ядра любого химического элемента равен произведению Z на e, где Z — порядковый номер данного элемента в периодической системе химических элементов, е — величина элементарного электрического заряда.
Электрон — мельчайшая частица вещества с отрицательным электрическим зарядом е=1,6·10-19кулона, принятым за элементарный электрический заряд. Размер атома определяется размером его электронной оболочки. Атом может терять электроны и становиться положительным ионом или присоединять электроны и становиться отрицательным ионом. Заряд иона определяет число потерянных или присоединенных электронов. Процесс превращения нейтрального атома в заряженный ион называется ионизацией.
Атомное ядро (центральная часть атома) состоит из элементарных ядерных частиц — протонов и нейтронов. Радиус ядра примерно в сто тысяч раз меньше радиуса атома. Плотность атомного ядра чрезвычайно велика.
Протоны — стабильные элементарные частицы, имеющие единичный положительный электрический заряд и массу. Число протонов в ядре равно Z.
Нейтрон — нейтральная (не имеющая электрического заряда) элементарная частица с массой, очень близкой к массе протона. Поскольку масса ядра складывается из массы протонов и нейтронов, то число нейтронов в ядре атома равно А — Z, где А — массовое число данного изотопа (см.Периодическая система химических элементов).
Так, например, в атоме кислорода 168О 8 протонов и 16-8=8 нейтронов, что кратко записывается 8p, 8n.
Заряд ядра – положительная, по величине равная количеству протов в ядре или электронов в нейтральном атоме и совпадает с порядковым номером элементов в периодической системе.
Природа устроена так, что один и тот же элемент может существовать в виде двух или нескольких изотопов. Изотопы отличаются друг от друга только числом нейтронов в ядре (числом N). Поскольку нейтроны практически не влияют на химические свойства элементов, все изотопы одного и того же элемента химически неотличимы
Атом любого химического элемента состоит из положительно заряженного ядра и окружающего его облака отрицательно заряженных электронов. Положение химического элемента в периодической системе Менделеева (его порядковый номер) определяется зарядом ядра его атомов.
Изотопами - называются разновидности одного и того же химического элемента, атомы которых имеют одинаковый заряд ядра (и, следовательно, практически одинаковые электронные оболочки), но отличаются значениями массы ядра. По образному выражению Ф.Содди, атомы изотопов одинаковы «снаружи», но различны «внутри».
Каждый изотоп принято обозначать набором символов , где X – символ химического элемента, Z – заряд ядра атома (число протонов), А – массовое число изотопа (общее число нуклонов – протонов и нейтронов в ядре, A = Z + N). N – нейтроны, А – атомное ядро.